Содержание
- 2. NO HNO NaOH HNO 2 3 К какому классу соединений относятся вещества, дать им названия
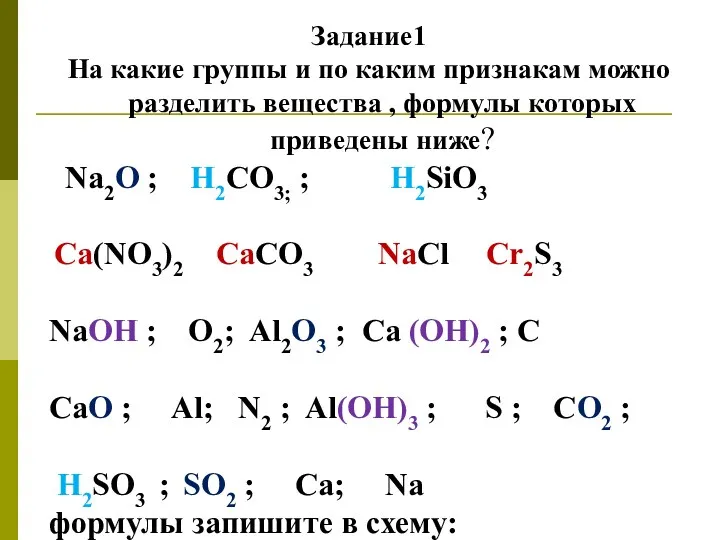
- 3. Задание1 На какие группы и по каким признакам можно разделить вещества , формулы которых приведены ниже?
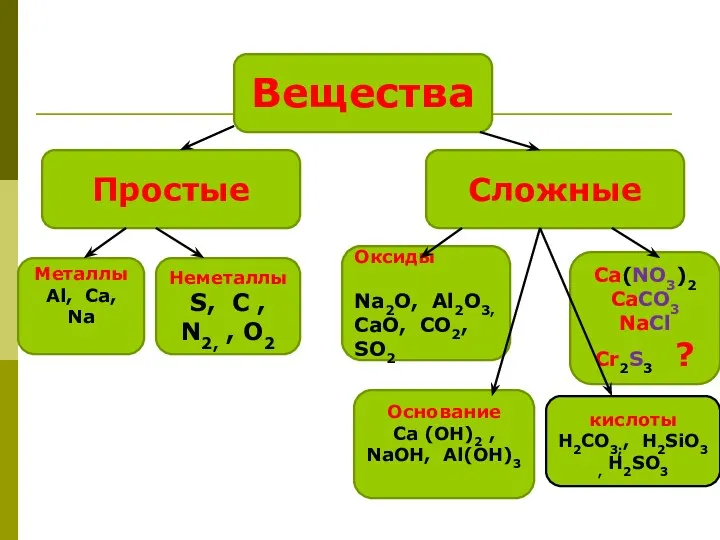
- 4. Вещества Простые Сложные Металлы Аl, Ca, Na Неметаллы S, С , N2, , О2 Оксиды Na2O,
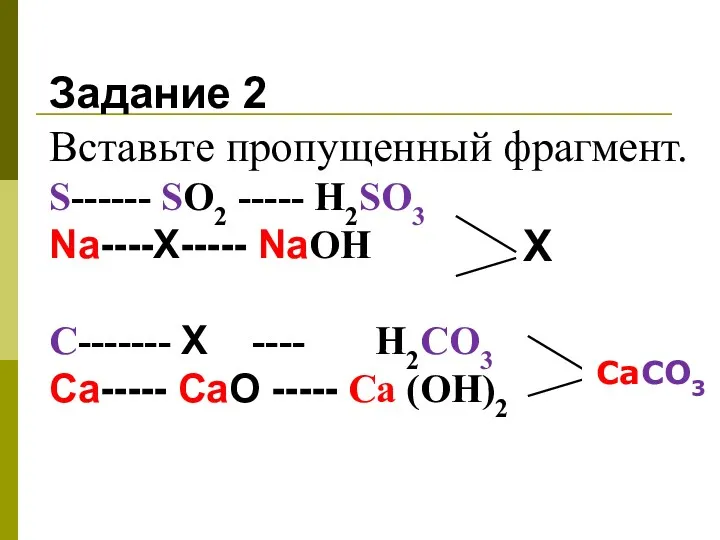
- 5. Задание 2 Вставьте пропущенный фрагмент. S------ SО2 ----- H2SO3 Na----Х----- NaОН С------- Х ---- H2CO3 Ca-----
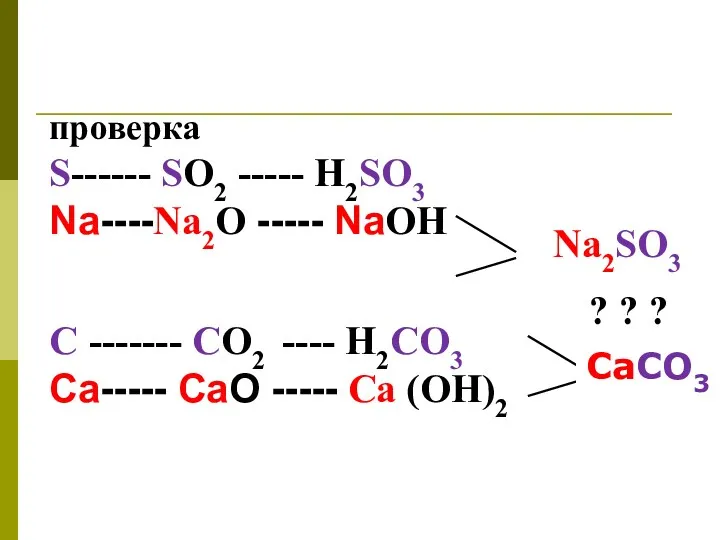
- 6. проверка S------ SО2 ----- H2SO3 Na----Na2O ----- NaОН ? ? ? С ------- СО2 ---- H2CO3
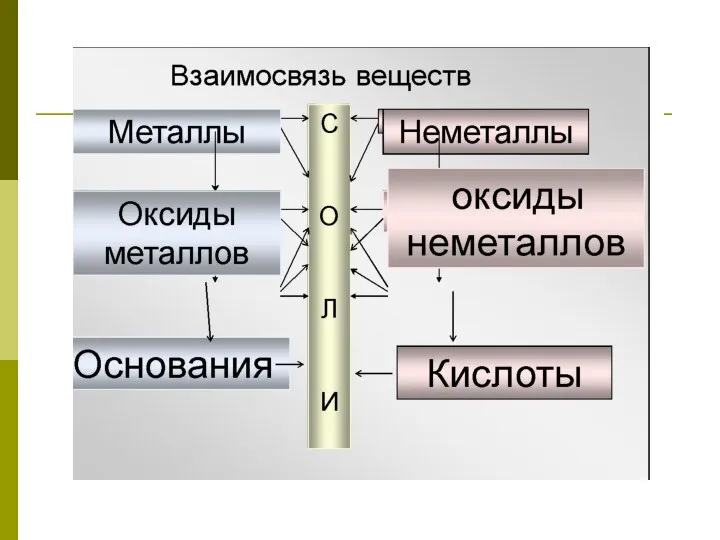
- 8. СОЛИ , как производные кислот и оснований.
- 9. Цель урока: Изучить состав, названия солей, классификацию, свойства и применение. План 1.Соли. Их состав и номенклатура
- 10. 1. Соли. Их состав и номенклатура (название).
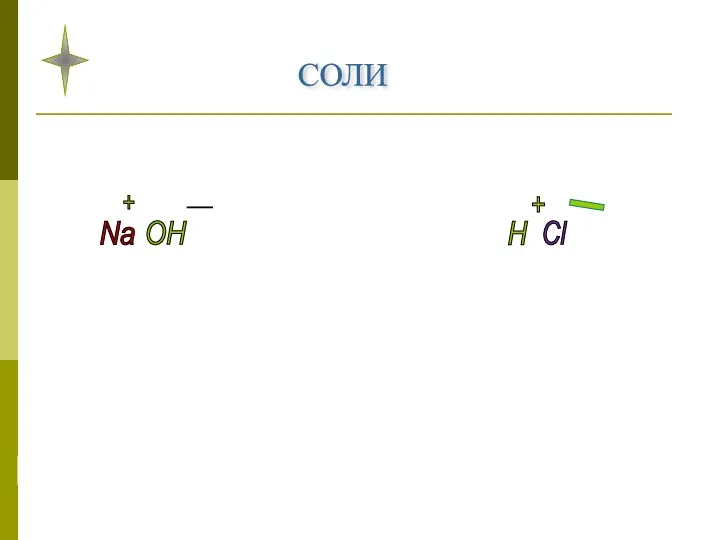
- 11. СОЛИ Na OH H Cl NaCl + - + _
- 12. Соли - это сложные вещества, которые состоят из ионов металла и кислотного остатка
- 13. 3 задание. Определить : почему у солей разное количество кислотных остатков Дайте обоснованный ответ. NaNO3 Ca
- 14. 3 задание. Na+1 Ca+2 Al+3 Имеют разную степень окисления. (см. таблицу растворимости)
- 15. задание 4. Определить : почему у солей разное количество ионов металла? Дайте обоснованный ответ. NaNO3 Na
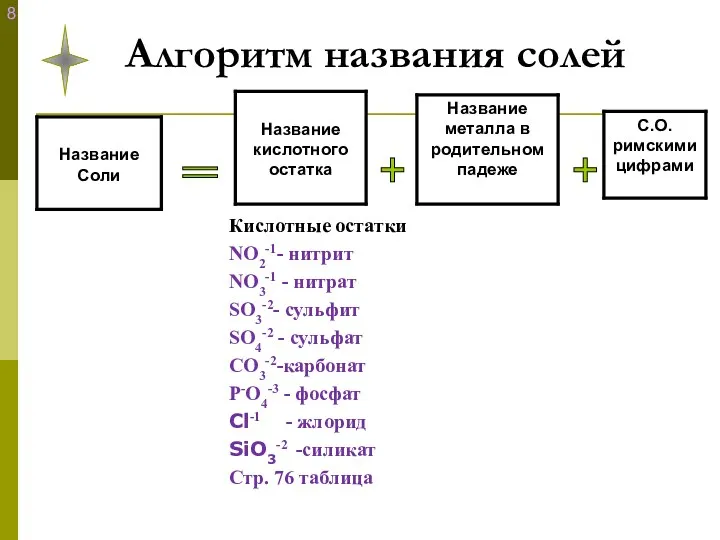
- 16. Так как кислотные остатки имеют свою степень окисления: (см. таблицу растворимости) NO2-1- нитрит NO3-1 - нитрат
- 17. Выведем общую формулу солей? Ме+n (К. О.-m)n
- 18. Алгоритм названия солей + + =
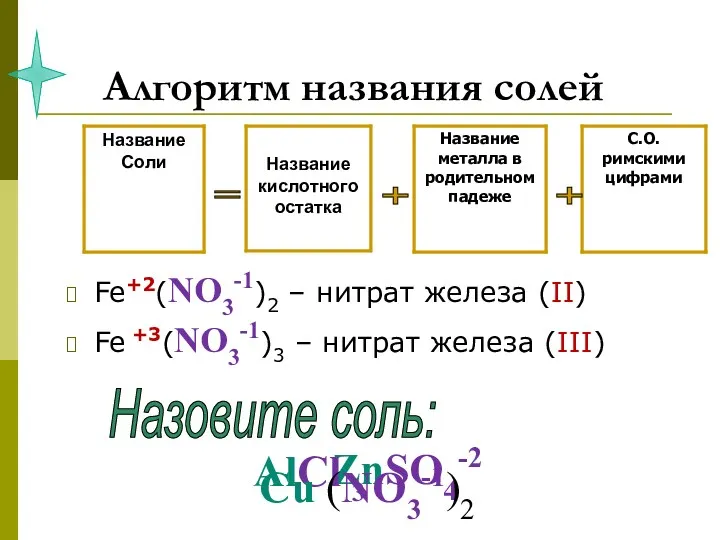
- 19. Алгоритм названия солей Fe+2(NO3-1)2 – нитрат железа (II) Fe +3(NO3-1)3 – нитрат железа (III) = +
- 20. задание 5. НАЗОВИТЕ СОЛИ NaCl Fe +2SO4 Al3(PO4)3 Ca(NO3)2 Cu+2CO3 Cr2+3S3 Na2SO4 Ba(NO3 )2
- 21. задание 5. НАЗОВИТЕ СОЛИ NaCl - хлорид натрия Fe +2SO4 - сульфат железа (II) Al3(PO4)3 –
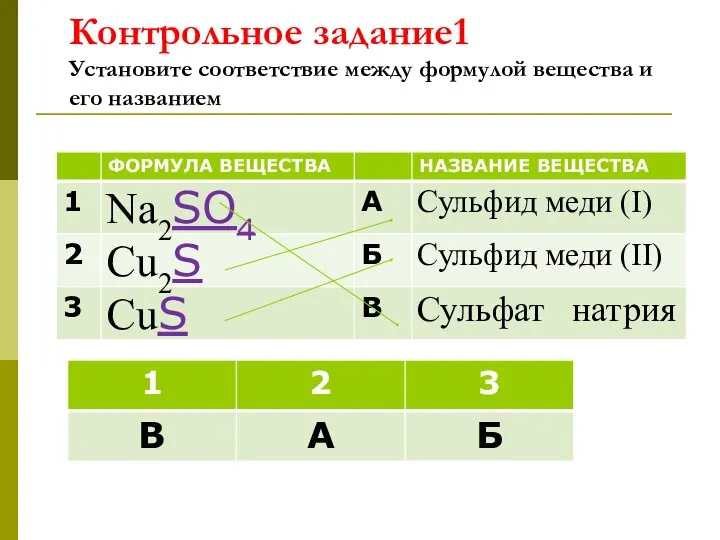
- 22. Контрольное задание1 Установите соответствие между формулой вещества и его названием
- 23. 2. Составление формул солей по их названиям.
- 24. 1. Запиши рядом знаки химических элементов, которые входят в состав вещества. Алгоритм составления формул солей: Составить
- 25. 2. Над знаками химических элементов поставь их степень окисления. Пример: Fe SO4 +3 -2 Второй пункт
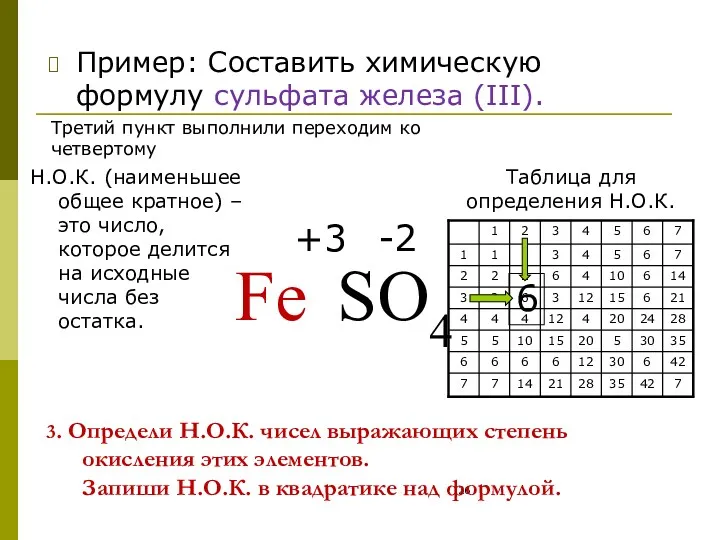
- 26. 3. Определи Н.О.К. чисел выражающих степень окисления этих элементов. Запиши Н.О.К. в квадратике над формулой. Пример:
- 27. 4. Раздели Н.О.К. на степень окисления каждого элемента. Запиши полученный индекс. Пример: Составить химическую формулу сульфата
- 28. Составить формулу сульфата алюминия: (второй способ) Составьте формулы: Упр. 3 стр. 78 Al 2 + SO
- 29. Составьте формулу хлорида кальция СаCl2 Составьте формулу нитрата натрия NaNO3 Zn(SO4)2 Cu NO3 Составьте формулу сульфата
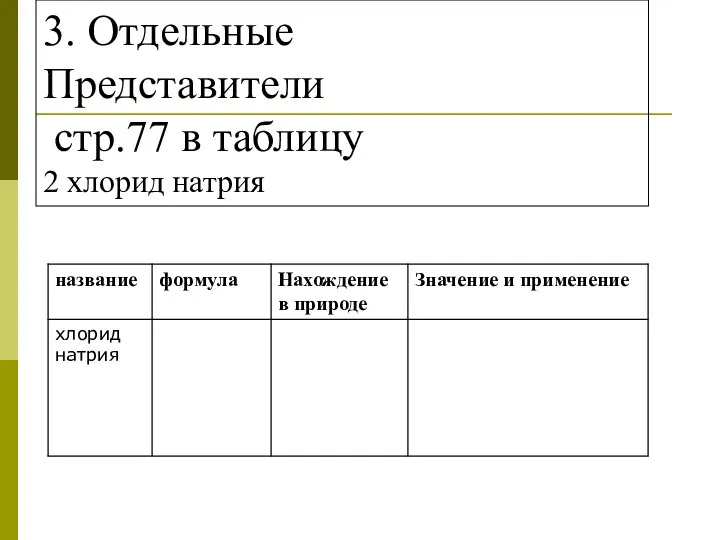
- 30. 3. Отдельные Представители стр.77 в таблицу 2 хлорид натрия
- 31. NaCl
- 32. "Среди всех природных минеральных солей, самая главная та, которую мы называем просто “соль” А.Е.Ферсман
- 33. За 4 года человек съедает пуд соли (в год человек с пищей потребляет 3-5,5 кг соли)
- 34. Соль в геральдике российских городов Герб Бахмута Герб Солигалича Герб Сольвычегодска Герб Энгельса Герб Усолья-Сибирского Герб
- 35. Добыча соли из соляных шахт из соленых озер
- 36. На озере Баскунчак ежегодно добывается около 5 млн. тонн соли
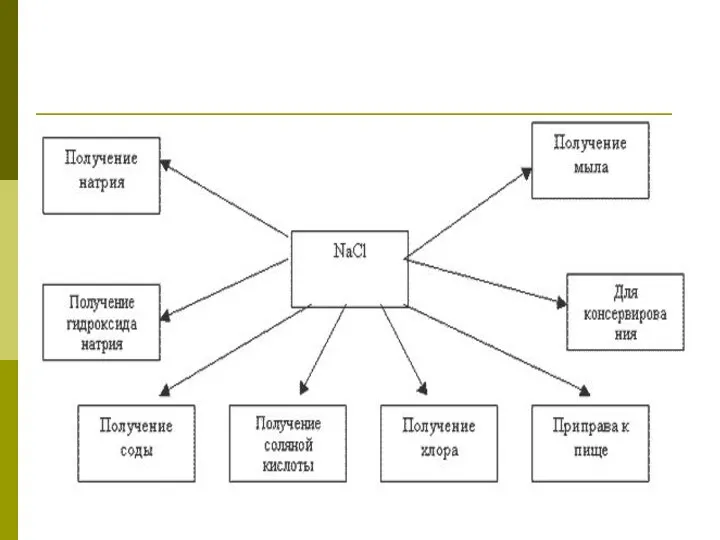
- 37. Применение NaCl
- 38. Д/З: CaCO3
- 39. Моллюски, раки, радиолярии, кораллы – все имеют известковый скелет
- 40. Большой Барьерный риф в Австралии
- 41. Меловые горы
- 42. Минералы карбоната кальция находятся в горных породах: Известняк Мел Мрамор Мрамор Мрамор Мрамор Травертин
- 43. Мрамор – строительный материал Единственное в России здание, полностью построенное из нешлифованного мрамора — железнодорожный вокзал
- 44. Д/З: Фосфат кальция - основа минералов фосфоритов и апатитов
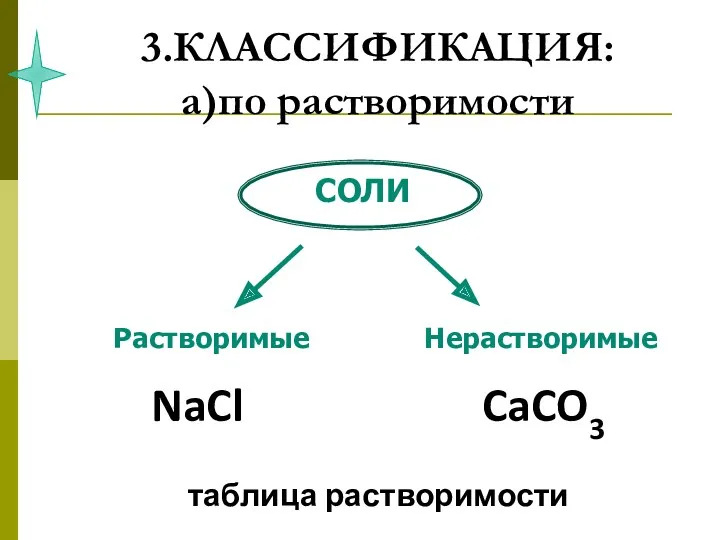
- 45. 3.КЛАССИФИКАЦИЯ: а)по растворимости
- 46. Лабораторный опыт. №1 Определите растворимость солей Для этого: -прибавьте в первую пробирку к хлориду натрия 5-10
- 47. 3.КЛАССИФИКАЦИЯ: а)по растворимости NaCl CaCO3 таблица растворимости
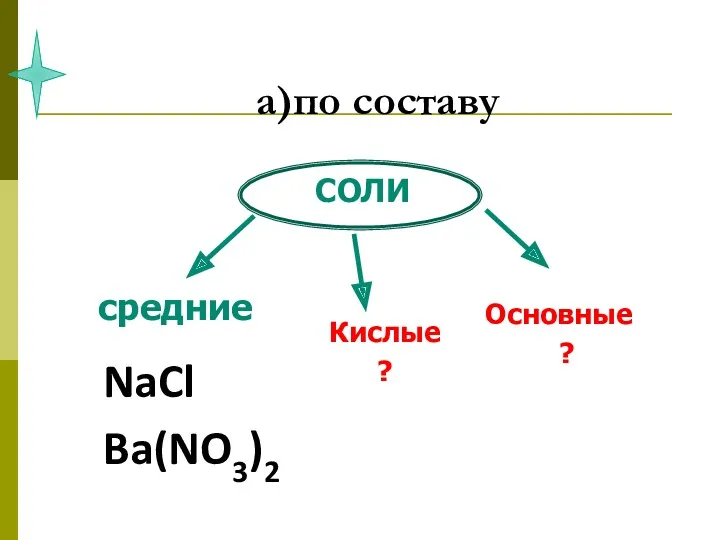
- 48. а)по составу
- 49. Лабораторный опыт. №2 Определите в какой из трех пробирок находятся кислота, в какой щелочь, в какой
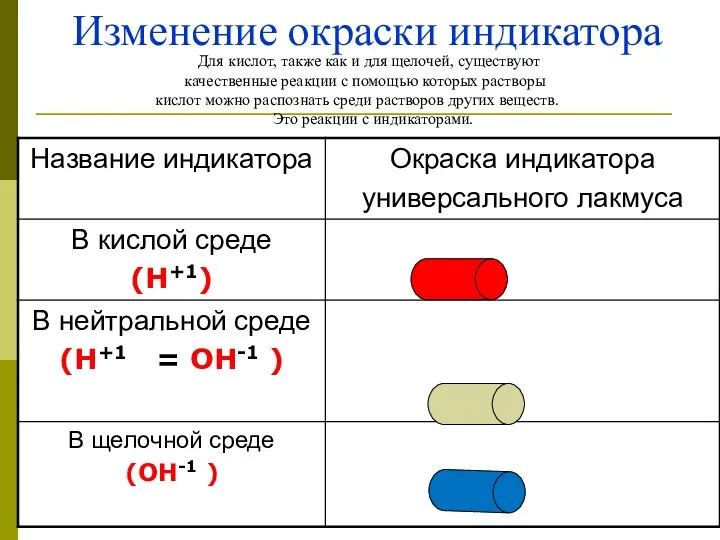
- 50. Изменение окраски индикатора Для кислот, также как и для щелочей, существуют качественные реакции с помощью которых
- 51. Контрольное задание3 Ответте на вопросы: 1.Какая окраска индикатора в растворе хлорида натрия. Почему? 2.Раствор хлорида натрия.
- 52. а)по составу NaCl Ba(NO3)2
- 53. Подведем итоги?
- 54. Контрольное задание - итоговое Часть А (задания с выбором ответа) 1. Соли – это сложные вещества:
- 55. Контрольное задание - итоговое Часть В Выбери лишнее вещество и объясни почему? Игра « Третий лишний»
- 56. Контрольное задание - итоговое Часть А Г А Часть В объясни почему? 1. NaCl. т.к… 2.
- 57. Домашнее задание §,21 упр.3 стр. 78 Составить презентацию фосфата кальция или опорный конспект в форме таблицы
- 59. Скачать презентацию






































 Алкоголсіз сусындарды өндіруге арналған шикізат
Алкоголсіз сусындарды өндіруге арналған шикізат Основные фонды предприятия
Основные фонды предприятия Англия в раннее Средневековье
Англия в раннее Средневековье Автономные системы навигации летательных аппаратов
Автономные системы навигации летательных аппаратов Город Сокол. Бюджет для граждан на 2016 год
Город Сокол. Бюджет для граждан на 2016 год Проект одномодельного технологічного потіку з виготовлення жакету жіночого з костюмних тканин
Проект одномодельного технологічного потіку з виготовлення жакету жіночого з костюмних тканин Правила дорожного движения
Правила дорожного движения Бизнес-кейс Илона Маска
Бизнес-кейс Илона Маска презентация А. С. Пушкин 1 часть для начальной школы 3 класс
презентация А. С. Пушкин 1 часть для начальной школы 3 класс Теория вероятностей и математическая статистика
Теория вероятностей и математическая статистика приглашение
приглашение Всеобщая декларация прав человека - идеал права
Всеобщая декларация прав человека - идеал права Технология разработки прогнозов разных уровней. Макроэкономическое прогнозирование
Технология разработки прогнозов разных уровней. Макроэкономическое прогнозирование Личная карта здоровья. Поставщики продукции Вивасан
Личная карта здоровья. Поставщики продукции Вивасан Мы за безопасность на дорогах
Мы за безопасность на дорогах Здравствуй, школа!
Здравствуй, школа! Урок 105 Сложение однозначных чисел с переходом через десяток
Урок 105 Сложение однозначных чисел с переходом через десяток Кижи
Кижи Радиосвязное оборудование воздушных судов
Радиосвязное оборудование воздушных судов Клинический случай
Клинический случай Ишемический инсульт
Ишемический инсульт Ветер
Ветер Строительство. Гигиенические требования к строительным материалам
Строительство. Гигиенические требования к строительным материалам Этапы компьютерного моделирования
Этапы компьютерного моделирования Инженерно- геологические изыскания при строительстве тоннелей
Инженерно- геологические изыскания при строительстве тоннелей Урок по теме Добро и зло
Урок по теме Добро и зло Православный этикет
Православный этикет Взаимодествие детей и воспитателя в образовательной области Социально- коммуникативное развитие
Взаимодествие детей и воспитателя в образовательной области Социально- коммуникативное развитие