Слайд 2

Слайд 3
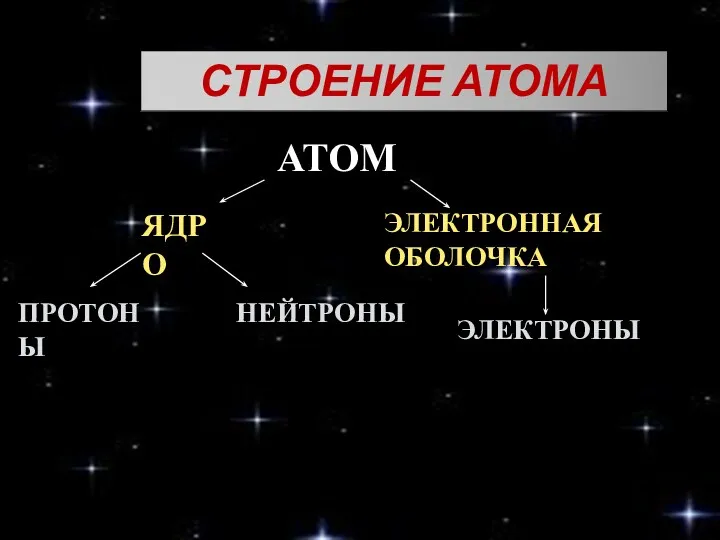
СТРОЕНИЕ АТОМА
АТОМ
СТРОЕНИЕ АТОМА
ЯДРО
ЭЛЕКТРОННАЯ ОБОЛОЧКА
ПРОТОНЫ
НЕЙТРОНЫ
ЭЛЕКТРОНЫ
Слайд 4

Теория
Число электронов, протонов и нейтронов в атоме.
Число электронов равно порядковому номеру
и числу протонов, число нейтронов равно разности между массовым числом и порядковым номером.
Слайд 5

ЗАДАНИЕ ПО ВАРИАНТАМ:
Определить количество é p+ n0 для атома
1вариант:
Mo
2вариант: Cd
Слайд 6

Слайд 7

Изотопы - разновидности атомов одного ХЭ, имеющие одинаковое число электронов и
протонов, но разную массу атома (разное число нейтронов).
Слайд 8

ЗАДАНИЕ:
а) Элемент 132Х, в ядре изотопа которого находится 76 нейтронов, –
это
1) сурьма; 2) барий; 3) гафний; 4) прометий.
Б) Число протонов и нейтронов в ядре атома изотопа 43Са равно
р = 40, n = 43; 3) p = 20, n = 43;
2) p =20, n = 23; 4) p = 20, n = 20
Слайд 9

Электронное строение атома
Максимальное число электронов на уровнях.
Максимальное число электронов на уровнях
определяется по формуле N= 2· n2.
1 уровень – 2, 2 уровень – 8, 3 уровень - 18, 4 уровень – 32.
s-, p- и d- элементы
s-элементы расположены в I и II А-группах;
p- элементы в III –VIII А –группах;
d- элементы в I- VIII В группах.
Порядок заполнения электронами Е уровней и орбиталей в атомах
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
Слайд 10

ЗАДАНИЕ:
А) Электронная конфигурация соответствующая атому цинка?
Б) Формула водородного соединения элемента с
электронной конфигурацией атома
1s22s22p63s23p64s23d104p65s24d105p3
ЭН 2) ЭН2
3) ЭН3 4) ЭН5
Слайд 11

Строение электронных оболочек ионов
У катиона – меньше электронов на величину заряда,
у анионов - больше на величину заряда.
Например:
Na0 - 11 электронов, Na+ - 10 электронов;
P0 – 15 электронов, P3- - 18 электронов.
Слайд 12

ЗАДАНИЕ:
Электронная конфигурация
1s22s22p63s23p6 соответствует частице
1) N3- 2) Ca2+ 3) F-
4) Al3+
Слайд 13

Закономерности изменения химических свойств элементов и их соединений по периодам и
группам.
Горизонтальная периодичность.
В периоде слева направо:
- заряды атомных ядер увеличиваются;
- число электронов на внешнем электронном слое увеличивается;
- число электронных слоёв не изменяется;
- радиус атомов уменьшается;
- ЭО увеличивается;
- металлические свойства уменьшаются,
- неметаллические свойства увеличиваются;
- основные свойства соединений (оксидов, гидроксидов) уменьшаются, сменяются амфотерными, - кислотные свойства (оксидов, кислот) увеличиваются.
Слайд 14

Вертикальная периодичность
В А - группе сверху вниз:
-заряды атомных ядер увеличиваются;
- число
электронов на внешнем электронном слое не изменяется;
- число электронных слоёв увеличивается;
- радиус атомов увеличивается;
- ЭО уменьшается;
- металлические свойства увеличиваются,
- неметаллические свойства уменьшаются;
- основные свойства соединений (оксидов, гидроксидов) увеличиваются,
- кислотные свойства соединений (оксидов, кислот) уменьшаются.













 Роль самоподготовки в режиме деятельности группы продлённого дня
Роль самоподготовки в режиме деятельности группы продлённого дня Горные породы, классификация их свойств
Горные породы, классификация их свойств Нелинейные модели парной регрессии
Нелинейные модели парной регрессии Викторина по сказке Г.Х.Андерсена Бузинная матушка
Викторина по сказке Г.Х.Андерсена Бузинная матушка Художественная обработка древесины. Мозаика. 7 класс
Художественная обработка древесины. Мозаика. 7 класс Арифметико-логические устройства, микропроцессоры
Арифметико-логические устройства, микропроцессоры Некоторые приемы работы со сборками. Конструирование сборки сверху вниз
Некоторые приемы работы со сборками. Конструирование сборки сверху вниз презентация ППРС
презентация ППРС Моделирование юбок на основе прямой юбки
Моделирование юбок на основе прямой юбки Клещевой энцефалит
Клещевой энцефалит Я Научу Тебя Творить
Я Научу Тебя Творить Презентация. Философия. Тема 6. Социальная философия (1)
Презентация. Философия. Тема 6. Социальная философия (1) Угрозы информационной безопасности
Угрозы информационной безопасности Социальная реклама. Разработка социальной кампании по защите окружающей среды от мусора
Социальная реклама. Разработка социальной кампании по защите окружающей среды от мусора Моё хобби
Моё хобби Мелиорация. Виды мелиораций
Мелиорация. Виды мелиораций Авиастроение и авиационный транспорт
Авиастроение и авиационный транспорт Особенности консультирования одаренных детей и подростков
Особенности консультирования одаренных детей и подростков Недвижимость для дальновидных инвесторов
Недвижимость для дальновидных инвесторов Грыжи живота
Грыжи живота Повышение эффективности ТЭУ
Повышение эффективности ТЭУ Игра Архитектурные ансамбли Петербурга
Игра Архитектурные ансамбли Петербурга 20231008_zreloe_i_pozdnee_srednevekove
20231008_zreloe_i_pozdnee_srednevekove Похвальное слово знакам препинания
Похвальное слово знакам препинания Презентация Золотые рыбки в технике оригами
Презентация Золотые рыбки в технике оригами Нотариальное производство. (Лекция 3)
Нотариальное производство. (Лекция 3) Проект строительства житлового комплекса в г. Ялта (2018 г.)
Проект строительства житлового комплекса в г. Ялта (2018 г.) Подготовка к ОГЭ: задача 18 (логика)
Подготовка к ОГЭ: задача 18 (логика)