Содержание
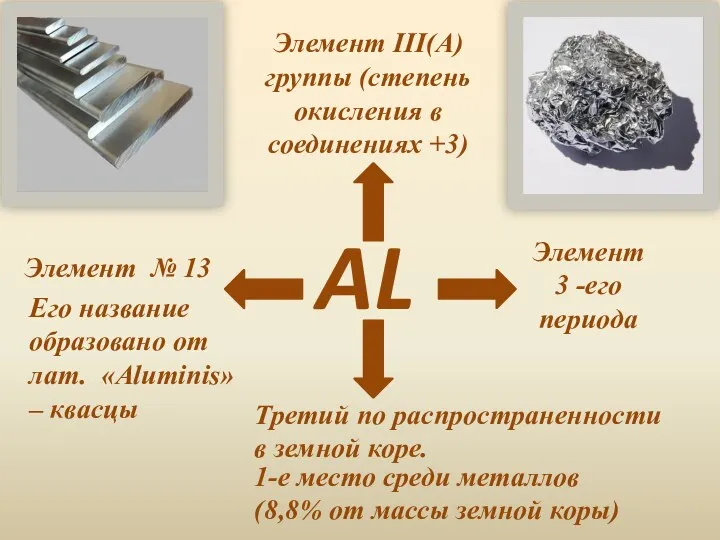
- 2. AL Элемент III(A) группы (степень окисления в соединениях +3) Элемент № 13 Элемент 3 -его периода
- 3. Датский физик Ганс Эрстед (1777-1851) Впервые алюминий был получен им в 1825 году действием амальгамы калия
- 4. Будучи студентом Оберлинского колледжа, он узнал, что можно разбогатеть и получить благодарность человечества, если изобрести способ
- 5. Современное получение алюминия Современный метод получения был разработан независимо друг от друга: американцем Чарльзом Холлом и
- 6. Поль Эру (1863-1914) – французский инженер - химик В 1889 году открыл алюминиевый завод во Фроне
- 7. Нахождение в природе Важнейшими на сегодня минералами алюминия являются бокситы и глины Основным химическим их компонентом
- 8. Физические свойства мягкий легкий (с малой плотностью – 2,7 г/см3) с высокой тепло- и электропроводностью легкоплавкий
- 9. с серой, образуя сульфид алюминия: 2Al + 3S = Al2S3 с азотом, образуя нитрид алюминия: 2Al
- 10. Химические свойства 1. С водой (после удаления защитной оксидной пленки) 2Al + 6H2O = 2Al(OH)3 +
- 11. Соединения алюминия встречаются не только на Земле, но и на Луне и Марсе. Самое древнее изделие,
- 12. Алюминий найдет свое место и в производстве новой так называемой «умной» одежды. Уже сейчас производители создали
- 13. Вставьте пропущенные слова в текст: Проверьте себя: Алюминий – это металл, у которого в соединениях степень
- 14. Какие из соединений вступят в реакцию с алюминием: Cl2 K2O CuSO4 H2O S BaSO4 HCL Cr
- 16. Скачать презентацию












 Забайкальский край
Забайкальский край Познавательное развитие дошкольников с задержкой психического развития
Познавательное развитие дошкольников с задержкой психического развития Зрительный анализатор. Подготовка к ЕГЭ
Зрительный анализатор. Подготовка к ЕГЭ Протон и нейтрон. Строение ядра
Протон и нейтрон. Строение ядра Педагогическая технология формирования культурно-гигиенических навыков
Педагогическая технология формирования культурно-гигиенических навыков Классный час Спорт-против наркотиков
Классный час Спорт-против наркотиков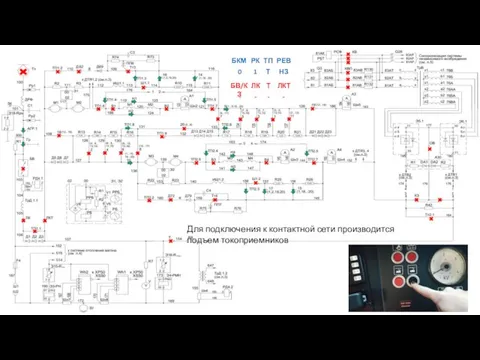 ЭП2Д. Схема электрическая силовая
ЭП2Д. Схема электрическая силовая English school
English school Сборка игрушки из помпонов
Сборка игрушки из помпонов Стратегия развития туризма в РФ
Стратегия развития туризма в РФ Основы проектирования и оборудования предприятий тонкого органического синтеза
Основы проектирования и оборудования предприятий тонкого органического синтеза Инструменты графического редактора Paint в Windows 7
Инструменты графического редактора Paint в Windows 7 20230904_prof
20230904_prof Развивающая среда в группе детей третьего года жизни
Развивающая среда в группе детей третьего года жизни Трубчатые печи. Классификация и принцип работы трубчатых печей
Трубчатые печи. Классификация и принцип работы трубчатых печей Forums_INGOs
Forums_INGOs Кровь. Состав и функции ДО
Кровь. Состав и функции ДО Ювелирное дело
Ювелирное дело Перечень и комплектность документов на ИС согласно ЕСПД и ЕСКД. Понятия и задачи документирования
Перечень и комплектность документов на ИС согласно ЕСПД и ЕСКД. Понятия и задачи документирования Возникновение государственности у славян. Образование древнерусского государства
Возникновение государственности у славян. Образование древнерусского государства Гидравлическое сопротивление в трубопроводах
Гидравлическое сопротивление в трубопроводах Дисграфия.Коррекция и предупреждение.
Дисграфия.Коррекция и предупреждение. Консерві кәсіпорнының өндірістік қуаты және жұмыс істеу режимі
Консерві кәсіпорнының өндірістік қуаты және жұмыс істеу режимі Арон Ралстон
Арон Ралстон Народная кукла, как средство приобщения детей дошкольного возраста к русской традиционной культуре
Народная кукла, как средство приобщения детей дошкольного возраста к русской традиционной культуре Артикуляционная гимнастика для постановке шипящих звуков.
Артикуляционная гимнастика для постановке шипящих звуков. Игорь Васильев. Первые 50 лет
Игорь Васильев. Первые 50 лет Федеральный проект Цифровая культура
Федеральный проект Цифровая культура