Содержание
- 2. Блиц - опрос В декабре, в декабре Все деревья в серебре, Нашу речку, словно в сказке,
- 3. На рукомойнике моем Позеленела медь. Но так играет луч на нем, Что весело глядеть. А.Ахматова
- 4. ВОПРОСЫ Какие типы реакций по числу и составу веществ вы знаете? Дать определения всем типам реакций.
- 5. Определите тип реакций: CaCO3 = CaO + CO2 H2 + N2 = NH3 Mg + ZnCl2
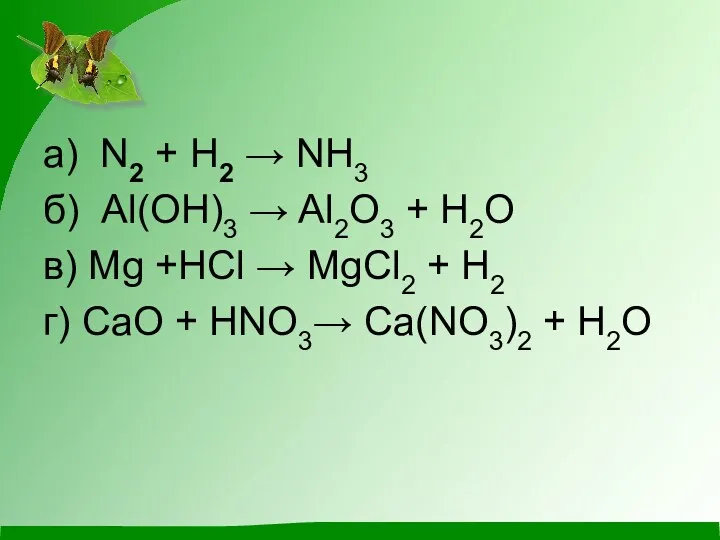
- 6. а) N2 + H2 → NH3 б) Al(OH)3 → Al2O3 + H2O в) Mg +HCl →
- 7. Конкурс капитанов
- 8. «кто быстрее» Карбонат кальция. Соляная кислота. Сульфат меди (II). Высшая степень окисления серы. Низшая степень окисления
- 9. Найдите соответствие: 1. Мg(OH)2 = MgO + H2O A) Реакция соединения 2. CuO + H2 =
- 10. Расставьте коэффициенты в следующих уравнениях реакций. Определите типы реакций: СаСО3 → СаО + CO2 Na2SO4 +
- 11. Напишите уравнения реакций по названиям исходных веществ и продуктов реакций. Определите типы реакций. Сульфат магния +
- 12. Дидактические карточки к самостоятельной работе I вариант Магний + кислород = оксид магния Цинк + соляная
- 13. Решение к самостоятельной работе I вариант 2Mg + O2 = 2MgO соединения Zn + 2HCl =
- 14. Домашнее задание: 1. Повторить &25 – 33 №1 (б,в) стр159 2. Повторить формулы нахождения количества вещества
- 15. Рефлексия. Теперь я знаю, что … 2. Теперь я знаю как … 3. Теперь я умею
- 17. Скачать презентацию













 Магазин промышленных товаров
Магазин промышленных товаров Презентация Пальчиковый игротренинг для детей дошкольного возраста.
Презентация Пальчиковый игротренинг для детей дошкольного возраста. Ерлер денсаулығын сақтау
Ерлер денсаулығын сақтау Приключения Тома Сойера. Марк Твен
Приключения Тома Сойера. Марк Твен The Geographical Position and Nature of Great Britain. Basic Facts
The Geographical Position and Nature of Great Britain. Basic Facts Презентация Мурманск- город-герой
Презентация Мурманск- город-герой Сборник презентаций Онлайн - раскраска для познавательного развития ребенка дошкольного возраста
Сборник презентаций Онлайн - раскраска для познавательного развития ребенка дошкольного возраста Формирование целевых ориентиров дошкольного образования в условиях ФГОС, требования по обеспечению надёжности и безопасности их использования.
Формирование целевых ориентиров дошкольного образования в условиях ФГОС, требования по обеспечению надёжности и безопасности их использования. Психические процессы внимание
Психические процессы внимание ТБ в кабинете информатики
ТБ в кабинете информатики Презентация Кабинет кубановедения
Презентация Кабинет кубановедения Невербальная коммуникация
Невербальная коммуникация Презентация к беседе Воздух, которым мы дышим
Презентация к беседе Воздух, которым мы дышим Классные часы
Классные часы Технологии управления космическим аппаратом Буран и их использование в наземном автоматизированном комплексе управления
Технологии управления космическим аппаратом Буран и их использование в наземном автоматизированном комплексе управления Самые роскошные поезда мира
Самые роскошные поезда мира Устройства ввода Джойстик (геймпад)
Устройства ввода Джойстик (геймпад) Новые методы
Новые методы Презентация по педагогическому познавательно-творческому проекту на тему: Осень золотая
Презентация по педагогическому познавательно-творческому проекту на тему: Осень золотая Менеджер глазами будущего руководителя
Менеджер глазами будущего руководителя Методы организации строительного производства
Методы организации строительного производства Общая собственность на приватизированное жилище
Общая собственность на приватизированное жилище Образование, наука, техника и технологии. Методы научного познания
Образование, наука, техника и технологии. Методы научного познания Анкета. Колледж
Анкета. Колледж 8 класс. Озера России
8 класс. Озера России Лечение наркомании
Лечение наркомании Введение в гистологию. История науки
Введение в гистологию. История науки Праздник птиц
Праздник птиц