Содержание
- 2. Назначение презентации Презентация предназначена для использования в качестве наглядного материала при изучении темы «Кислоты» на уроках
- 3. Преимущества презентации Содержит опорные схемы, способствующие быстрому запоминанию учащимися учебного материала; Содержит анимацию «Изменение окраски индикаторов»,
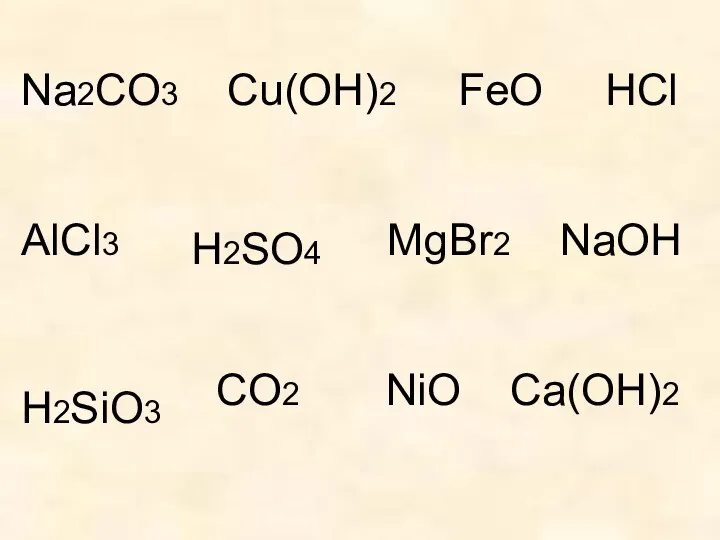
- 4. Na2CO3 Cu(OH)2 FeO AlCl3 MgBr2 NaOH CO2 NiO Ca(OH)2 HCl H2SO4 H2SiO3
- 5. КИСЛОТЫ Тема урока
- 6. Цель урока: познакомиться с классификациями и общими химическими свойствами кислот.
- 7. План урока Классификации кислот Физические свойства кислот Химические свойства кислот
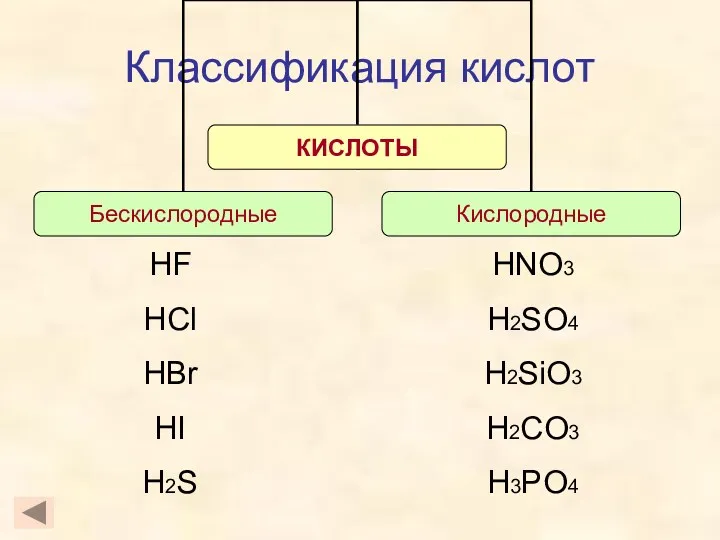
- 8. Классификация кислот HF HCl HBr HI H2S HNO3 H2SO4 H2SiO3 H2CO3 H3PO4
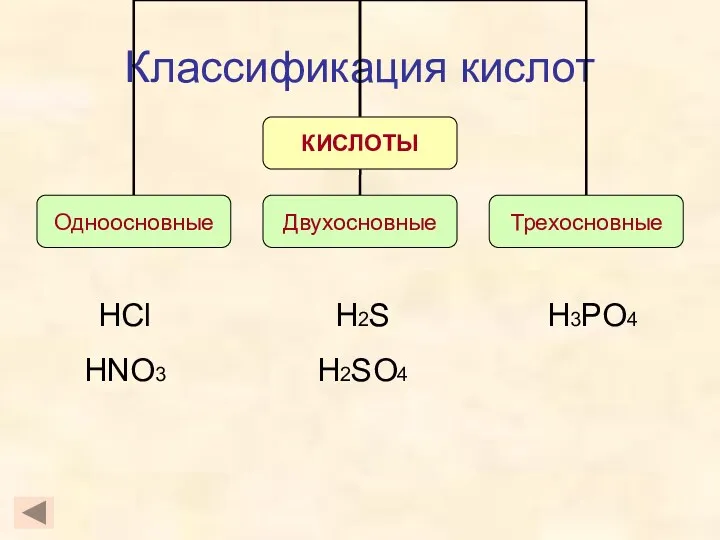
- 9. Классификация кислот HCl HNO3 H3PO4 H2S H2SO4
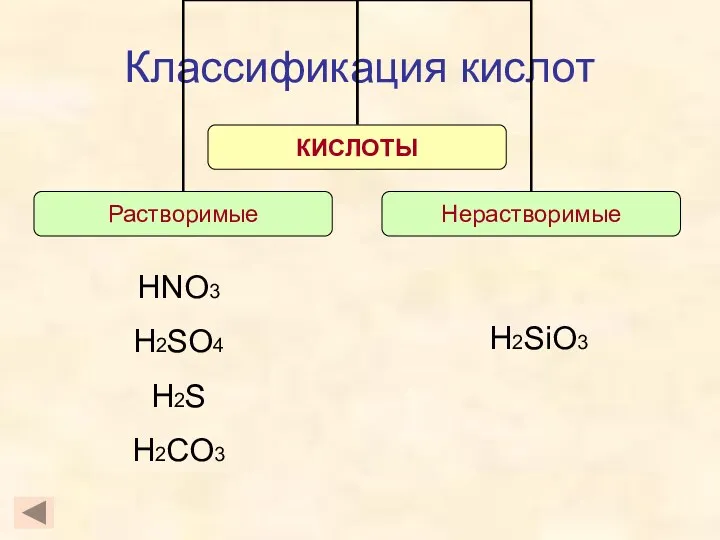
- 10. Классификация кислот H2SiO3 HNO3 H2SO4 H2S H2CO3
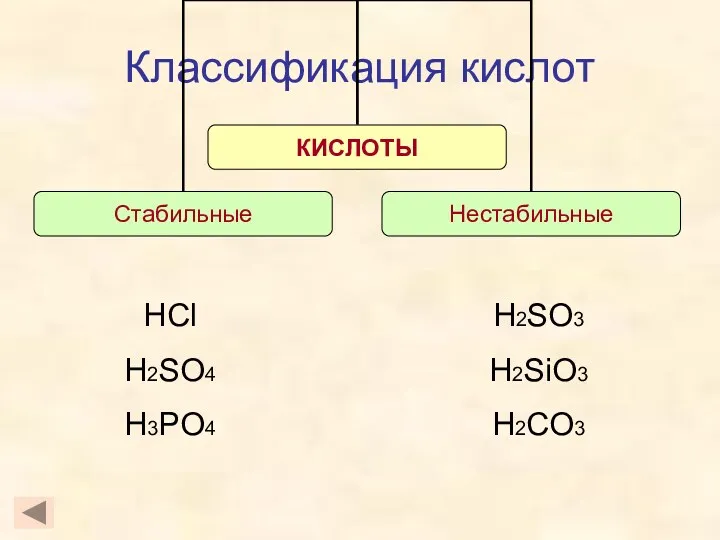
- 11. Классификация кислот HCl H2SO4 H3PO4 H2SO3 H2SiO3 H2CO3
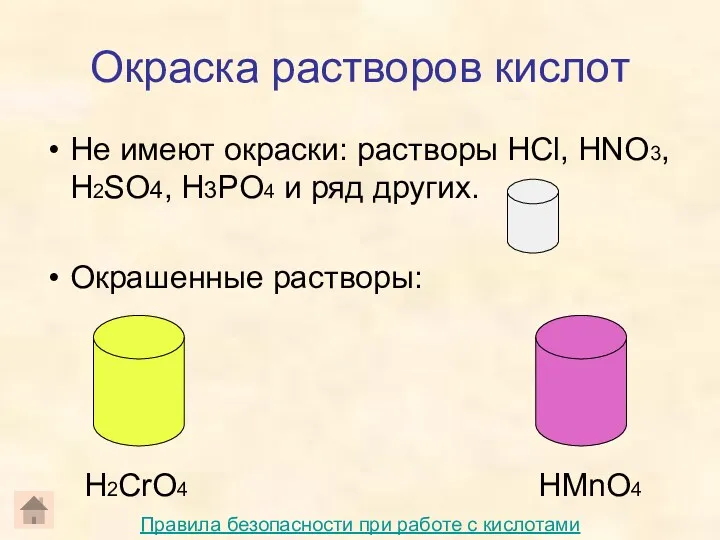
- 12. Окраска растворов кислот Не имеют окраски: растворы HCl, HNO3, H2SO4, H3PO4 и ряд других. Окрашенные растворы:
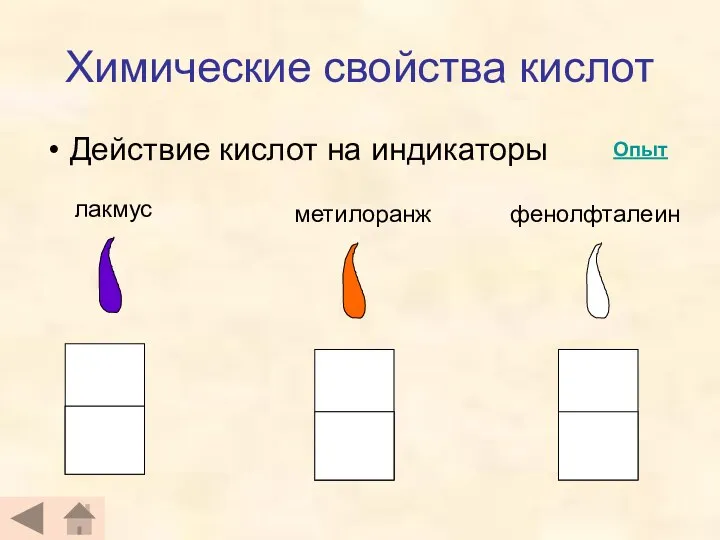
- 13. Химические свойства кислот Действие кислот на индикаторы лакмус метилоранж фенолфталеин Опыт
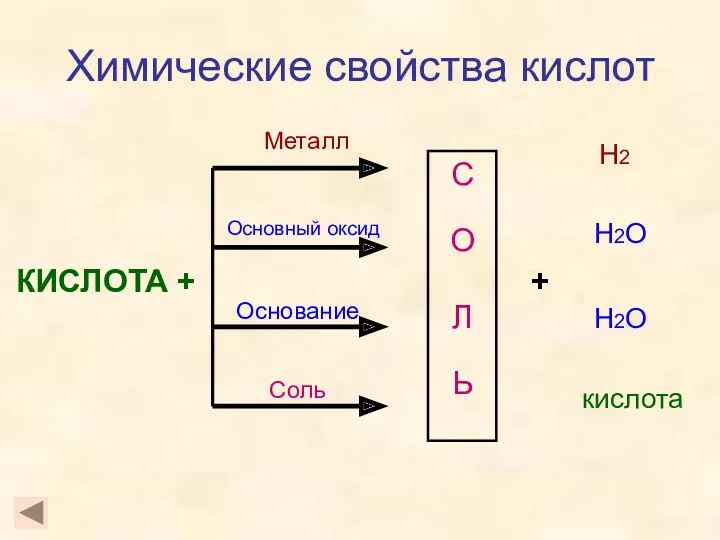
- 14. Химические свойства кислот КИСЛОТА + С О Л Ь Металл Основный оксид Основание Соль + Н2
- 15. Химические свойства кислот Кислота + металл = соль + водород Ряд активности металлов: Li K Ba
- 16. Химические свойства кислот Кислота + основный оксид = соль + вода Опыт. Взаимодействие оксида меди (Опыт.
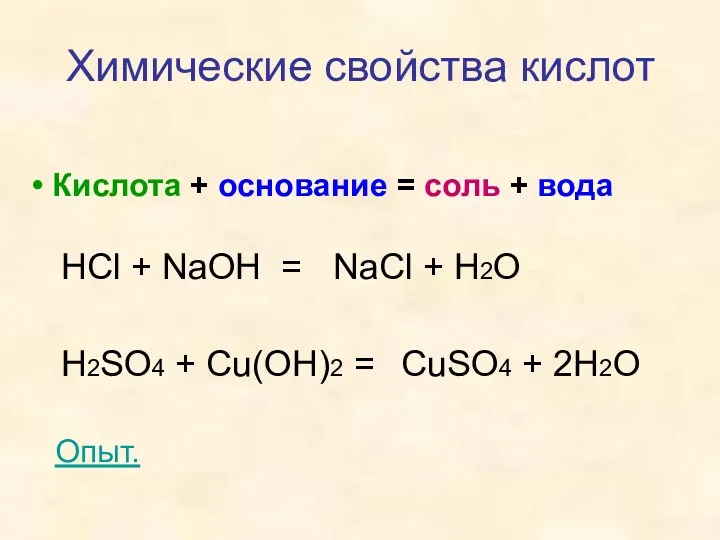
- 17. Кислота + основание = соль + вода Химические свойства кислот HCl + NaOH = H2SO4 +
- 18. Химические свойства кислот Кислота 1 + соль 1 = соль 2 + Кислота 2 Условия реакции:
- 19. Составьте возможные уравнения реакций взаимодействия перечисленных веществ с раствором серной кислоты.
- 20. Спасибо за внимание!
- 22. Скачать презентацию










 Коклюш. Паракоклюш
Коклюш. Паракоклюш Трехкомпонентные системы
Трехкомпонентные системы Выражение и его значение. Порядок выполнения действий. Равенства и неравенства
Выражение и его значение. Порядок выполнения действий. Равенства и неравенства Крымская весна. Лекция 13
Крымская весна. Лекция 13 Что изучают в курсе География материков и океанов?
Что изучают в курсе География материков и океанов? Моделирование и конструирование одежды промышленного производства
Моделирование и конструирование одежды промышленного производства А. И. Куприн Куст сирени
А. И. Куприн Куст сирени The indefinite article (a/an) - неопределенный артикль
The indefinite article (a/an) - неопределенный артикль Строение атома
Строение атома Современные проблемы сохранения КОТР Журавлиная родина: новые реалии XXI века
Современные проблемы сохранения КОТР Журавлиная родина: новые реалии XXI века Основные виды PR-мероприятий
Основные виды PR-мероприятий Прочность бетона
Прочность бетона Аппликация кораблик. Поэтапное изготовление
Аппликация кораблик. Поэтапное изготовление Мониторинг народная игротерапия
Мониторинг народная игротерапия Профессиональная этика педагога. Закон Об образовании РФ, ФГОСы, ПСП и ФОСы
Профессиональная этика педагога. Закон Об образовании РФ, ФГОСы, ПСП и ФОСы Абсолютные и относительные величины
Абсолютные и относительные величины Музыкальный фотоальбом Времена года-зима.
Музыкальный фотоальбом Времена года-зима. Возможности и варианты активизации инновационных процессов НГК РФ в условиях санкций
Возможности и варианты активизации инновационных процессов НГК РФ в условиях санкций Компьютерная презентация Путешествие в Африку
Компьютерная презентация Путешествие в Африку Японская национальная валюта йена
Японская национальная валюта йена Исследование функции. Построение графиков
Исследование функции. Построение графиков Русское национальное блюдо Ватрушки
Русское национальное блюдо Ватрушки Живой Журнал: инструкция по эксплуатации
Живой Журнал: инструкция по эксплуатации دیمر کارکرد عملکرد
دیمر کارکرد عملکرد Лесной пожар
Лесной пожар Внутренняя энергия и энтальпия
Внутренняя энергия и энтальпия Современные теории психопатологии личности
Современные теории психопатологии личности Презентация совместной деятельности педагога с детьми и детей с родителями Фестиваль пасхальных посиделок
Презентация совместной деятельности педагога с детьми и детей с родителями Фестиваль пасхальных посиделок