Содержание
- 2. Занимательные опыты Обугливание сахара Пламя-художник "Вода" зажигает костер
- 3. Я растворю любой металл. Меня алхимик получал В реторте глиняной простой. Слыву я главной кислотой... Когда
- 4. «Сами, трудясь, Вы сделаете все для близких людей и для себя, а если при труде успеха
- 5. Цель урока: познакомиться с историей открытия серной кислоты и распространением ее в природе; изучить химические и
- 6. Содержание 1. История открытия 2. Серная кислота в природе 3. Физические свойства 4. Химические свойства а)
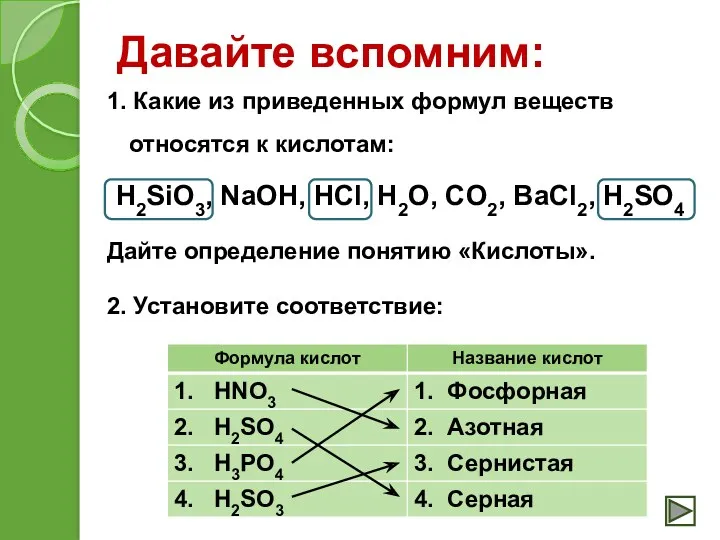
- 7. Давайте вспомним: 1. Какие из приведенных формул веществ относятся к кислотам: H2SiO3, NaOH, HCl, H2O, CO2,
- 8. 3. В предложенных рядах исключите «лишнее вещество». Объясните свой выбор: а. NaOH, KOH, HCl; б. H2SO4,
- 9. История открытия 1. Первое упоминание – алхимик Гебер (при нагревании квасцов перегоняется «спирт», обладающий сильной растворя-
- 10. Серная кислота в природе Кислотное озеро на глубине вулкана Малый Семячик Кипящее озеро (Курильские острова) Европа
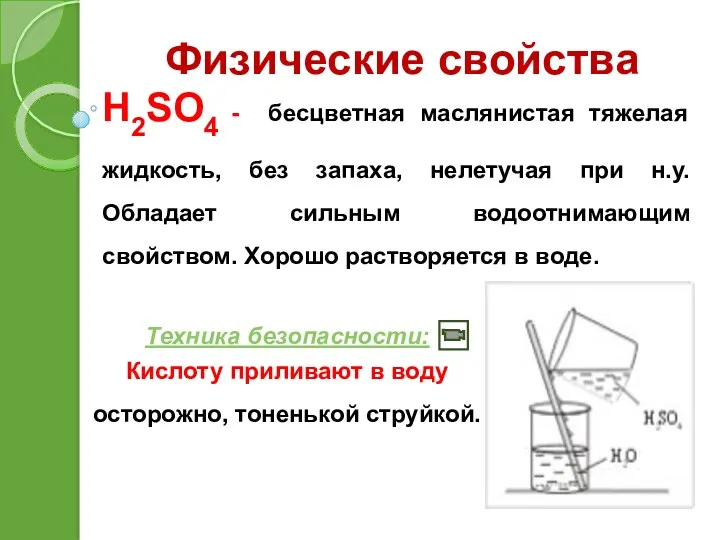
- 11. Физические свойства H2SO4 - бесцветная маслянистая тяжелая жидкость, без запаха, нелетучая при н.у. Обладает сильным водоотнимающим
- 12. Разбавление серной кислоты
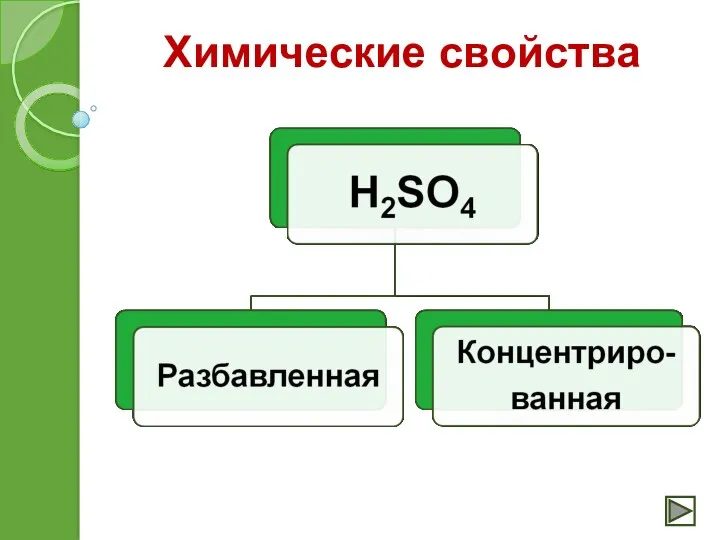
- 13. Химические свойства
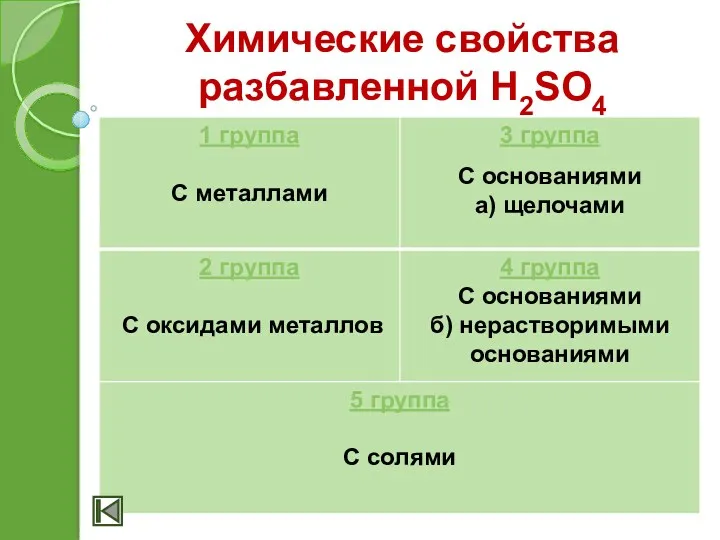
- 14. Химические свойства разбавленной H2SO4
- 15. Химические свойства разбавленной H2SO4 1. Взаимодействие с металлами (Стоящими до Н в ЭРНМ) Zn + H2SO4
- 16. Химические свойства разбавленной H2SO4 2. Взаимодействие с основными и амфотерными оксидами H2SO4 + CuO = CuSO4
- 17. Химические свойства разбавленной H2SO4 3. Взаимодействие с основаниями: а) щелочами H2SO4 + 2NaOH = Na2SO4 +
- 18. Химические свойства разбавленной H2SO4 4. Взаимодействие с солями H2SO4 + BaCl2 = BaSO4↓+ 2HCl 2H+ +
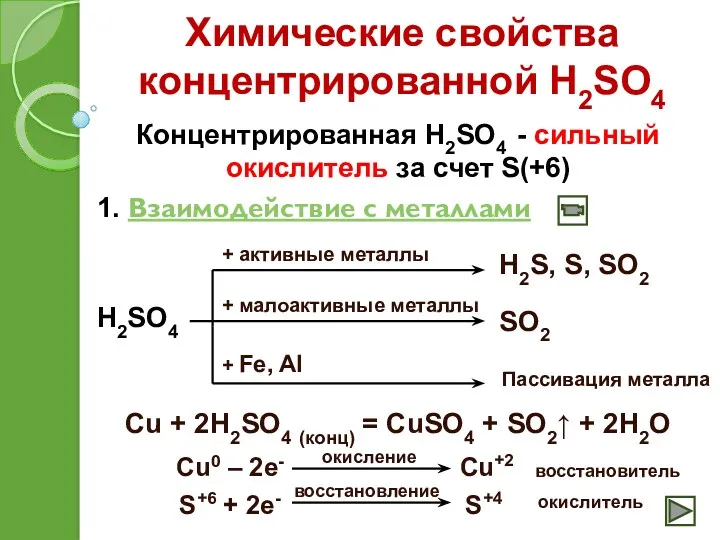
- 19. Химические свойства концентрированной H2SO4 Концентрированная H2SO4 - сильный окислитель за счет S(+6) 1. Взаимодействие с металлами
- 20. Взаимодействие концентрированной серной кислоты с металлами
- 21. Химические свойства концентрированной H2SO4 2. Взаимодействие с неметаллами 2H2SO4 + C = CO2 + 2SO2 +
- 22. Гигроскопичность серной кислоты
- 23. Применение H2SO4 HNO3 Производство кислот Взрывчатые вещества Электролитическая медь Минеральные удобрения Лекарства Производство солей Искусственный шелк
- 24. Соли серной кислоты
- 25. Тест 1. Концентрированная серная кислота при комнатной температуре не действует на каждое из двух веществ: А)
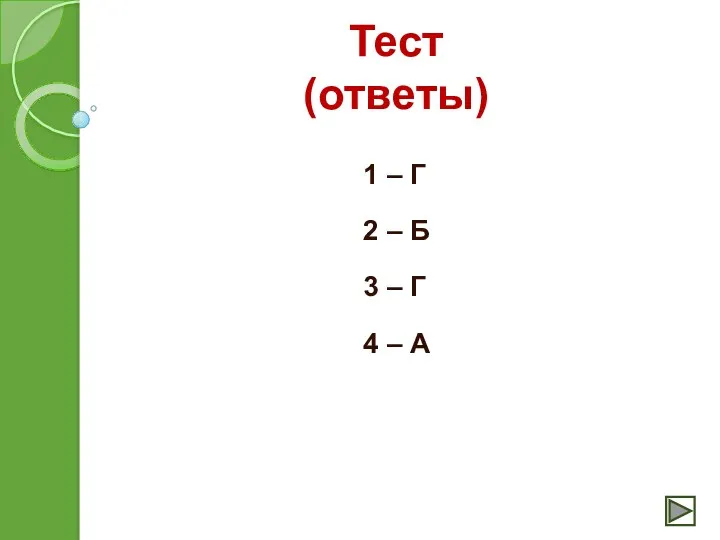
- 26. Тест (ответы) 1 – Г 2 – Б 3 – Г 4 – А
- 27. Продолжите предложение
- 28. Домашнее задание Параграф 27 (с. 197-202). Выполнение домашнего задания по уровням: «3» - с. 204 №
- 30. Скачать презентацию





















 Экскурсия_на_четверг_18_03_Ермолаева_Геральда_
Экскурсия_на_четверг_18_03_Ермолаева_Геральда_ Новогодние поделки в 3 классе
Новогодние поделки в 3 классе Знаменитые задачи древности. Возвращение к истокам
Знаменитые задачи древности. Возвращение к истокам Мировой рынок функциональных продуктов и бад
Мировой рынок функциональных продуктов и бад Мастер-класс Подарок для мамы
Мастер-класс Подарок для мамы Бюджет и бюджетная система Российской Федерации
Бюджет и бюджетная система Российской Федерации Совершенствование проведения ГИА по образовательным программам основного общего образования (ГИА-9)
Совершенствование проведения ГИА по образовательным программам основного общего образования (ГИА-9) По местам Героя нашего времени. Лермонтовские места
По местам Героя нашего времени. Лермонтовские места Эволюция, структура менеджмента
Эволюция, структура менеджмента Некоторые особенности решения уравнений С1–С6 ЕГЭ
Некоторые особенности решения уравнений С1–С6 ЕГЭ Два главных правила успешного человека
Два главных правила успешного человека Город Санкт-Петербург
Город Санкт-Петербург Сам себе HR
Сам себе HR Мировой рынок электроники и электротехники
Мировой рынок электроники и электротехники Декларация ООН о правах умственно отсталых лиц 20 декабря 1971 года
Декларация ООН о правах умственно отсталых лиц 20 декабря 1971 года Синтез регулятора на основе модели объекта управления и желаемого вида передаточной функции замкнутой системы
Синтез регулятора на основе модели объекта управления и желаемого вида передаточной функции замкнутой системы Презентация по краеведению на тему Верните мне хозяина
Презентация по краеведению на тему Верните мне хозяина Телефонная станция
Телефонная станция КВН по сказкам А. С. Пушкина
КВН по сказкам А. С. Пушкина Понятие производственных запасов и их классификация
Понятие производственных запасов и их классификация практическая работа 8
практическая работа 8 Критерии деления кормов на диетические и повседневные
Критерии деления кормов на диетические и повседневные Руйнівна дія наркотиків
Руйнівна дія наркотиків Эволюция семьи и брака
Эволюция семьи и брака Презентация Развитие логического мышления у детей дошкольного возраста через игровую деятельность
Презентация Развитие логического мышления у детей дошкольного возраста через игровую деятельность Теорема Виета
Теорема Виета Основы теории журналистики
Основы теории журналистики Презентация Государственная стратегия в содержании дошкольного образования
Презентация Государственная стратегия в содержании дошкольного образования