Содержание
- 2. План изучения класса СПИРТЫ Определение Классификация Строение предельных одноатомных спиртов Номенклатура Изомерия Получение Физические свойства Химические
- 3. Спирты (Алкоголи) – – производные углеводородов, в молекулах которых один или несколько атомов замещены на соответствующее
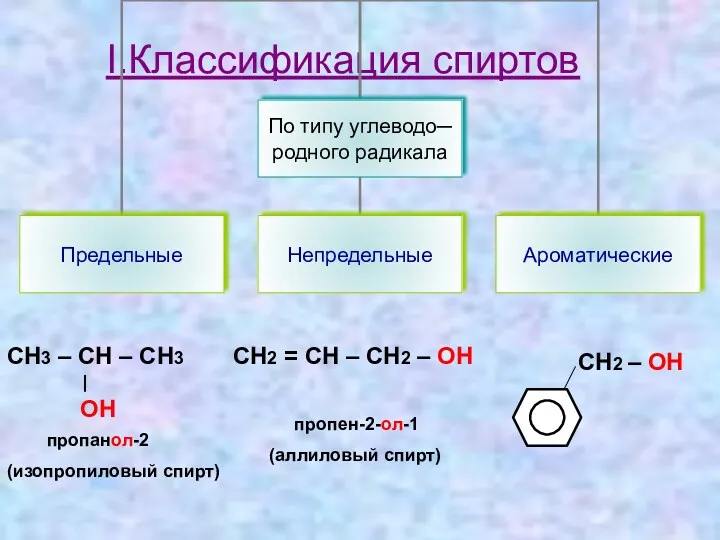
- 4. I.Классификация спиртов СН3 – СН – СН3 | OH пропанол-2 (изопропиловый спирт) СН2 = СН –
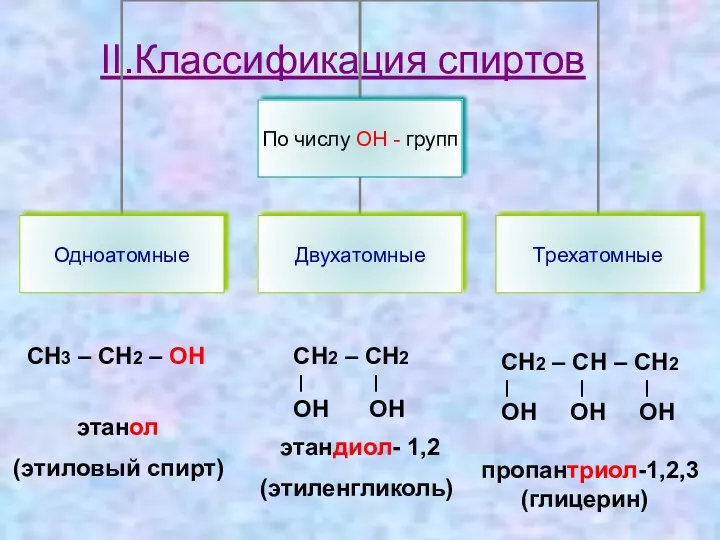
- 5. II.Классификация спиртов СН3 – СН2 – OH этанол (этиловый спирт) СН2 – СН2 | | ОН
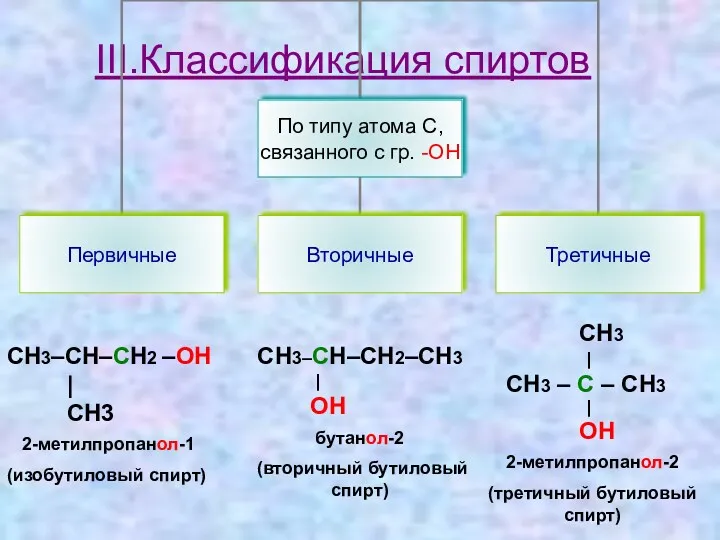
- 6. III.Классификация спиртов СН3–СН–СН2 –ОН | СН3 2-метилпропанол-1 (изобутиловый спирт) СН3–СН–СН2–СН3 | ОН бутанол-2 (вторичный бутиловый спирт)
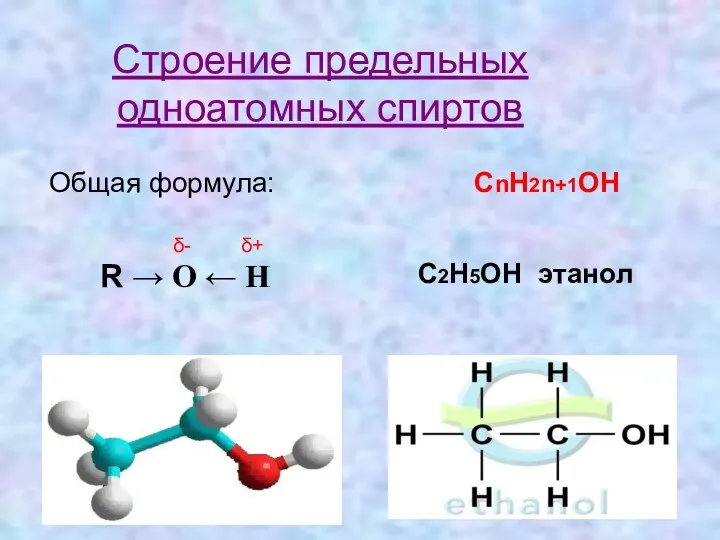
- 7. Строение предельных одноатомных спиртов Общая формула: СnH2n+1OH R → O ← H δ- δ+ C2H5OH этанол
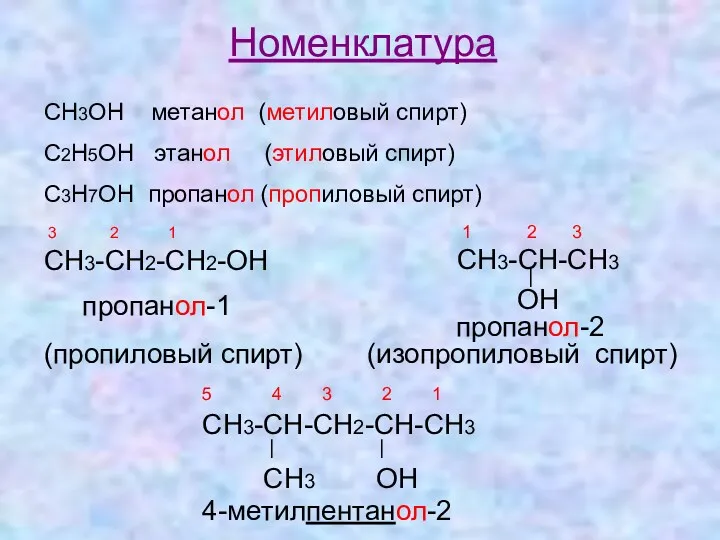
- 8. Номенклатура СН3ОН метанол (метиловый спирт) С2Н5ОН этанол (этиловый спирт) С3Н7ОН пропанол (пропиловый спирт) 3 2 1
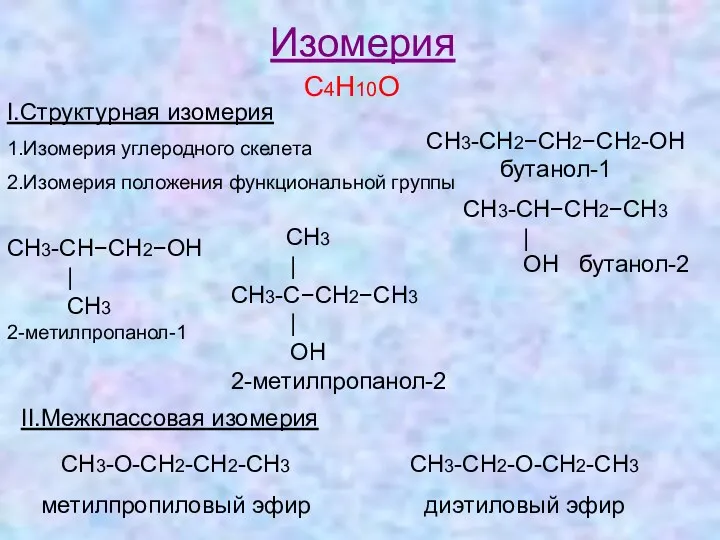
- 9. Изомерия С4Н10О I.Структурная изомерия 1.Изомерия углеродного скелета 2.Изомерия положения функциональной группы СН3-СН2−СН2−СН2-ОН бутанол-1 СН3-СН−СН2−СН3 | OH
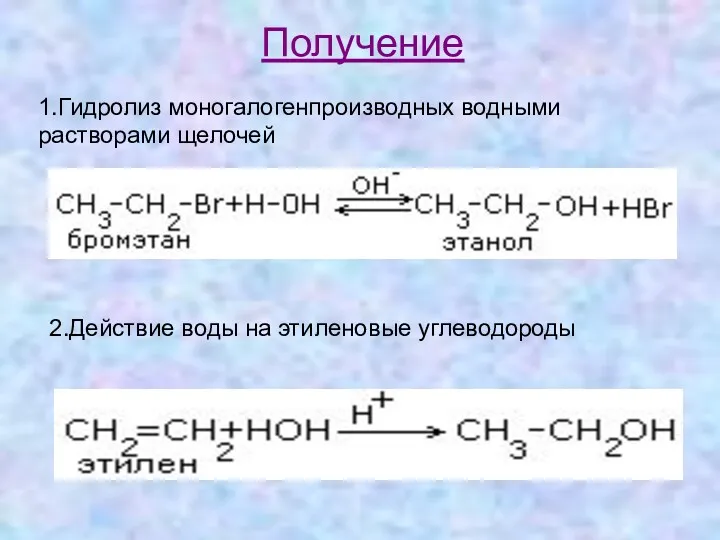
- 10. Получение 1.Гидролиз моногалогенпроизводных водными растворами щелочей 2.Действие воды на этиленовые углеводороды
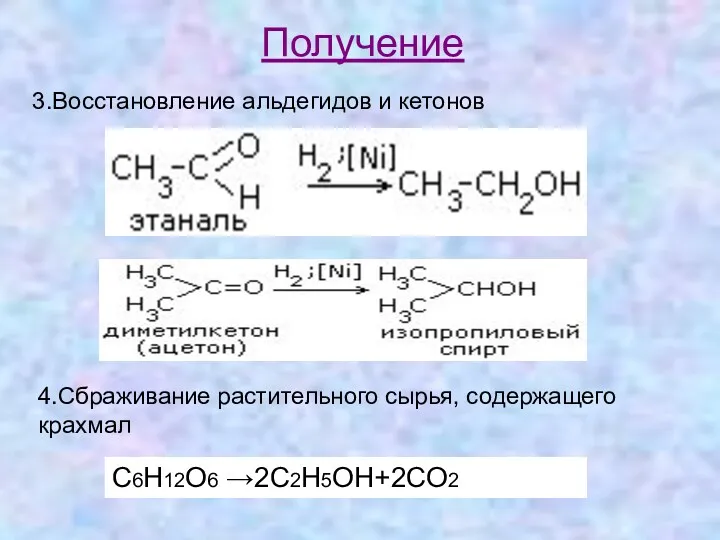
- 11. Получение 3.Восстановление альдегидов и кетонов 4.Сбраживание растительного сырья, содержащего крахмал С6H12O6 →2C2H5OH+2CO2
- 12. Физические свойства предельные одноатомные спирты от С1 до С12 – жидкости высшие спирты – мазеобразные вещества
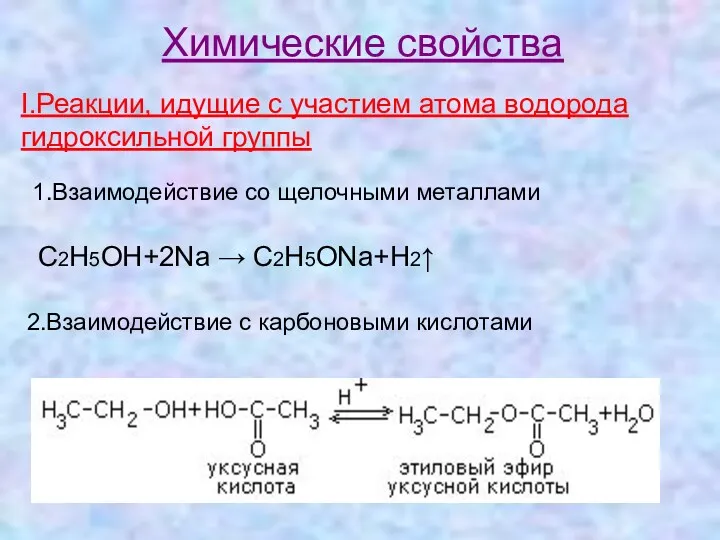
- 13. Химические свойства I.Реакции, идущие с участием атома водорода гидроксильной группы 1.Взаимодействие со щелочными металлами C2H5OH+2Na →
- 14. Химические свойства II. Реакции, идущие с участием гидроксильной группы 1.Взаимодействие с галогеноводородами C2H5OH+HBr →C2H5Br +HOH 2.Отщепление
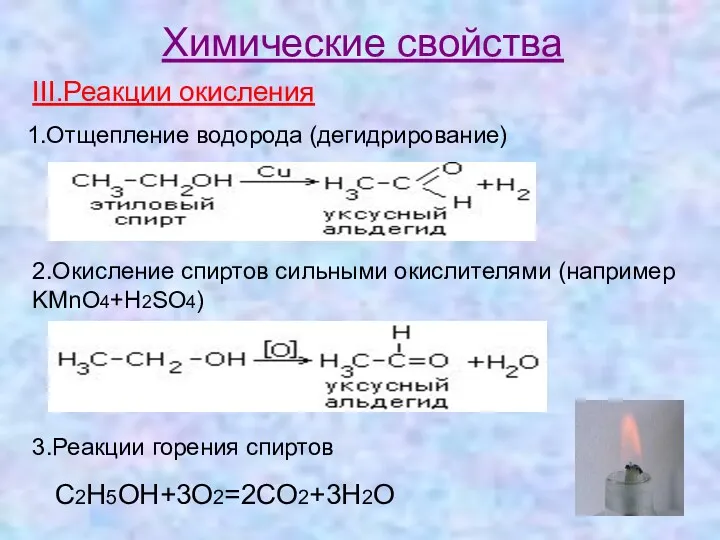
- 15. Химические свойства III.Реакции окисления 1.Отщепление водорода (дегидрирование) 2.Окисление спиртов сильными окислителями (например KMnO4+H2SO4) 3.Реакции горения спиртов
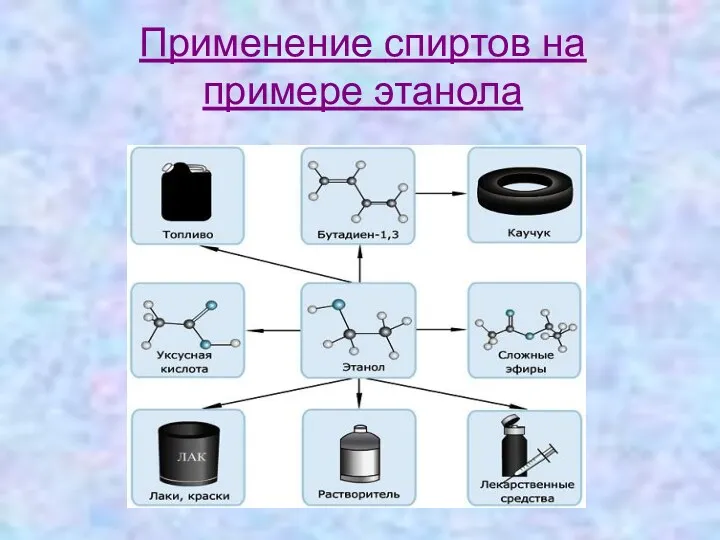
- 16. Применение спиртов на примере этанола
- 18. Скачать презентацию




 Производство чугуна и стали
Производство чугуна и стали Родительское собрание Основы гендерного воспитания у дошкольников в семье и детском саду.
Родительское собрание Основы гендерного воспитания у дошкольников в семье и детском саду. Хозяин своей жизни. Энергия –внутри. Семинар-тренинг
Хозяин своей жизни. Энергия –внутри. Семинар-тренинг Возрастные особенности детей 2-3 лет
Возрастные особенности детей 2-3 лет Промывка скважин
Промывка скважин Деление на двузначное число
Деление на двузначное число Воскресная школа сегодня и завтра
Воскресная школа сегодня и завтра Урок-игра Заполни энергетические уровни
Урок-игра Заполни энергетические уровни Презентация к классному часу Покормите птиц
Презентация к классному часу Покормите птиц ЖИТС-тің құқықтық және медико-деонтологиялық мәселелері
ЖИТС-тің құқықтық және медико-деонтологиялық мәселелері Правописание чередующихся гласных в корнях слов
Правописание чередующихся гласных в корнях слов Санкт-Петербург - новый хозяйственный узел России.
Санкт-Петербург - новый хозяйственный узел России. Сенсорные мониторы
Сенсорные мониторы Глобальные сети и перспективные сетевые технологии. Глобальные сети (Wide Area Networks, WAN)
Глобальные сети и перспективные сетевые технологии. Глобальные сети (Wide Area Networks, WAN) Оценка химической обстановки на объектах хозяйствования
Оценка химической обстановки на объектах хозяйствования Служба в органах и организациях прокуратуры. Кадры органов и организаций прокуратуры
Служба в органах и организациях прокуратуры. Кадры органов и организаций прокуратуры Значимость практических и лабораторных работ в овладении профессиональными компетенциями
Значимость практических и лабораторных работ в овладении профессиональными компетенциями Жиры и мыло
Жиры и мыло Кранцевое устройство
Кранцевое устройство презентация опыт работы
презентация опыт работы Вклад химиков в Великую Победу
Вклад химиков в Великую Победу Конспект занятий с презентацией Остров сокровищ
Конспект занятий с презентацией Остров сокровищ Правила наложения жгутов, повязок и шин при травмах
Правила наложения жгутов, повязок и шин при травмах Искусство Франции второй половины XVIII века
Искусство Франции второй половины XVIII века Подготовка и разделка кромок под сварку
Подготовка и разделка кромок под сварку С днем учителя
С днем учителя Время новых возможностей! Круглый стол финал. Avon
Время новых возможностей! Круглый стол финал. Avon Презентация к урокам химии 11 класс.
Презентация к урокам химии 11 класс.