Слайд 2

На уроке мы:
-продолжим изучать соединения азота
-подробно рассмотрим свойства HNO3
-будем совершенствовать
навыки написания уравнений реакций
-узнаем об областях практического применения HNO3 и ее солей
Слайд 3

Химическая разминка:
1.Формула аммиака: а)NH2 б) NH4 в)NH3 г) N2
2.Аммиак: а)легче воздуха,
б)тяжелее воздуха, в)не легче и не тяжелее
3.Аммиак является: а)окислителем, б)восстановителем, в)и тем,и другим.
4.Ион аммония а)NH2+ б)NH4+ в)NH3– г)NH3
5.Донором электронов при образовании иона
аммония является а) атом азота, б)ион водорода, в)ион аммония
6.Степень окисления азота в аммиаке: а)0, б)-3, 4)+3, 5)8
Слайд 4
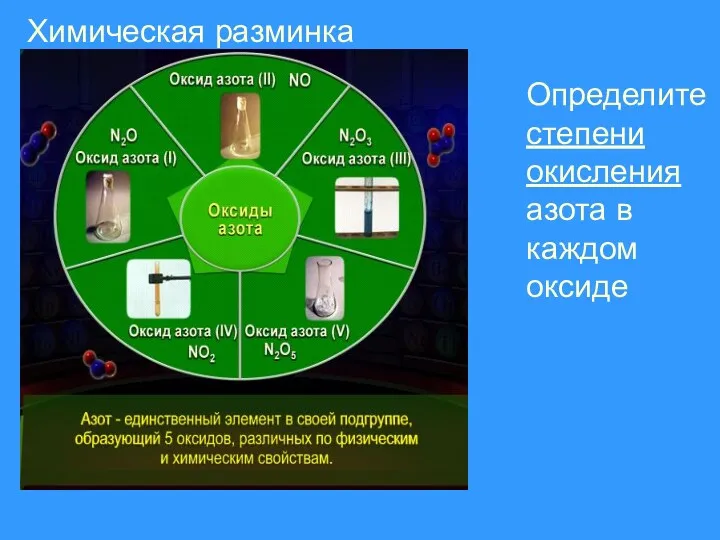
Химическая разминка
Определите степени окисления азота в каждом оксиде
Слайд 5
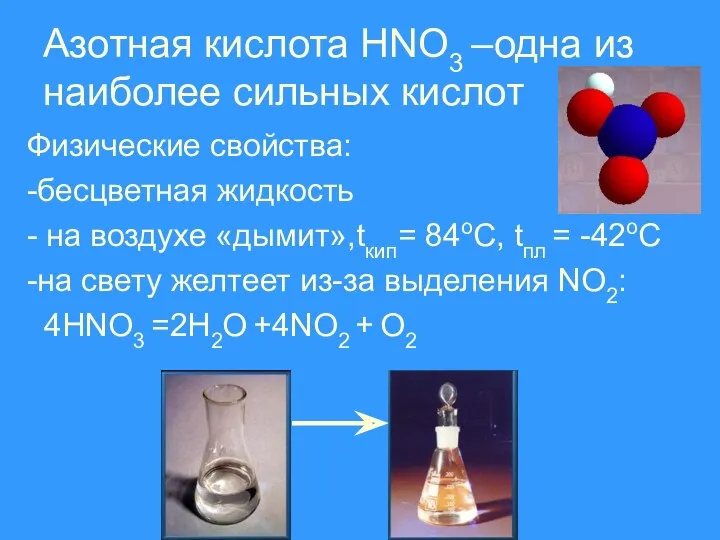
Азотная кислота HNO3 –одна из наиболее сильных кислот
Физические свойства:
-бесцветная жидкость
- на
воздухе «дымит»,tкип= 84оС, tпл = -42оС
-на свету желтеет из-за выделения NO2:
4HNO3 =2H2O +4NO2 + O2
Слайд 6

Слайд 7

Химические свойства
Типичные свойства кислот
Слайд 8

Химические свойства
С металлами реагирует особо:
Слайд 9
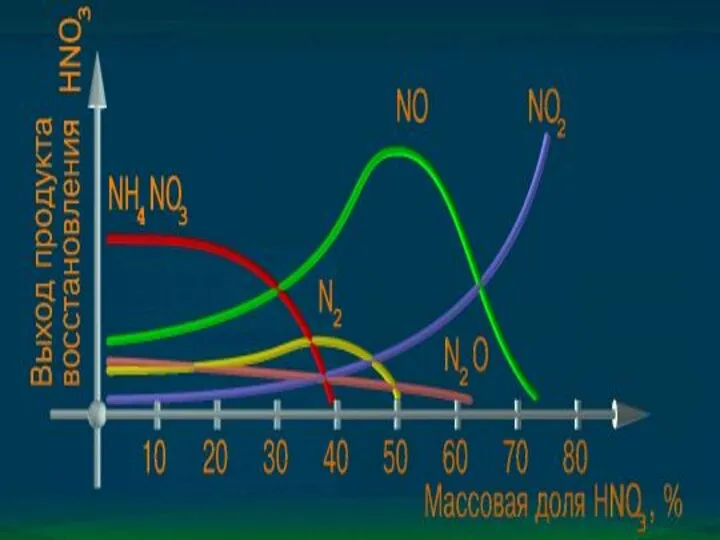
Слайд 10

Химические свойства:
Взаимодействие с неметаллами
Слайд 11

Слайд 12

Применение солей HNO3
-в сельском хозяйстве
-для крашения тканей
-в медицине
-в пиротехнике
Слайд 13

Проверь себя:
Степень окисления азота в HNO3 а)-3 б)0 в)+5 г)+4
При хранении
на свету HNO3 а) краснеет б) желтеет в) остается бесцветной
Азотная кислота является: а)окислителем, б)восстановителем, в)и тем,и другим.
Проявляет ли HNO3 общие с другими кислотами свойства? а)да б)нет в)зависит от погоды
Царская водка- это а)концентрированный спирт б)3 объема HCl и 1 объем HNO3
в) концентрированная азотная кислота
Слайд 14

Закончите предложения:
-сегодня на уроке я узнал…
-я потренировался…
-я увидел…













 Инновационный опыт
Инновационный опыт Авторские презентации
Авторские презентации Консультирование асоциальных личностей
Консультирование асоциальных личностей Стендовый урок математика 5 класс Десятичные дроби
Стендовый урок математика 5 класс Десятичные дроби Энзимы для отделки джинсовых изделий
Энзимы для отделки джинсовых изделий Проект Рукавичка
Проект Рукавичка Классный час. Тема: Путешествие в страну Здоровья. 1-й класс.
Классный час. Тема: Путешествие в страну Здоровья. 1-й класс. Уран-седьмая планета от Солнца
Уран-седьмая планета от Солнца Презентация к дистанционному уроку Типы химических реакций на примере свойств воды. 8 класс
Презентация к дистанционному уроку Типы химических реакций на примере свойств воды. 8 класс Элементы низковольтных цепей. Проведение электромонтажных работ
Элементы низковольтных цепей. Проведение электромонтажных работ Международная торговля и внешнеторговая политика
Международная торговля и внешнеторговая политика Вступ до юридичної конфліктології
Вступ до юридичної конфліктології проект Краски весны
проект Краски весны Старшие и младшие символисты
Старшие и младшие символисты Административная практика при нарушениях в сфере здравоохранения
Административная практика при нарушениях в сфере здравоохранения What is the Operating System
What is the Operating System Внеурочная деятельность в духовно-нравственном развитии и воспитании младшего школьника
Внеурочная деятельность в духовно-нравственном развитии и воспитании младшего школьника Музей боевой славы.
Музей боевой славы. Проблематика романа М. Булгакова Белая гвардия
Проблематика романа М. Булгакова Белая гвардия Рассказ об истории российской журналистики
Рассказ об истории российской журналистики Таможенный контроль товаров и транспортных средств
Таможенный контроль товаров и транспортных средств Электронная картотека игр для развития мелкой моторики с использованием нестандартного оборудования
Электронная картотека игр для развития мелкой моторики с использованием нестандартного оборудования Умный дом
Умный дом Использование средств ИКТ при анализе процессов в обществе, в природе и технике
Использование средств ИКТ при анализе процессов в обществе, в природе и технике игра сложи ракету
игра сложи ракету Спортивная школа
Спортивная школа Граффити, как вид современного искусства
Граффити, как вид современного искусства Экспертиза качества некоторых сортов хлеба
Экспертиза качества некоторых сортов хлеба