Содержание
- 2. Оглавление Аллотропия. Аллотропные модификации кислорода. История открытия кислорода и озона. Нахождение в природе. Строение молекулы. Физические
- 3. Аллотропия (от греческих слов allos – другой и tropos – образ, способ) Способность атомов одного элемента
- 4. Аллотропные модификации кислорода. О2 кислород (простое вещество) К. В. Шееле 1772 г. Дж. Пристли 1774 г.
- 5. 1772 год. Карл Вильгельм Шееле (шведский учёный) хотел раскрыть загадку огня и при этом неожиданно обнаружил,
- 6. 1774 год. Джозеф Пристли, изучая состав воздуха, пытался выяснить, какие его составляющие могут выделиться из химических
- 7. Впервые количественный состав воздуха установил французский ученый Антуан Лоран Лавуазье ( 1775 г. ) По результатам
- 8. Впервые озон обнаружил в 1785 голландский физик М. ван Марум по характерному запаху (свежести) и окислительным
- 9. ( 1799 – 1868 ) Кристиан Фридрих Шёнбей Термин озон предложен немецким химиком X.Ф. Шёнбейном в
- 10. Нахождение в природе. О2 Воздух – 21% по объёму 23% по массе. О3 Атмосфера (верхний слой)
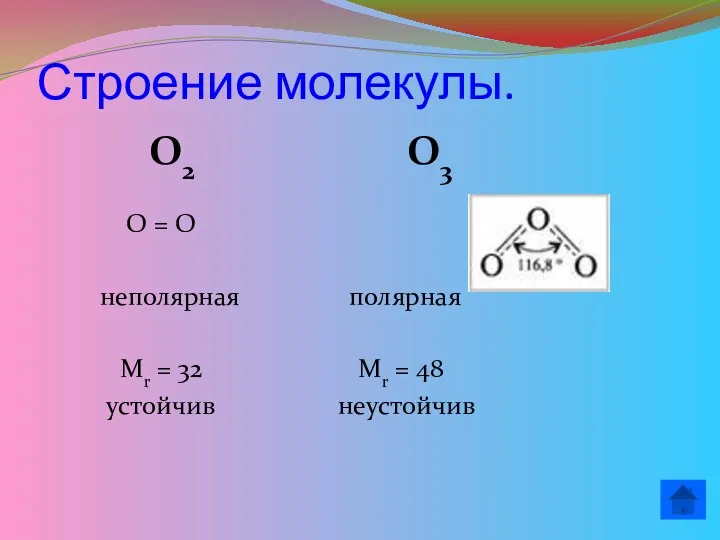
- 11. Строение молекулы. О2 О3 О = О неполярная полярная Mr = 32 Mr = 48 устойчив
- 12. Физические свойства.
- 13. Химические свойства О2 Сильный окислитель, но не окисляет Au и Pt, окисляет многие металлы, образуя оксиды,
- 14. Получение в природе. О2 6СО2 + 6Н2О = С6Н12О6 + 6О2 Процесс фотосинтеза. О3 3О2 ⇄
- 15. Значение кислорода и озона в природе. О2 дыхание (животные) О2 гемоглобин Н2О + СО2 хлорофилл фотосинтез
- 16. Проверь себя! 1. Что такое аллотропия? 2. Назовите фамилии трех ученых, открывших кислород. 3. В результате
- 17. Литература, интернет-ресурсы. О.С.Габриелян « Химия. 9 кл.» М. Дрофа, 2007 г.. Ю.М.Малиновская «Химия. 6 кл.» (пропедевтический
- 19. Скачать презентацию














 Презентация_Селяева А.Д
Презентация_Селяева А.Д Презентация посвящённая 100-летию Г.В.Свиридова МБДОУ №25
Презентация посвящённая 100-летию Г.В.Свиридова МБДОУ №25 Важные изменения в законодательстве в 2019 году
Важные изменения в законодательстве в 2019 году Семья субъект социокультурной среды
Семья субъект социокультурной среды презентация по работе семейного клуба Счастливый ребёнок МКДОУ детский сад№4 Золотой петушок. с.Пригородное Ивановская область
презентация по работе семейного клуба Счастливый ребёнок МКДОУ детский сад№4 Золотой петушок. с.Пригородное Ивановская область Презентация 8 класс Рациональное использование природных ресурсов
Презентация 8 класс Рациональное использование природных ресурсов командная игра огонь - наш друг, огонь - наш враг
командная игра огонь - наш друг, огонь - наш враг Представление чисел в формате с плавающей запятой
Представление чисел в формате с плавающей запятой Газопламенное напыление
Газопламенное напыление Шагает эра космоса вперёд.
Шагает эра космоса вперёд. Алтайский заповедник
Алтайский заповедник Профотбор. Проблема отбора
Профотбор. Проблема отбора РобоПлатформа. Старт 2.0 Урок 10
РобоПлатформа. Старт 2.0 Урок 10 Отработка предлагаемых продаж и навыки презентации меню/
Отработка предлагаемых продаж и навыки презентации меню/ ВОИН о ВОЙНЕ работа посвящается Героям Отечества
ВОИН о ВОЙНЕ работа посвящается Героям Отечества 97 А класс әмбебап тігін машинасы
97 А класс әмбебап тігін машинасы Презентация Механические волны.
Презентация Механические волны. Презентация к уроку истории и культуры Санкт-Петербурга в 8 классе Памятники воинской славы в Санкт-Петербурге: Отечественная война 1812 года
Презентация к уроку истории и культуры Санкт-Петербурга в 8 классе Памятники воинской славы в Санкт-Петербурге: Отечественная война 1812 года Будова і технічне обслуговування транспортного засобу категорії В. Трансмісія, підвіска та механізми керування
Будова і технічне обслуговування транспортного засобу категорії В. Трансмісія, підвіска та механізми керування Рисуем пасхальные яйца
Рисуем пасхальные яйца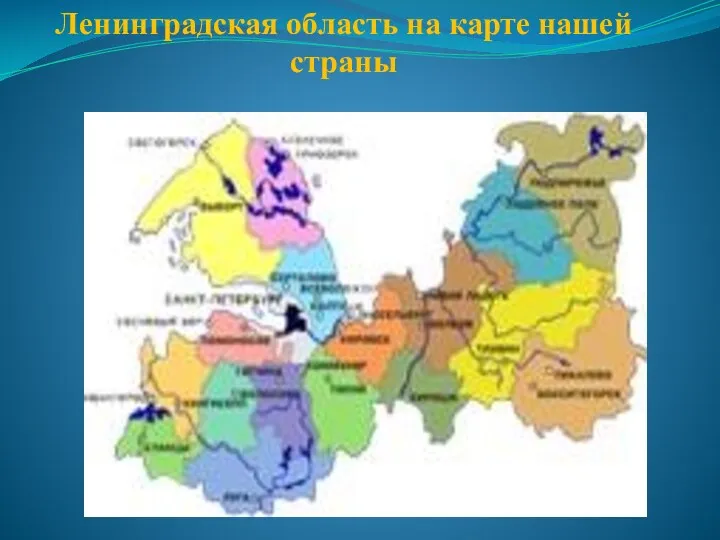 Ленинградская область на карте нашей страны
Ленинградская область на карте нашей страны Петровские преобразования: предпосылки, основные направления, результаты
Петровские преобразования: предпосылки, основные направления, результаты Заболачивание
Заболачивание Моя презентация
Моя презентация Метод щелевой разгрузки пласта в призабойной зоне скважин
Метод щелевой разгрузки пласта в призабойной зоне скважин Система входных приемных устройств 35ВВ РЛС 35Н6
Система входных приемных устройств 35ВВ РЛС 35Н6 Против неограниченной свободы
Против неограниченной свободы Bukhara
Bukhara