Содержание
- 2. Оксиды - сложные вещества, cостоящие из двух химических элементов, один из которых кислород в степени окисления
- 3. Солеобразующие оксиды Основные оксиды (оксид натрия Na2O, оксид меди (II) CuO); Оксиды металлов, степень окисления которых
- 4. Оксиды называют словом «оксид», после которого следует наименование химического элемента в родительном падеже, например: К2O —
- 5. 1. Взаимодействие простых веществ (за исключением инертных газов, Au и Pt) с кислородом: 2H2 + O2
- 6. 4. Термическое разложение оснований или кислот: 2Al(OH)3 = Al2O3 + 3H2O↑ 4HNO3 = 4NO2↑ + O2↑
- 7. 1. Основный оксид + кислота = соль + вода CuO + H2SO4 = CuSO4 + H2O
- 8. 1. Кислотный оксид + вода = кислота SO3 + H2O = H2SO4 2. Кислотный оксид +
- 10. Скачать презентацию







 Презентация Страна СОНЛЯНДИЯ
Презентация Страна СОНЛЯНДИЯ Готовимся к ЕГЭ по русскому языку. Тренажер А3
Готовимся к ЕГЭ по русскому языку. Тренажер А3 Структура и особенности построения коммуникационного процесса. Тема 2
Структура и особенности построения коммуникационного процесса. Тема 2 Безопасность на дороге
Безопасность на дороге Виденин Иван Васильевич. Семейные реликвии
Виденин Иван Васильевич. Семейные реликвии Н.В. Гоголь. Место рождения
Н.В. Гоголь. Место рождения урок Серная кислота
урок Серная кислота Я и моя семья. Филиппова Лиана
Я и моя семья. Филиппова Лиана Улыбка. В чем ее секрет? Диск
Улыбка. В чем ее секрет? Диск Интерьер жилого дома. Кухня
Интерьер жилого дома. Кухня Презентация о Суворове
Презентация о Суворове Представление данных на ЭВМ. (Лекция 2)
Представление данных на ЭВМ. (Лекция 2) ООО Нефтегазстрой Инжиниринг. Монтаж выкидного трубопровода на скважине 136 Западно-Коммунарского месторождения
ООО Нефтегазстрой Инжиниринг. Монтаж выкидного трубопровода на скважине 136 Западно-Коммунарского месторождения ФОНЕМАТИЧЕСКИЙ СЛУХ КАК СРЕДСТВО ФОРМИРОВАНИЯ ЗВУКОВОГО АНАЛИЗА И СИНТЕЗА
ФОНЕМАТИЧЕСКИЙ СЛУХ КАК СРЕДСТВО ФОРМИРОВАНИЯ ЗВУКОВОГО АНАЛИЗА И СИНТЕЗА презентация Праздник осени Диск
презентация Праздник осени Диск Проект Молоко и его польза
Проект Молоко и его польза Система ЦТ PAL
Система ЦТ PAL Общая характеристика металлов
Общая характеристика металлов Презентация образовательной деятельности Профессии повара и доктора
Презентация образовательной деятельности Профессии повара и доктора Новые ресурсосберегающие технологии и машины для внесения твердых органических удобрений в почву
Новые ресурсосберегающие технологии и машины для внесения твердых органических удобрений в почву Отдел покрытосеменные
Отдел покрытосеменные 20231203_zadachi_na_dvizhenie_2_1
20231203_zadachi_na_dvizhenie_2_1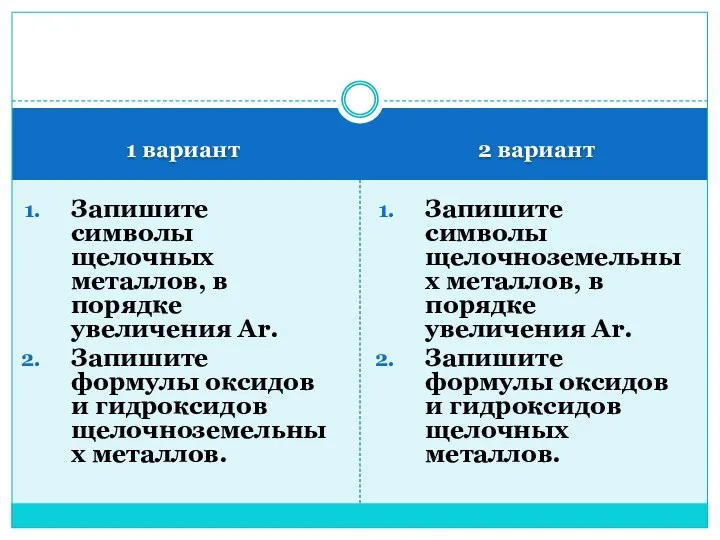 Периодический закон Д.И. Менделеева
Периодический закон Д.И. Менделеева Алгоритм разработки Адаптированной общеобразовательной программы (АООП)
Алгоритм разработки Адаптированной общеобразовательной программы (АООП) Флористика
Флористика Innovation electric car: Tesla
Innovation electric car: Tesla Электронная цифровая подпись. Лекция 13
Электронная цифровая подпись. Лекция 13 Дуговая наплавка. Особенности процесса наплавки
Дуговая наплавка. Особенности процесса наплавки