Содержание
- 2. Общая характеристика Общая формула гомологического ряда предельных одноатомных спиртов — CnH2n+1OH. В зависимости от того, при
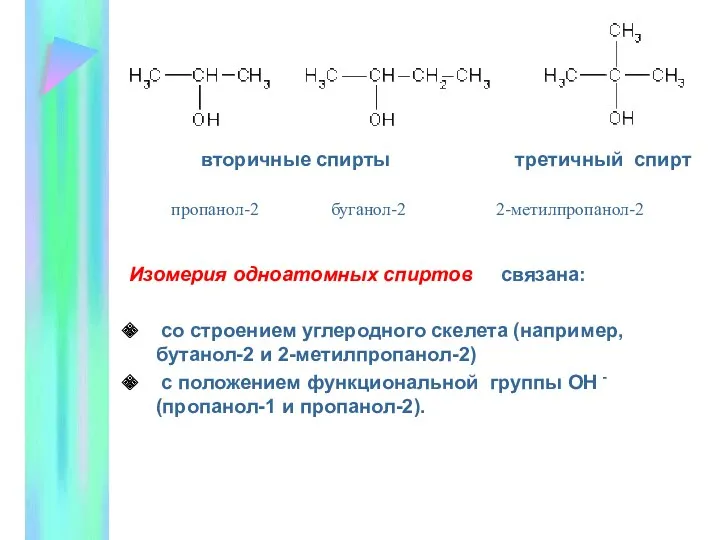
- 3. вторичные спирты третичный спирт Изомерия одноатомных спиртов связана: со строением углеродного скелета (например, бутанол-2 и 2-метилпропанол-2)
- 4. Номенклатура Названия спиртов образуют, добавляя окончание -ол к названию углеводорода с самой длинной углеродной цепью, включающей
- 5. Физические свойства Низшие спирты (до C15) — жидкости, высшие — твердые вещества. Метанол и этанол смешиваются
- 6. Образование водородных связей Образование водородной связи между молекулами спирта … между молекулами воды … между молекулами
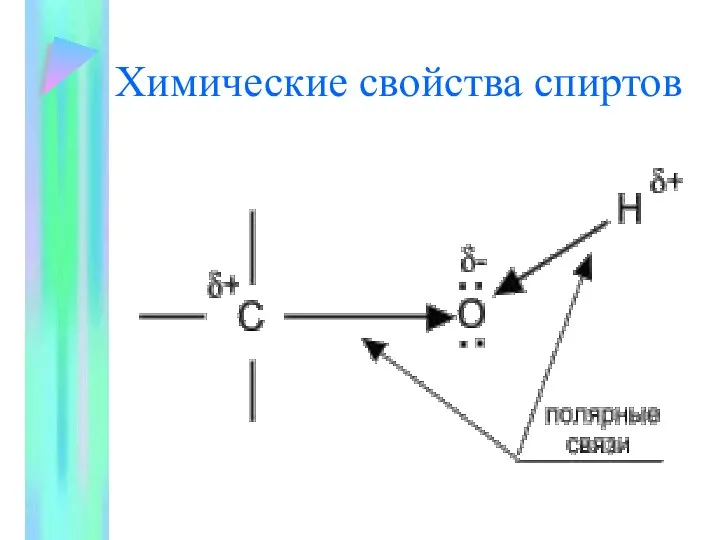
- 7. Химические свойства спиртов
- 8. Химические свойства спиртов определяются присутствием в их молекулах гидроксильной группы ОН-. Связи С-О и О- Н
- 9. Реакции сопровождающиеся разрывом связи С-О: (здесь проявляются слабые основные свойства спиртов) внутримолекулярная дегидратация с образованием алкенов
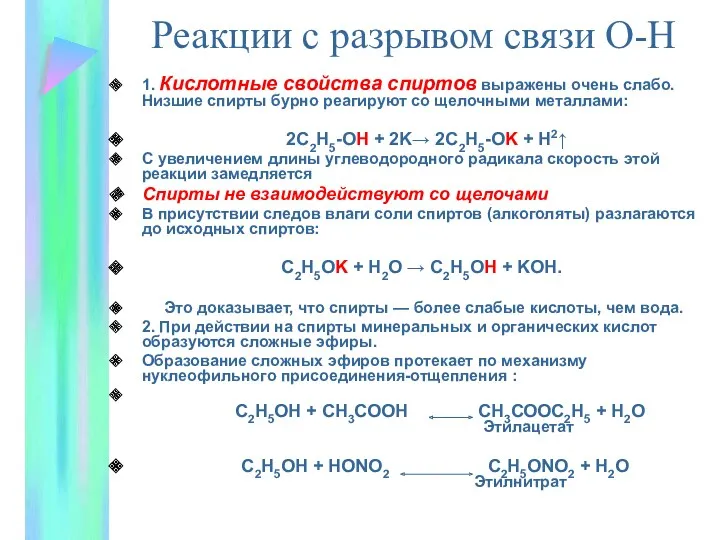
- 10. 1. Кислотные свойства спиртов выражены очень слабо. Низшие спирты бурно реагируют со щелочными металлами: 2С2Н5-ОН +
- 11. Отличительной особенностью первой из этих реакций является то, что атом водорода отщепляется от спирта, а группа
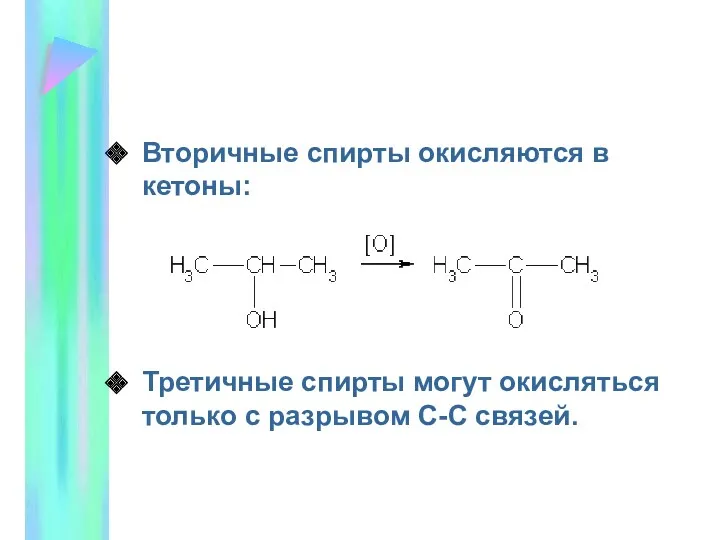
- 12. Вторичные спирты окисляются в кетоны: Третичные спирты могут окисляться только с разрывом С-С связей.
- 13. Реакции с разрывом связи С-О. Реакции дегидратации протекают при нагревании спиртов с водоотнимающими веществами. При сильном
- 14. Получение 1. Самый общий способ получения спиртов, имеющий промышленное значение, — гидратация алкенов. Реакция идет при
- 15. 3. Восстановление карбонильных соединений. При восстановлении альдегидов образуются первичный спирты, при восстановлении кетонов — вторичные: R—CH=O
- 16. Применение спиртов Спирты главным образом используют в промышленности органического синтеза. Этанол - важное сырье пищевой промышленности.
- 18. Скачать презентацию











 Электроэнергетика мира
Электроэнергетика мира Конкурс Лучший виртуальный ландшафтный дизайн среды
Конкурс Лучший виртуальный ландшафтный дизайн среды Мастер Класс Декоративное Оформление Бутылок
Мастер Класс Декоративное Оформление Бутылок Урок химии в 8 классе Валентность
Урок химии в 8 классе Валентность Презентация к классному часу Горячее сердце 2014
Презентация к классному часу Горячее сердце 2014 Подарки. Как дарить подарки
Подарки. Как дарить подарки Dwayne Douglas Johnson
Dwayne Douglas Johnson Цветные металлы
Цветные металлы Животноводство. Отрасли животноводства
Животноводство. Отрасли животноводства Эпидемическая ситуация по распространению ВИЧ-инфекции по г. Новоуральску
Эпидемическая ситуация по распространению ВИЧ-инфекции по г. Новоуральску Свобода и необходимость в человеческой деятельности. Свобода и ответственность
Свобода и необходимость в человеческой деятельности. Свобода и ответственность Двигательная реабилитация в неврологии
Двигательная реабилитация в неврологии ЛФ упруго-вязко-пластичной консистенций. Мази
ЛФ упруго-вязко-пластичной консистенций. Мази Практическая работа Получение уксусной кислоты и опыты с ней
Практическая работа Получение уксусной кислоты и опыты с ней Место России в мире. Политико-государственное устройство РФ.
Место России в мире. Политико-государственное устройство РФ. Учетная политика для целей налогообложения
Учетная политика для целей налогообложения Детский травматизм в ДОУ
Детский травматизм в ДОУ Презентация Кристаллические решетки
Презентация Кристаллические решетки Паренхиматозные дистрофии
Паренхиматозные дистрофии Соляно-кислотные обработки
Соляно-кислотные обработки Задачи команды Звезда!
Задачи команды Звезда! Использование ИКТ на уроках в коррекционной школе VIII вида
Использование ИКТ на уроках в коррекционной школе VIII вида Власть. Роль политики в жизни общества
Власть. Роль политики в жизни общества Родительское собрание на тему Детские вредные привычки
Родительское собрание на тему Детские вредные привычки Презентация к открытому занятию ПМ 01 Диагностическая деятельность МДК Пропедевтика клинических дисциплин Тема: Питание и гигиена во второй половине беременности. Гимнастика беременной женщины
Презентация к открытому занятию ПМ 01 Диагностическая деятельность МДК Пропедевтика клинических дисциплин Тема: Питание и гигиена во второй половине беременности. Гимнастика беременной женщины Технические средства автоматизации. Исполнительные механизмы
Технические средства автоматизации. Исполнительные механизмы Жақсыз сөйлем, жасаулы
Жақсыз сөйлем, жасаулы Составные задачи на нахождение суммы, в которых неизвестно одно из слагаемых
Составные задачи на нахождение суммы, в которых неизвестно одно из слагаемых