Содержание
- 2. Реакции между ионами называют ионными реакциями, а уравнения таких реакций – ионными уравнениями. Большинство химических реакций
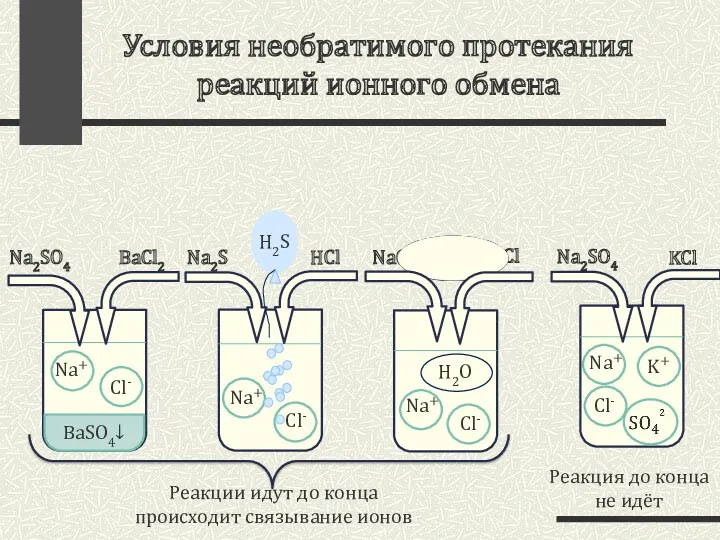
- 3. Условия необратимого протекания реакций ионного обмена Na2SO4 KCl Na2SO4 BaCl2 Реакция до конца не идёт Na2S
- 4. Правила составления ионных уравнений При составлении ионных уравнений следует руководствоваться тем, что вещества малодиссоциирующие, нерастворимые и
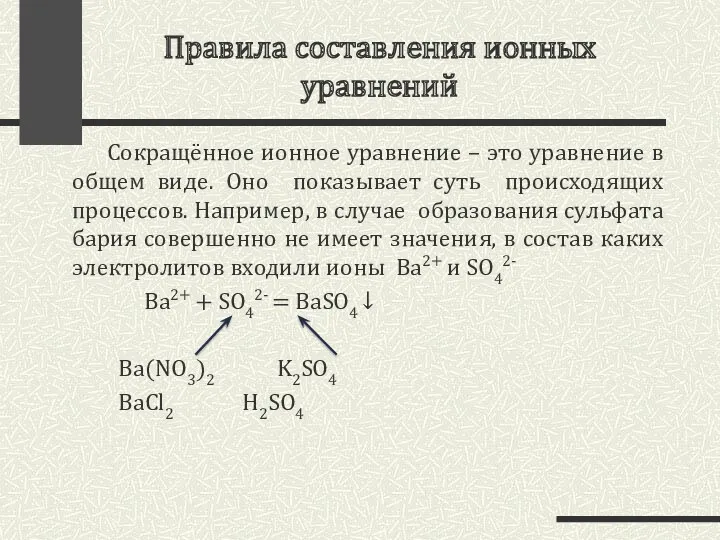
- 5. Правила составления ионных уравнений Сокращённое ионное уравнение – это уравнение в общем виде. Оно показывает суть
- 6. Правила составления ионных уравнений
- 7. Правила составления ионных уравнений Пример: Взаимодействие сульфата натрия с хлоридом бария. Запишем уравнение в молекулярном виде:
- 8. Примеры реакций ионного обмена Молекулярное уравнение реакции щелочи с кислотой: КOH + HCl = KCl +
- 9. Примеры реакций ионного обмена Молекулярное уравнение реакции основного оксида с кислотой: CaO + 2HNO3 = Ca(NO3)2
- 10. Примеры реакций ионного обмена Молекулярное уравнение реакции нерастворимого основания с кислотой: 3Mg(OH)2 + 2H3PO4 = Mg3(PO4)2
- 11. Примеры реакций ионного обмена Молекулярное уравнение реакции амфотерного оксида с кислотой: Al2O3 + 6HCl = 2AlCl3
- 12. Примеры реакций ионного обмена Молекулярное уравнение реакции растворимой соли со щелочью: CuCl2 + 2KOH = 2KCl
- 13. Примеры реакций ионного обмена
- 14. Примеры реакций ионного обмена Молекулярное уравнение реакции растворимой соли (сульфида) с кислотой: K2S + 2HCl =
- 15. Примеры реакций ионного обмена
- 16. Примеры реакций ионного обмена
- 17. Примеры реакций ионного обмена
- 19. Скачать презентацию














 ВИЧ-инфекция
ВИЧ-инфекция Презентация О космосе
Презентация О космосе Систематизация катехизаторской деятельности на приходах
Систематизация катехизаторской деятельности на приходах СОВРЕМЕННЫЕ ЗДОРОВЬЕСБЕРЕГАЮЩИЕ ТЕХНОЛОГИИ В ДОУ
СОВРЕМЕННЫЕ ЗДОРОВЬЕСБЕРЕГАЮЩИЕ ТЕХНОЛОГИИ В ДОУ Устройство управления вычислительной машины
Устройство управления вычислительной машины Переводы Библии
Переводы Библии Нестандартные приемы умножения. Урок занимательной математики
Нестандартные приемы умножения. Урок занимательной математики Классный час Семья и семейные ценности
Классный час Семья и семейные ценности Серебряный век: музыка, театр, балет, кинематограф
Серебряный век: музыка, театр, балет, кинематограф Конспект логопедического занятия с учащимися 3 класса по преодолению аргамматической дисграфии
Конспект логопедического занятия с учащимися 3 класса по преодолению аргамматической дисграфии В уездном городе. Памятники истории и культуры дореволюционного Челябинска.
В уездном городе. Памятники истории и культуры дореволюционного Челябинска. Экономичность проектных решений жилых зданий
Экономичность проектных решений жилых зданий 20231013_ryad_naturalnyh_chisel_5_klass
20231013_ryad_naturalnyh_chisel_5_klass Банкет-коктейль
Банкет-коктейль Глобальные проблемы современности
Глобальные проблемы современности Получение электрического тока
Получение электрического тока Урок технологии по теме Сувенирная открытка к 23 февраля для 3 класса
Урок технологии по теме Сувенирная открытка к 23 февраля для 3 класса Урок химия+математика
Урок химия+математика Австралия. Интересные факты
Австралия. Интересные факты Презентация Лесостепи и степи России
Презентация Лесостепи и степи России Психогенді аурулардың дамуының механизмдері мен этиологиялық факторлары
Психогенді аурулардың дамуының механизмдері мен этиологиялық факторлары Система зажигания двигателя
Система зажигания двигателя Построение профиля местности
Построение профиля местности Инструкция по сигнализации на железнодорожном транспорте Российской Федерации
Инструкция по сигнализации на железнодорожном транспорте Российской Федерации ВВЭР (водо-водяной энергетический реактор)
ВВЭР (водо-водяной энергетический реактор) Город Подольск
Город Подольск нефть и бензин
нефть и бензин В.А. Осеева Кто наказал его?. Образовательные технологии на уроках литературы
В.А. Осеева Кто наказал его?. Образовательные технологии на уроках литературы