Слайд 2
Цель урока:
Обобщить, систематизировать, развить знания о строении металлов, свойствах металлов и
их важнейших соединений, рассмотреть их взаимообусловленность
Слайд 3

Третий лишний
Щелочные металлы
Ca
Na
Li
Слайд 4

Третий лишний
Щелочноземельные металлы
Ва
Ra
К
Слайд 5

Мои соседи
Be
Na Mg Al
Ca
Слайд 6
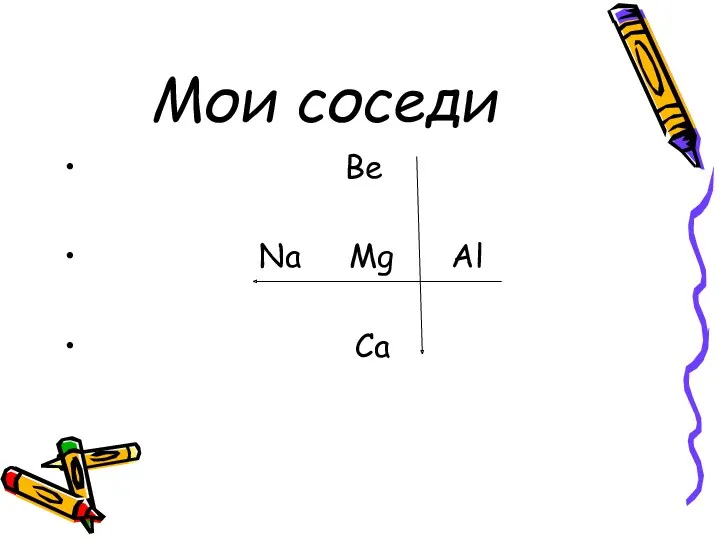
Мои соседи
Be
Na Mg Al
Ca
Слайд 7

Слайд 8
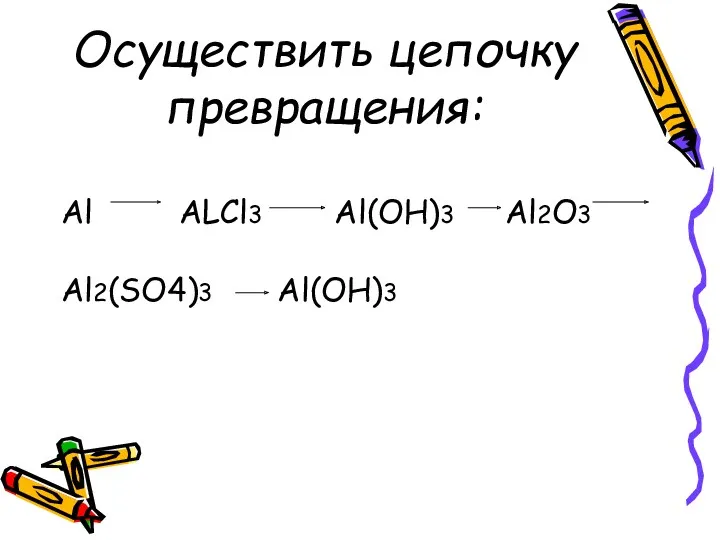
Осуществить цепочку превращения:
Al ALCl3 Al(OH)3 Al2O3
Al2(SO4)3 Al(OH)3
Слайд 9

Проверка:
2Al + 6HCl 2AlCl3 + 3H2
AlCl3 + 3NaOH 3NaCl + Al(OH)3
2Al(OH)3
Al2O3 + 3H2O
Al2O3 +3H2SO4 Al2(SO4)3 + 3H2O
Al2(SO4)3 + 6NaOH 2Al(OH)3 + 3Na2SO4
Слайд 10

План изучения нового материала:
1. Строение атома
2. Нахождение железа в природе
3. Физические
свойства железа
4. Химические свойства железа
Слайд 11

1. Строение атома железа:
Fe + 26 2)8)14)2
Степени окисления:
0 Fe
+2 FeО
+3
Fe2О3
Слайд 12

Слайд 13
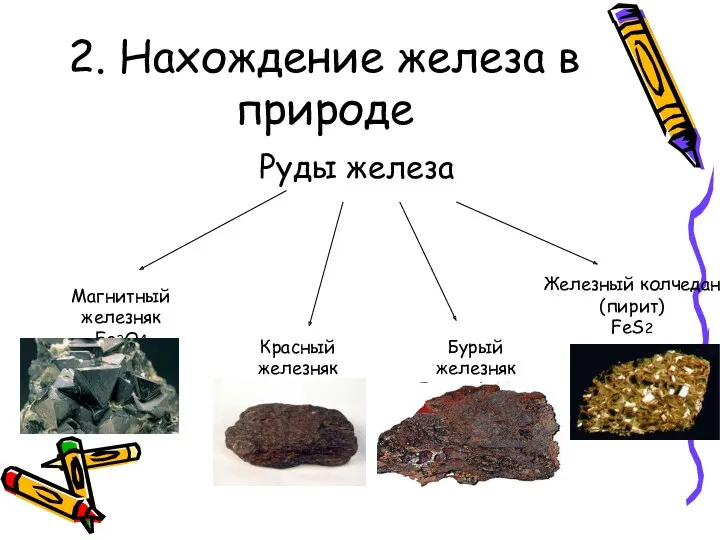
2. Нахождение железа в природе
Руды железа
Магнитный железняк
Fe3O4
Красный железняк
Fe2O3
Бурый железняк
Fe2O3 *nH2O
Железный колчедан
(пирит)
FeS2
Слайд 14

3. Физические свойства железа
1. Серебристо-белый блестящий металл
2. Температура плавления 1538ºС
3. Пластичность
7,87 г/см3
4. Пластичный (куется, прокатывается, штампуется)
5. Намагничивается и размагничивается
Слайд 15

4. Химические свойства железа
1. Взаимодействие с простыми веществами
Опыт 1 Горение железа
3Fe + 2O2 Fe3O4
(железная окалина)
Слайд 16

4. Химические свойства железа
1. Взаимодействие с простыми веществами
Опыт 2 Взаимодействие железа
с серой
Fe + S FeS
(сульфид железа II)
Слайд 17

4. Химические свойства железа
2. Взаимодействие со сложными веществами
Опыт 3 Взаимодействие
железа с соляной кислотой
Fe + 2HCl FeCl2 + H2
(хлорид железа II)
Слайд 18

4. Химические свойства железа
2. Взаимодействие со сложными веществами
Опыт 4 Взаимодействие железа
с солями
Fe + CuSO4 Cu + FeSO4
(сульфат железа II)
Слайд 19

4. Химические свойства железа
2. Взаимодействие со сложными веществами
Ржавление железа
4Fe +
6H2O + 3O2 4Fe(OH)3
(ржавчина)
Слайд 20

Закрепление
Найди ошибку в рассуждении незадачливого химика?
Слайд 21

Закрепление
В результате какого взаимодействия получится сульфат железа (II)?
SO2 + Fe(OH)2
Fe +
ZnSO4
FeO + H2SO4
Fe2O3 + H2SO4
Слайд 22

Закрепление
Найди ошибку
В каких уравнениях реакции коэффициенты расставлены верно?
3CO + Fe2O3 2Fe
+ 3CO2
3Fe + 3Cl2 3FeCl3
Fe2O3 + 4CO 2Fe + 3CO2
Слайд 23

Домашнее задание:
«5» Почему не допустимо одновременное введение в внутрь больному сульфата
железа (II) и нитрита натрия, учитывая, что среда в желудке кислая? Рассмотреть данную реакцию как окислительно-восстановительную
FeSO4 + NaNO2 + H2SO4
Fe2(SO4)3 + Na2SO4 + NO + H2O
Слайд 24

Домашнее задание:
«4» В настоящее время всем известно о содержании железа в
составе гемоглобина крови человека. Но в XIX веке открытие этого факта французским ученым Мери стало сенсацией, вызвало небывалый интерес общественности и стало причиной трагических случаев. Один студент-химик решил подарить своей возлюбленной кольцо, сделанное из железа собственной крови. Выпуская время от времени кровь, он получал соединение, из которого химическим путем выделял железо. Однако юноша погиб, так и не собрав нужного для изготовления кольца количества железа. Что стало причиной смерти юного возлюбленного?
Слайд 25

Домашнее задание:
«3» К раствору, содержащему 16 грамм сульфата меди (II), прибавили
12 грамм железных опилок. Какая масса меди выделится при этом?
Слайд 26
2. Нахождение железа в природе

























 Моделирование индукционных процессов и индукторов
Моделирование индукционных процессов и индукторов Пути управления финансовой устойчивостью организации
Пути управления финансовой устойчивостью организации Стили семейного воспитания
Стили семейного воспитания Арматура систем водоснабжения зданий. Материал труб
Арматура систем водоснабжения зданий. Материал труб Проект развития застройки городской территории. Реконструкция квартала
Проект развития застройки городской территории. Реконструкция квартала Дереворежущие инструменты
Дереворежущие инструменты Презентация к уроку в 8 классе по химиии. Тема Основание
Презентация к уроку в 8 классе по химиии. Тема Основание Отряд хищные. Семейство медвежьи
Отряд хищные. Семейство медвежьи Пасха Христова
Пасха Христова Портфолио класса
Портфолио класса Презентация к уроку по теме Химические свойства кислот
Презентация к уроку по теме Химические свойства кислот Патофизиология: предмет, задачи, методы
Патофизиология: предмет, задачи, методы Первичное наблюдение и инвентаризация. Оценка объектов учета
Первичное наблюдение и инвентаризация. Оценка объектов учета Антонио Гауди-и-Корнет Архитектура как скульптура
Антонио Гауди-и-Корнет Архитектура как скульптура My hobbies
My hobbies Внешняя политика СССР. Завершение холодной войны. 10 класс
Внешняя политика СССР. Завершение холодной войны. 10 класс Следы рук
Следы рук Основы проектирования робототехнических систем. КД3-22Р. КД3-840. КД1-1627
Основы проектирования робототехнических систем. КД3-22Р. КД3-840. КД1-1627 Судьбою вызваны к доске...
Судьбою вызваны к доске... Сущность и основные стандарты экологического менеджмента
Сущность и основные стандарты экологического менеджмента Организация исследовательской деятельности в ДОУ
Организация исследовательской деятельности в ДОУ Элементы функционального анализа
Элементы функционального анализа Развитие читательского интереса у учащихся начальных классов
Развитие читательского интереса у учащихся начальных классов Запам’ятовуючі пристрої СО (Заняття № 7.3)
Запам’ятовуючі пристрої СО (Заняття № 7.3) Переводческие соответствия
Переводческие соответствия Список 1 группы
Список 1 группы HD Body Electrical. BCM's Function Comparison 1
HD Body Electrical. BCM's Function Comparison 1 Судьба планеты в наших руках
Судьба планеты в наших руках