- Главная
- Без категории
- Применение первого закона термодинамики к решению графических задач

Содержание
- 2. вспомним Какие формулировки первого закона термодинамики вам известны? Какие формулы используются? ΔU = A + Q
- 3. Учимся анализировать графики р V V2 V1 1. Определим характер теплообмена в ходе процесса, изображенного на
- 4. р V T1 T2 3 Изменяется ли внутренняя энергия при адиабатном процессе ? РЕШЕНИЕ: 1 2
- 5. P V B 1 2 Идеальный газ переходит из состояния А в состояние В сначала в
- 6. р v 1 2 3 4 Определить характер теплообмена идеального газа с окружающей средой в ходе
- 7. Решаем самостоятельно Определите знак работы газа при переходах из состояний 1, 2, 3 в конечное состояние
- 8. Одинаковую ли работу выполнил газ во время переходов из состояния 1 в состояние 2 в ходе
- 9. Домашнее задание: р V 1 2 а б Газ переводится из состояния 1 в состояние 2
- 11. Скачать презентацию
вспомним
Какие формулировки первого закона термодинамики вам известны?
Какие формулы используются?
ΔU
=
вспомним
Какие формулировки первого закона термодинамики вам известны?
Какие формулы используются?
ΔU
=
+ Q
Q =
ΔU
+ A
Применение первого закона термодинамики к изобарному
процессу
Применение первого закона термодинамики к изотермическому процессу
Т=const , ΔU = 0
Q = A
Q = 0 + A
Применение первого закона термодинамики к
изохорному процессу
V = const , A = 0
Q = 0 + ΔU
Q = ΔU
Какой процесс называется адиабатным?
Применение первого закона термодинамики к
адиабатному процессу
Q = 0 , ΔU = 0 + А , ΔU = 0 - А
ΔU = А
ΔU = - А
Учимся анализировать графики
р
V
V2
V1
1.
Определим характер теплообмена в ходе
процесса, изображенного на
Учимся анализировать графики
р
V
V2
V1
1.
Определим характер теплообмена в ходе
процесса, изображенного на
1
2
1-2 :
V
, А > 0 и
Q = ΔU + A > 0 - газ получает тепло
Изотерма, т.е. Т = const , ΔU = 0 ,
2 -1:
V
А < 0 и
Q = ΔU + A < 0 - газ отдает тепло
р
V
V
1
2
р1
р2
2
Каков характер теплообмена с окружающей средой?
Изохора, т.е. V = const , А = 0
1-2:
Т (т.к. переходим на изотерму, лежащую выше)
или второй способ рассуждения: т.к. р ,то и Т
р
V
T
= const
значит, ΔU > 0
и Q = ΔU + A > 0 - газ получает тепло
2 -1:
Т (т.к. переходим на изотерму, лежащую ниже)
или : т.к. р , то и Т
значит, ΔU < 0
и Q = ΔU + A < 0 - газ отдает тепло
р
V
T1
T2
3
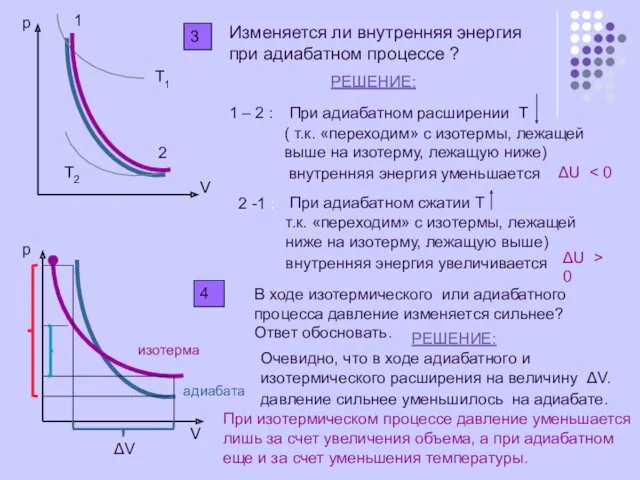
Изменяется ли внутренняя энергия при адиабатном процессе ?
РЕШЕНИЕ:
1
2
1 – 2 :
При
р
V
T1
T2
3
Изменяется ли внутренняя энергия при адиабатном процессе ?
РЕШЕНИЕ:
1
2
1 – 2 :
При
( т.к. «переходим» с изотермы, лежащей
выше на изотерму, лежащую ниже)
внутренняя энергия уменьшается
ΔU < 0
2 -1 :
При адиабатном сжатии Т
т.к. «переходим» с изотермы, лежащей
ниже на изотерму, лежащую выше)
внутренняя энергия увеличивается
ΔU > 0
р
V
4
В ходе изотермического или адиабатного
процесса давление изменяется сильнее?
Ответ обосновать.
изотерма
адиабата
ΔV
РЕШЕНИЕ:
Очевидно, что в ходе адиабатного и
изотермического расширения на величину ΔV.
давление сильнее уменьшилось на адиабате.
При изотермическом процессе давление уменьшается
лишь за счет увеличения объема, а при адиабатном
еще и за счет уменьшения температуры.
P
V
B
1
2
Идеальный газ переходит из состояния А в состояние В сначала в
P
V
B
1
2
Идеальный газ переходит из состояния А в состояние В сначала в
одинаково ли изменяется внутренняя энергия
одинаковая ли совершается работа
одинаковое ли количество теплоты получает газ
РЕШЕНИЕ:
Запишем первый закон термодинамики
Q = ΔU + A
1. Внутренняя энергия – это функция состояния, а так как начальное и конечное состояния газа в ходе процессов 1 и 2 одинаковы, то и изменение внутренней энергии одинаково:
2. Сравним площади фигур под графиками процессов 1 и 2 :
S1 > S2 значит, А1 > A2
3. Согласно первому закону термодинамики,
так как ΔU1 = ΔU2 и А1 > A2 , то Q1 > Q2
ВАЖНО: При совпадении начального и конечного состояний, газ совершает большую работу и получает большее количество теплоты в ходе того процесса, график которого лежит выше в координатах РV
ΔU1 = ΔU2
5
р
v
1
2
3
4
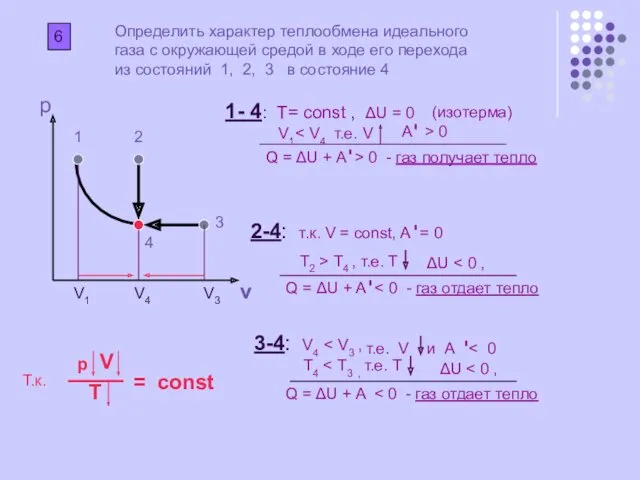
Определить характер теплообмена идеального газа с окружающей средой в ходе его
р
v
1
2
3
4
Определить характер теплообмена идеального газа с окружающей средой в ходе его
из состояний 1, 2, 3 в состояние 4
1- 4: Т= const , ΔU = 0
V1< V4 т.е. V
V1
V4
V3
Q = ΔU + A > 0 - газ получает тепло
2-4: т.к. V = const, A = 0
Т2 > Т4 , т.е. T
Q = ΔU + A < 0 - газ отдает тепло
3-4: V4 < V3 ,
Т4 < Т3 , т.е. T
Q = ΔU + A < 0 - газ отдает тепло
(изотерма)
A > 0
p
V
T
= const
Т.к.
ΔU < 0 ,
ΔU < 0 ,
т.е. V
и А < 0
6
Решаем самостоятельно
Определите знак работы газа при переходах из состояний
1, 2,
Решаем самостоятельно
Определите знак работы газа при переходах из состояний
1, 2,
с окружающей средой
т
V
1
2
3
РЕШЕНИЕ :
1
Работа не совершается , т.к. V = 0
ΔU > 0 , т.к. Т ,значит, Q = ΔU > 0
газ получает тепло
2
V , значит,, A < 0
Т , значит, ΔU < 0, т.о. Q < 0
газ отдает тепло
3
ΔU = 0, т.к. Т = const
V ,значит, A > 0 , т.о. Q > 0
газ получает тепло
Одинаковую ли работу выполнил газ во время переходов из состояния 1
Одинаковую ли работу выполнил газ во время переходов из состояния 1
р
V
1
2
а
б
РЕШЕНИЕ :
Нет, работа газа различна в ходе процессов
а и б несмотря на то, что площади фигур,
ограниченных графиками циклов, равны.
На участке 1-а работа отрицательна
( т.к. объем уменьшается), а на участке а-2 она положительна ( т.к. объем газа увеличивается. В итоге, работа газа в ходе процесса а положительна
На участке 1-б работа газа положительна ( т.к. объем увеличивается ), а на участке б-2 она отрицательна ( т.к. объем газа уменьшается).
В итоге, работа газа в ходе процесса б отрицательна.
Таким, образом, большая работа выполняется газом в ходе процесса а
Домашнее задание:
р
V
1
2
а
б
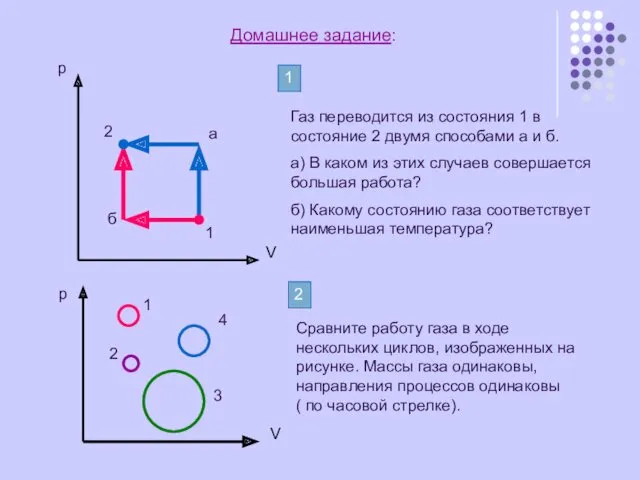
Газ переводится из состояния 1 в состояние 2 двумя способами
Домашнее задание:
р
V
1
2
а
б
Газ переводится из состояния 1 в состояние 2 двумя способами
а) В каком из этих случаев совершается большая работа?
б) Какому состоянию газа соответствует наименьшая температура?
1
р
V
1
2
3
4
2
Сравните работу газа в ходе нескольких циклов, изображенных на рисунке. Массы газа одинаковы, направления процессов одинаковы ( по часовой стрелке).





 Hseimun diplomacy club
Hseimun diplomacy club Артериальная гипертония
Артериальная гипертония Искусственный интеллект 3008
Искусственный интеллект 3008 Использование пакета прикладных программ Microsoft Office в профессиональной деятельности
Использование пакета прикладных программ Microsoft Office в профессиональной деятельности Нотариаттық iс-әрекеттер жасаудың негiзгi ережелерi
Нотариаттық iс-әрекеттер жасаудың негiзгi ережелерi Ата-ана алдындағы парыз
Ата-ана алдындағы парыз Бейбітшілік мақсатында атом энергиясын қолдану
Бейбітшілік мақсатында атом энергиясын қолдану Правила игры в настольный теннис (основные понятия) учебно–методические пособие Диск
Правила игры в настольный теннис (основные понятия) учебно–методические пособие Диск Проект Земля – наш общий дом
Проект Земля – наш общий дом Презентация к занятию по внеурочной деятельности Полдник. Пора есть булочки
Презентация к занятию по внеурочной деятельности Полдник. Пора есть булочки Выбор журнала
Выбор журнала Национальная политика в Донбассе
Национальная политика в Донбассе Лальск
Лальск Презентация по дорожной безопасности Горит зеленый огонек
Презентация по дорожной безопасности Горит зеленый огонек Мой опыт использования разнообразных форм работы с родителями
Мой опыт использования разнообразных форм работы с родителями Выставочный павильон Космос
Выставочный павильон Космос Конспект и презентация по теме Из истории Российской Армии
Конспект и презентация по теме Из истории Российской Армии Проект по исследованию в действии в рамках всей школы
Проект по исследованию в действии в рамках всей школы 20230711_prez_k_otkr_uroku
20230711_prez_k_otkr_uroku Вилла Майреа, архитектор Алвар Аалто
Вилла Майреа, архитектор Алвар Аалто Презентация к сообщению Календари
Презентация к сообщению Календари Неисправности и условия допуска транспортных средств к эксплуатации. Вопросы
Неисправности и условия допуска транспортных средств к эксплуатации. Вопросы Сказочное королевство
Сказочное королевство Нельзя обижать животных
Нельзя обижать животных Вижен-Софт. Питание в детском саду 1.0
Вижен-Софт. Питание в детском саду 1.0 Обобщение педагогического опыта на тему: Развитие креативности обучающихся на занятиях в Театре Моды Силуэт через систему творческих заданий.
Обобщение педагогического опыта на тему: Развитие креативности обучающихся на занятиях в Театре Моды Силуэт через систему творческих заданий. Усиление и замена несущих конструкций при реконструкции производственных зданий. (Лекция 4)
Усиление и замена несущих конструкций при реконструкции производственных зданий. (Лекция 4) Русский язык на 4 февраля
Русский язык на 4 февраля