Содержание
- 2. Цели урока: Сформировать понятие о кислотах; Рассмотреть их классификацию по разным признакам; Познакомиться с химическими свойствами
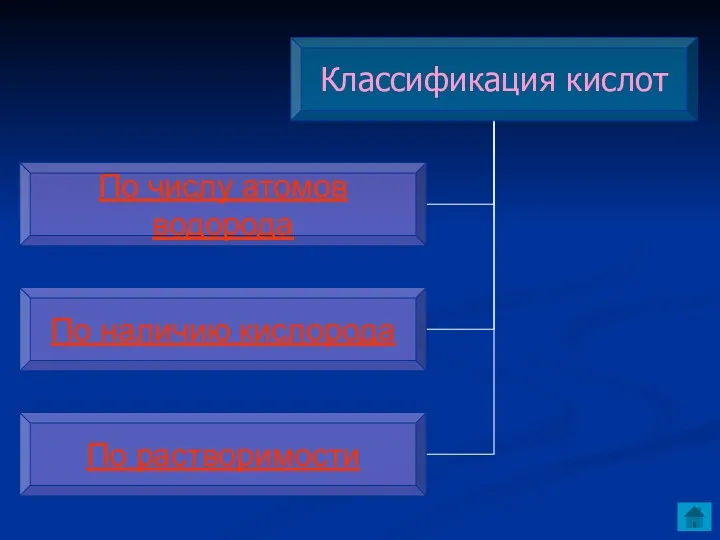
- 3. План урока. Повторение. Изучение нового материала: 1) Классификация кислот; 2) Химические свойства кислот. Домашнее задание .
- 4. Щавель, неспелые фрукты, лимон… Что общего между ними? В них содержатся кислоты.
- 5. Кислоты в природе и в жизни человека.
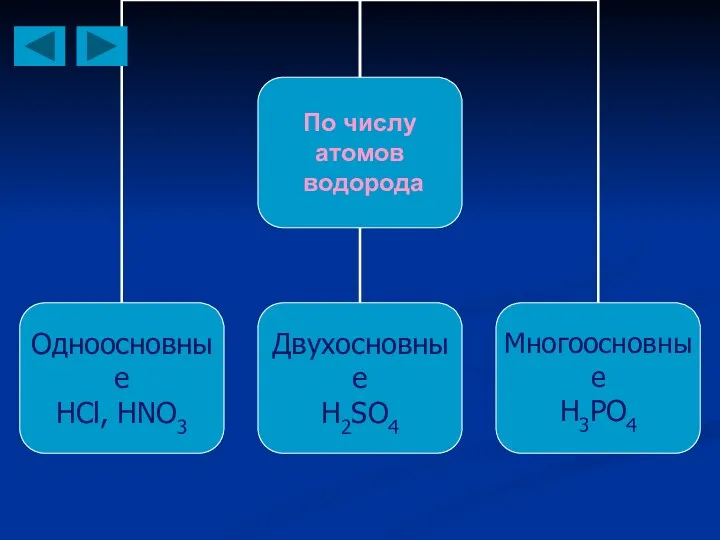
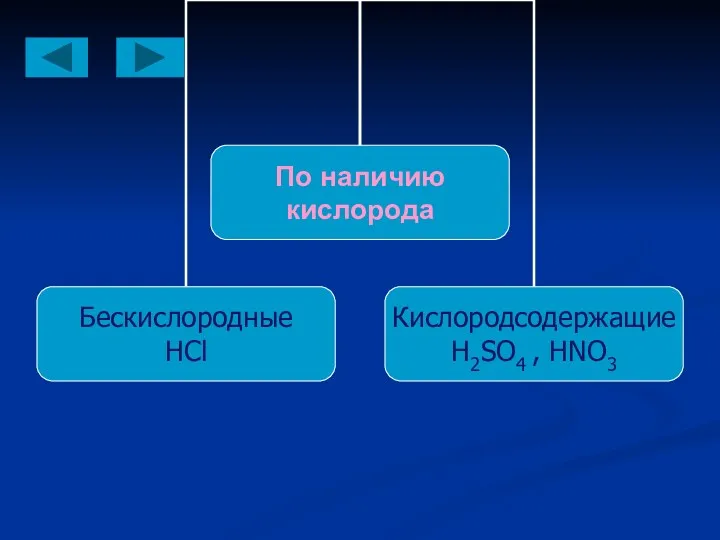
- 6. Что такое кислоты? Сложные вещества, состоящие из атомов водорода, соединенных с кислотным остатком (HCl, H2SO4) Электролиты,
- 7. Задание: Из ряда веществ выбрать кислоты: H2SO4, CO2, HNO3, HCl, NO, H2CO3, CuO, MgS, H3PO4
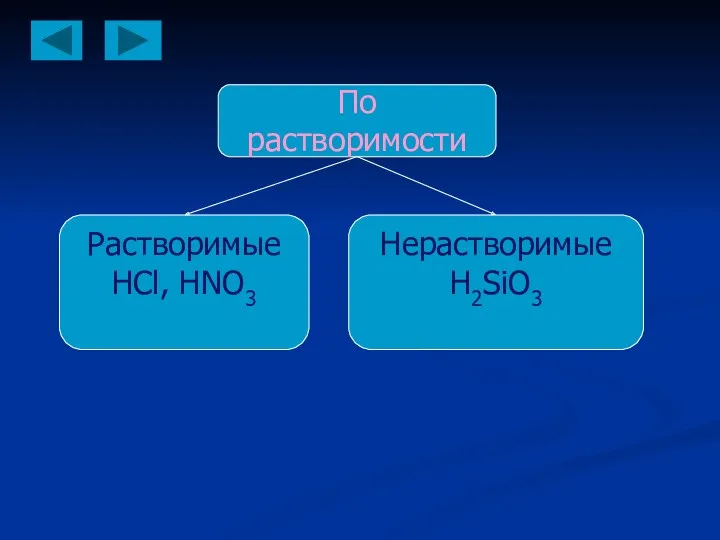
- 11. По растворимости Растворимые HCl, HNO3 Нерастворимые H2SiO3
- 12. Химические свойства кислот: Диссоциация; Взаимодействие с индикаторами; Взаимодействие с металлами; Взаимодействие с основными оксидами; Взаимодействие с
- 13. При работе с кислотами необходимо соблюдать правила техники безопасности ! ! !
- 14. Диссоциация кислот HCl → HNO3 → H++ Cl- H+ + NO3-
- 15. Изменение окраски индикаторов. Нерастворимые кислоты не меняют окраску индикаторов.
- 16. Взаимодействие с металлами металл + кислота→соль + водород Zn + 2HCl = ZnCl2 + H2 Реакция
- 17. Взаимодействие с основными оксидами Основный оксид + кислота → соль + вода CuO + H2SO4 =
- 18. Взаимодействие с основаниями Основание + кислота → соль + вода H2SO4 + 2NaOH = Na2SО4 +
- 19. Взаимодействие с солями Реакция возможна, если в результате образуется осадок, газ или слабый электролит . Кислота
- 21. Скачать презентацию














 Мастер -класс Божья коровка в технике канзаши Диск
Мастер -класс Божья коровка в технике канзаши Диск Правовое обеспечение местного самоуправления. Часть 2
Правовое обеспечение местного самоуправления. Часть 2 Презентация к логопедическому занятию в подготовительной группе по теме Ранняя весна.
Презентация к логопедическому занятию в подготовительной группе по теме Ранняя весна. a6e9bd53623e7a70f46310600f3
a6e9bd53623e7a70f46310600f3 Художественно – эстетическое развитие в МБДОУ, компенрсирующего вида №3 Ручеёк.
Художественно – эстетическое развитие в МБДОУ, компенрсирующего вида №3 Ручеёк. Основные модели развития науки и их критический анализ: кумулятивизм и антикумулятивизм, прогрессивизм и антипрогрессивизм
Основные модели развития науки и их критический анализ: кумулятивизм и антикумулятивизм, прогрессивизм и антипрогрессивизм Вирусные болезни схж - крс, мрс
Вирусные болезни схж - крс, мрс Организация предметно-пространственной среды для театрализованной деятельности
Организация предметно-пространственной среды для театрализованной деятельности Мини-проект Предприятия нашего города ОАО Невская косметика
Мини-проект Предприятия нашего города ОАО Невская косметика Switching systems
Switching systems Развитие артикуляционной моторики. Информация для родителей от учителя-логопеда.
Развитие артикуляционной моторики. Информация для родителей от учителя-логопеда. Работа с родителями в ДОУ (презентация)
Работа с родителями в ДОУ (презентация) GalaxyS7 Edge Repair Tips Troubleshooting Guide (by Part)
GalaxyS7 Edge Repair Tips Troubleshooting Guide (by Part) Классный час. Правила дорожного движения
Классный час. Правила дорожного движения Преемственность в обучении начальной школы и среднего звена
Преемственность в обучении начальной школы и среднего звена Биологическое оружие и его виды
Биологическое оружие и его виды Графика: прошлое и настоящее
Графика: прошлое и настоящее Жизненные цели подростка
Жизненные цели подростка Презентация к уроку с Марусей
Презентация к уроку с Марусей Методические рекомендации по оформлению научных работ
Методические рекомендации по оформлению научных работ Antihypertensive and lipid-lowering drugs
Antihypertensive and lipid-lowering drugs Природные комплексы Русской равнины. Презентация ученицы 8 класса МОУ Весеннинская ООШ Василевич Елены
Природные комплексы Русской равнины. Презентация ученицы 8 класса МОУ Весеннинская ООШ Василевич Елены Групповая работа. Команды по 4 ученика
Групповая работа. Команды по 4 ученика Урок хими 9 класс Реакции ионного обмена
Урок хими 9 класс Реакции ионного обмена Методы исследования в биологии
Методы исследования в биологии Консультация для педагогов Влияние музыки на психику человека
Консультация для педагогов Влияние музыки на психику человека Технология подключения, настройки и проверки работоспособности печатающих устройств
Технология подключения, настройки и проверки работоспособности печатающих устройств Инновационные технологии производства рыбных товаров
Инновационные технологии производства рыбных товаров