Содержание
- 2. ВАЖНЕЙШИЕ РЕАКЦИИ ЭЛЕКТРОФИЛЬНОГО ЗАМЕЩЕНИЯ (SE ) 1.1. Галогенирование. Бензол реагирует с Cl2 и Br2 в присутствии
- 3. Электрофильными реагентами являются частицы, обладающие высоким сродством к электронам. Это могут быть как положительно заряженные частицы
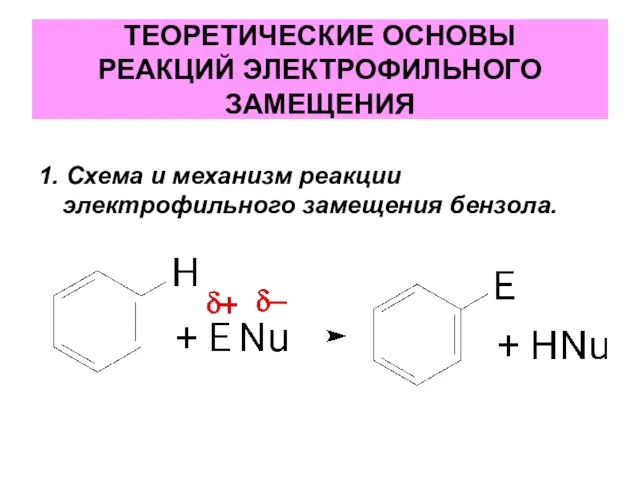
- 4. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ РЕАКЦИЙ ЭЛЕКТРОФИЛЬНОГО ЗАМЕЩЕНИЯ 1. Схема и механизм реакции электрофильного замещения бензола.
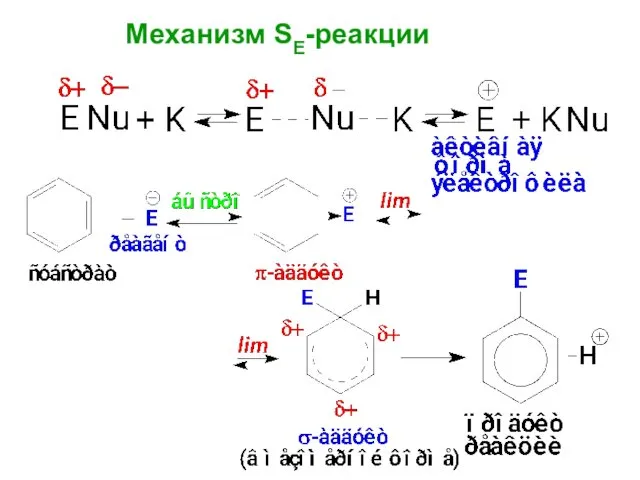
- 5. Механизм: SE Стадии механизма: - Активация реагента; (получение активной формы электрофила); - образование π-аддукта; - образование
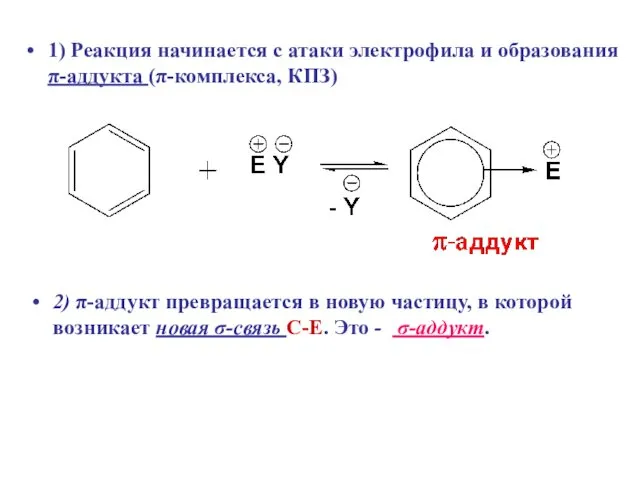
- 6. 1) Реакция начинается с атаки электрофила и образования π-аддукта (π-комплекса, КПЗ) 2) π-аддукт превращается в новую
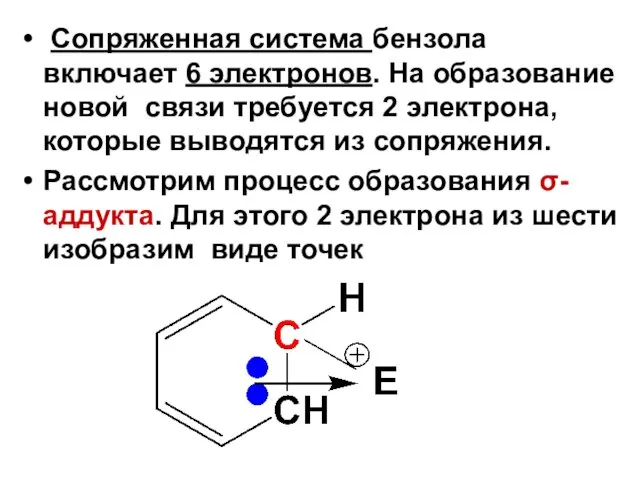
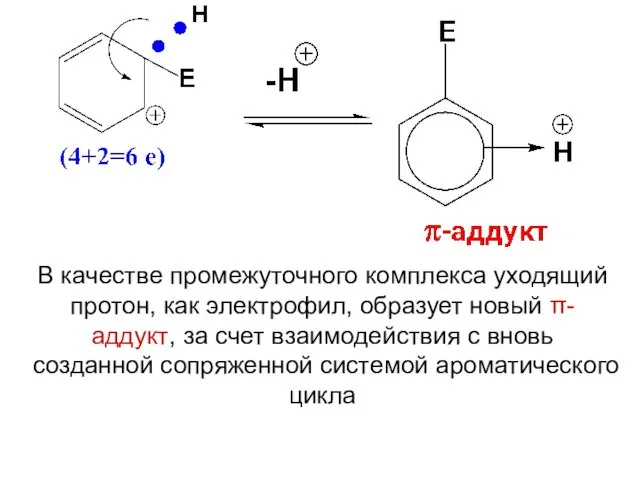
- 7. Сопряженная система бензола включает 6 электронов. На образование новой связи требуется 2 электрона, которые выводятся из
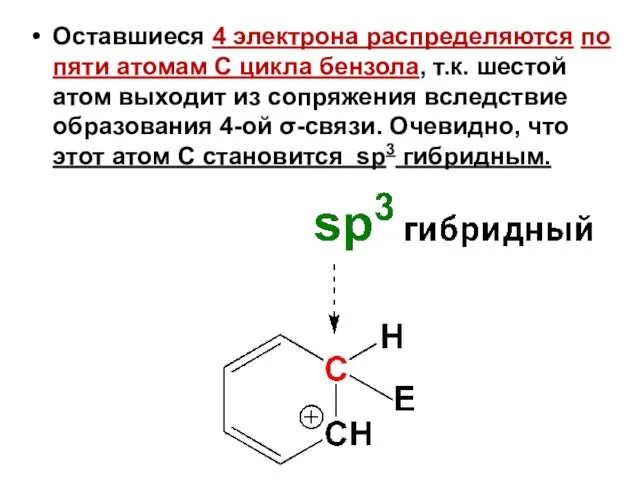
- 8. Оставшиеся 4 электрона распределяются по пяти атомам С цикла бензола, т.к. шестой атом выходит из сопряжения
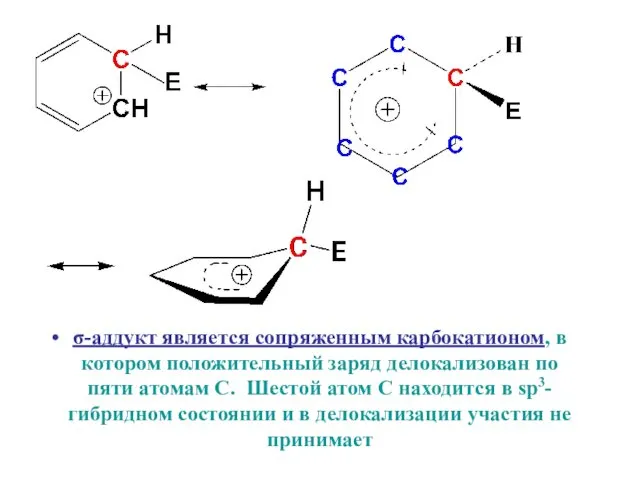
- 9. σ-аддукт является сопряженным карбокатионом, в котором положительный заряд делокализован по пяти атомам С. Шестой атом С
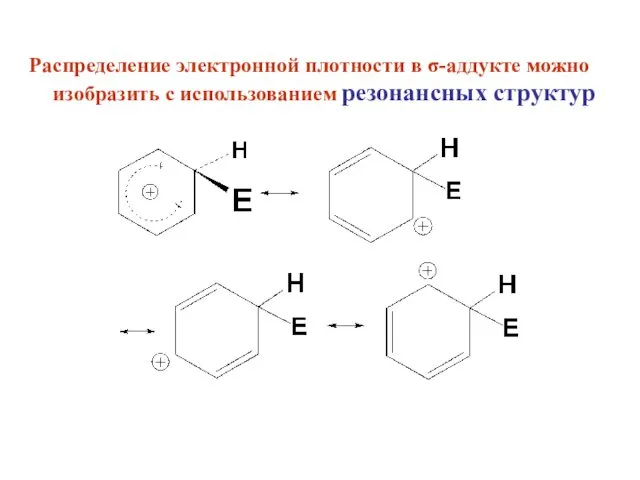
- 10. Распределение электронной плотности в σ-аддукте можно изобразить с использованием резонансных структур
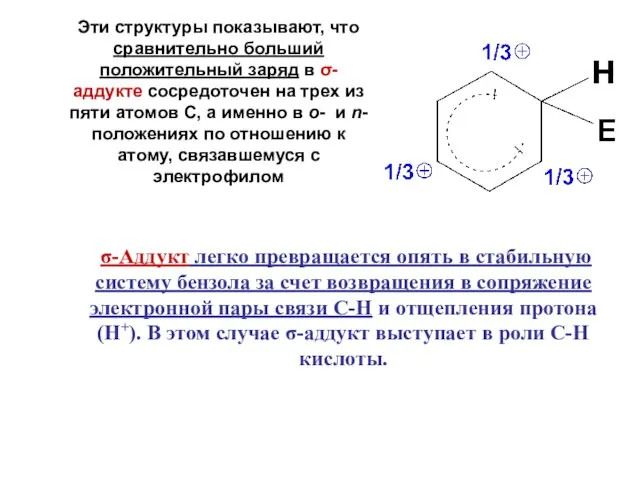
- 11. Эти структуры показывают, что сравнительно больший положительный заряд в σ-аддукте сосредоточен на трех из пяти атомов
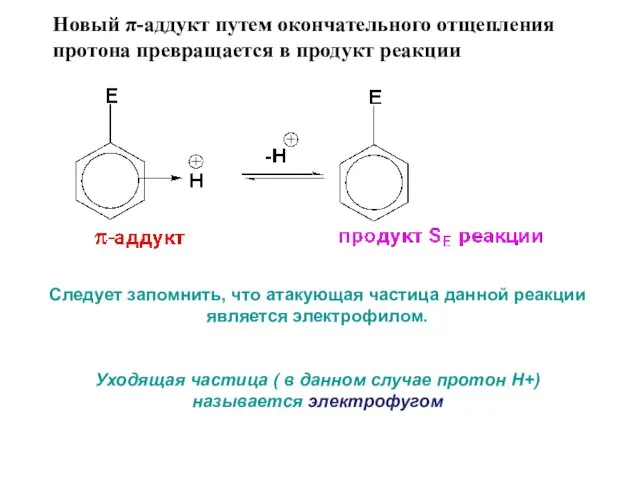
- 12. В качестве промежуточного комплекса уходящий протон, как электрофил, образует новый π-аддукт, за счет взаимодействия с вновь
- 13. Новый π-аддукт путем окончательного отщепления протона превращается в продукт реакции Следует запомнить, что атакующая частица данной
- 14. Механизм SE-реакции
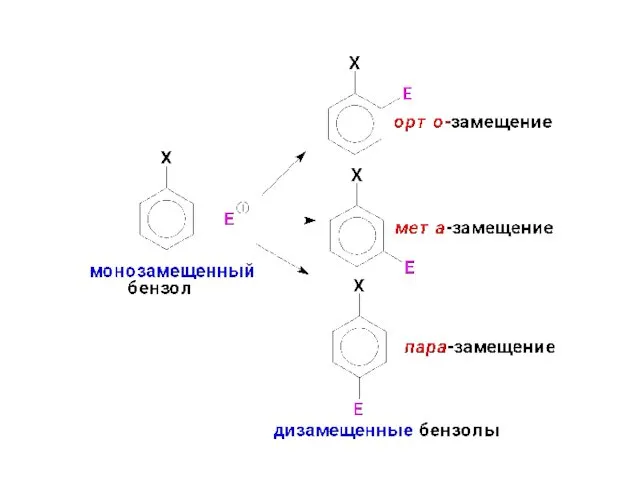
- 15. 3. Влияние заместителей на скорость и направление SE-реакций в монозамещенных бензолах Заместители в бензольном кольце нарушают
- 17. По своему влиянию на ориентацию в SE-реакциях все заместители Х делятся на: орто-, пара-ориентанты (ориентанты I-го
- 18. − активирующими; дезактивирующими. Все ЭД заместители являются активирующими. Они активируют бензольное кольцо, повышают скорость SE-реакции, являются
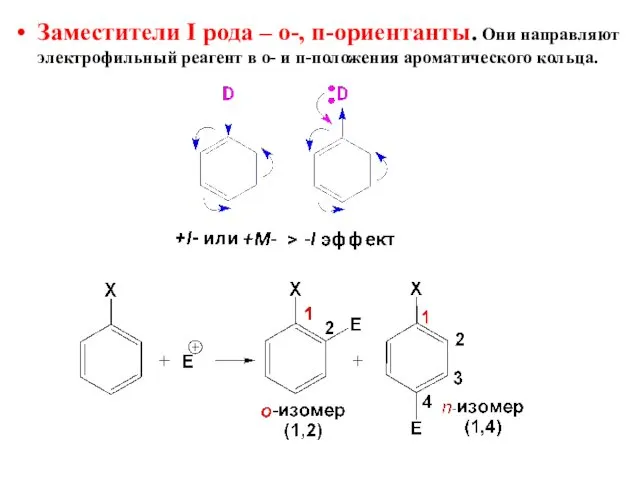
- 19. Заместители I рода – о-, п-ориентанты. Они направляют электрофильный реагент в о- и п-положения ароматического кольца.
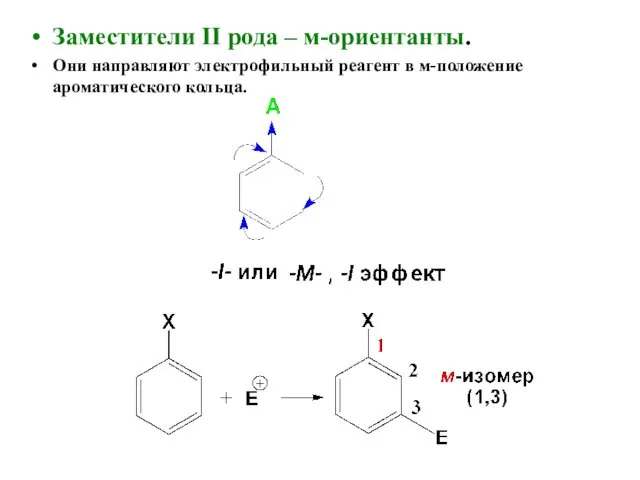
- 20. Заместители II рода – м-ориентанты. Они направляют электрофильный реагент в м-положение ароматического кольца.
- 21. орто-, пара-Ориентанты (заместители I рода) Относятся все электронодонорные заместители, а также галогениды ЭД-заместители стабилизируют π- и
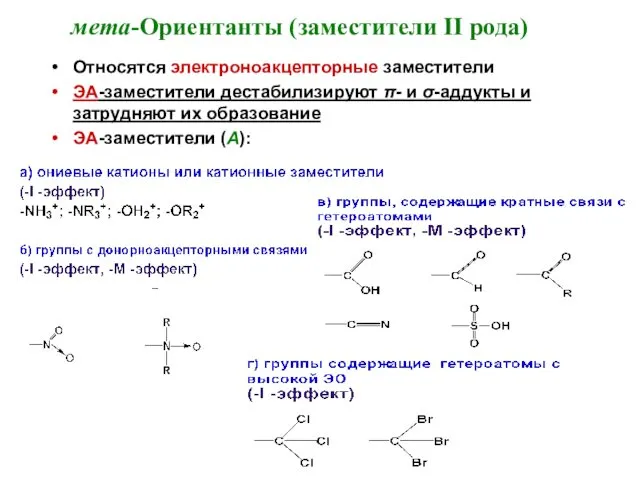
- 22. мета-Ориентанты (заместители II рода) Относятся электроноакцепторные заместители ЭА-заместители дестабилизируют π- и σ-аддукты и затрудняют их образование
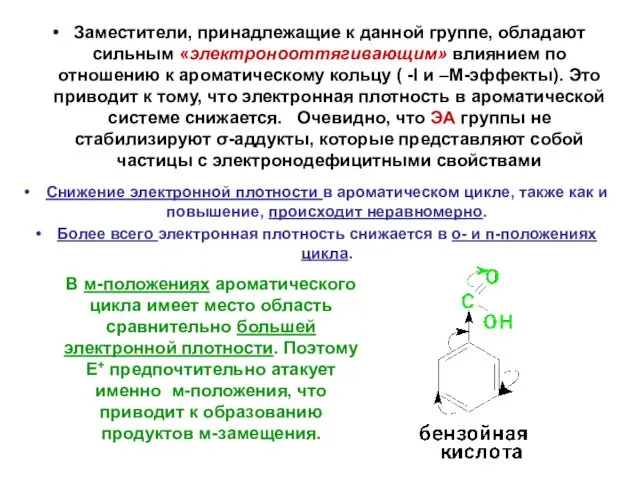
- 23. Заместители, принадлежащие к данной группе, обладают сильным «электронооттягивающим» влиянием по отношению к ароматическому кольцу ( -I
- 24. Заместители смешанного типа (−СH2Cl, −СH2OH, −СHCl2) не обладают выраженным эффектом ориентации. В этом случае в реакциях
- 25. Влияние заместителей на направление SE-реакций в дизамещенных бензолах В дизамещенных производных бензола возможно 2 типа ориентирующего
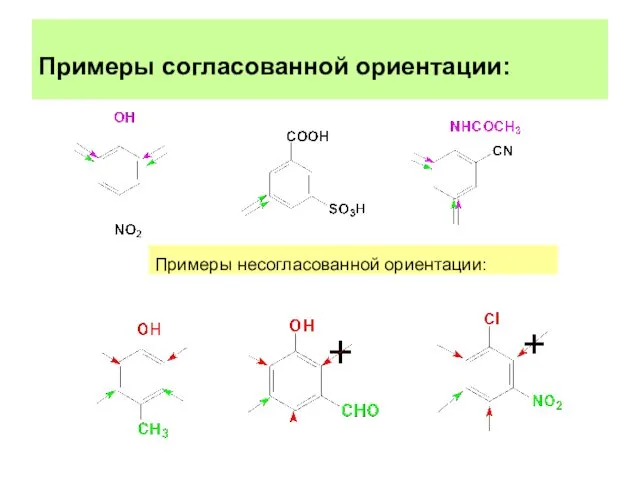
- 26. Примеры согласованной ориентации: Примеры несогласованной ориентации:
- 28. Скачать презентацию









 Механизмы и формы видообразования
Механизмы и формы видообразования Устройство и конструкция основных элементов холодного водопровода (Тема 2)
Устройство и конструкция основных элементов холодного водопровода (Тема 2) Единая система конструкторской документации
Единая система конструкторской документации Определение жесткости токарного станка производственным методом
Определение жесткости токарного станка производственным методом Методическая разработка презентации: Развитие анализа структуры предложения
Методическая разработка презентации: Развитие анализа структуры предложения Сырье для производства строительной керамики. Часть 2
Сырье для производства строительной керамики. Часть 2 Организация свободного времени подростка. Труд и отдых в летние каникулы
Организация свободного времени подростка. Труд и отдых в летние каникулы Магматические месторождения. (Лекция 2)
Магматические месторождения. (Лекция 2) Wybory sąmorzadowe
Wybory sąmorzadowe Проектирование программы духовно-нравственного воспитания
Проектирование программы духовно-нравственного воспитания Футуризм в искусстве
Футуризм в искусстве конспект занятия Определение азимута
конспект занятия Определение азимута Знаки-помощники
Знаки-помощники Развитие коммуникативной функции речи у дошкольников с ОНР
Развитие коммуникативной функции речи у дошкольников с ОНР Монолог-рассуждение о влиянии наркотических веществ на организм человека
Монолог-рассуждение о влиянии наркотических веществ на организм человека Изменения политической системы
Изменения политической системы Изменения в нормативном регулировании строительства. Практическое применение положений законодательства
Изменения в нормативном регулировании строительства. Практическое применение положений законодательства Треугольник. Равенство и подобие треугольников
Треугольник. Равенство и подобие треугольников Как стать добрым человеком
Как стать добрым человеком Имена существительные, которые имеют форму только единственного числа
Имена существительные, которые имеют форму только единственного числа Растительность Уссурийской тайги
Растительность Уссурийской тайги Железные дороги сложной конфигурации в горах
Железные дороги сложной конфигурации в горах Образцы основных документов управления
Образцы основных документов управления Использование роз в ландшафтной архитектуре музея-заповедника Ясная Поляна
Использование роз в ландшафтной архитектуре музея-заповедника Ясная Поляна Презентация к родительскому собранию Зелёная аптека на окне
Презентация к родительскому собранию Зелёная аптека на окне Кардиоэмболический инсульт
Кардиоэмболический инсульт Кормовые культуры в Северном регионе Казахстана
Кормовые культуры в Северном регионе Казахстана Безопасность в сети интернет
Безопасность в сети интернет