Слайд 2

Слайд 3
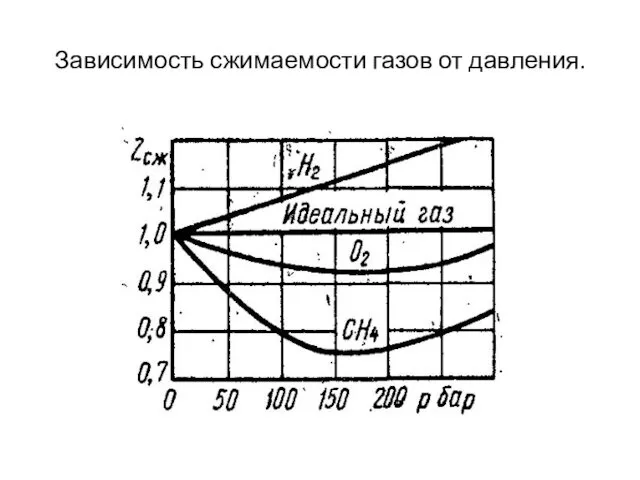
Зависимость сжимаемости газов от давления.
Слайд 4

5.2.Уравнение Ван-дер-Ваальса.
Уравнение Менделеева-Клапейрона удовлетворительно описывает разряжённые газы.
Это значит, новое уравнение должно
для малых плотностей газов переходить в уравнение Менделеева-Клапейрона.
Уравнение Менделеева-Клапейрона должно быть просто модифицировано.
Слайд 5

Собственный объём молекул.
Слайд 6
Слайд 7

Слайд 8

Уравнение Ван-дер-Ваальса.
Слайд 9

Уравнение Ван-дер-Ваальса для любого количества вещества.
Слайд 10

Слайд 11
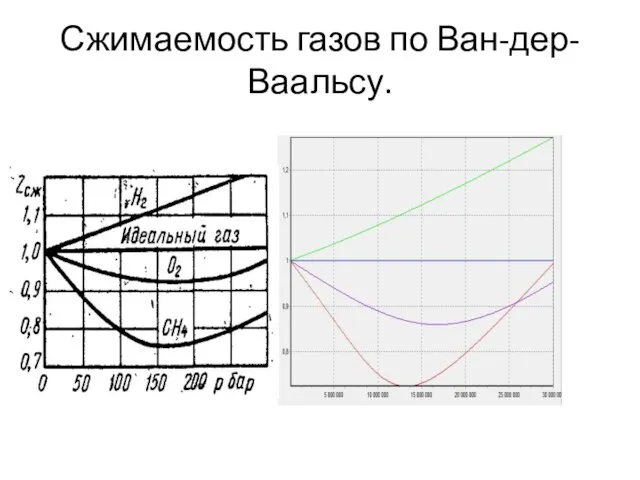
Сжимаемость газов по Ван-дер-Ваальсу.
Слайд 12
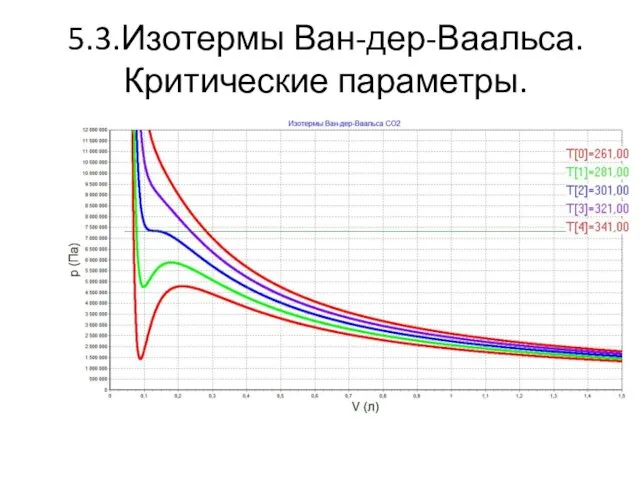
5.3.Изотермы Ван-дер-Ваальса. Критические параметры.
Слайд 13

Изотермы Вар-дер-Ваальса.
Progr D: Progr E: Progr F: Progr G: Progr H:
Слайд 14

Система уравнений для отыскания Критических параметров.
Слайд 15

Слайд 16

Слайд 17

Слайд 18

Слайд 19

Слайд 20
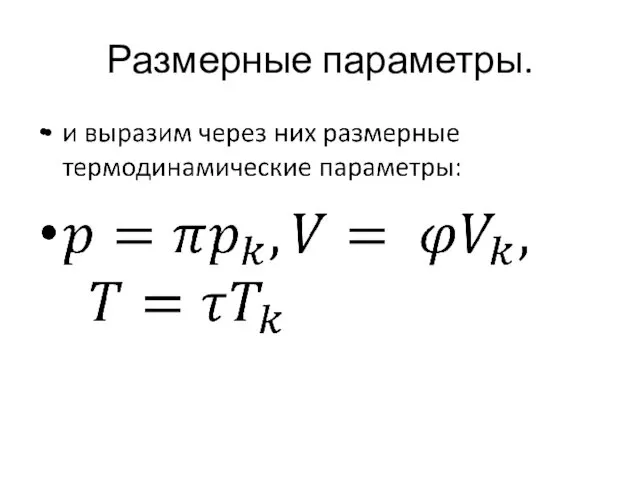
Слайд 21

Уравнение Ван-дер-Ваальса с безразмерными параметрами.
Слайд 22

Безразмерное уравнение Ван-дер-Ваальса.
Слайд 23
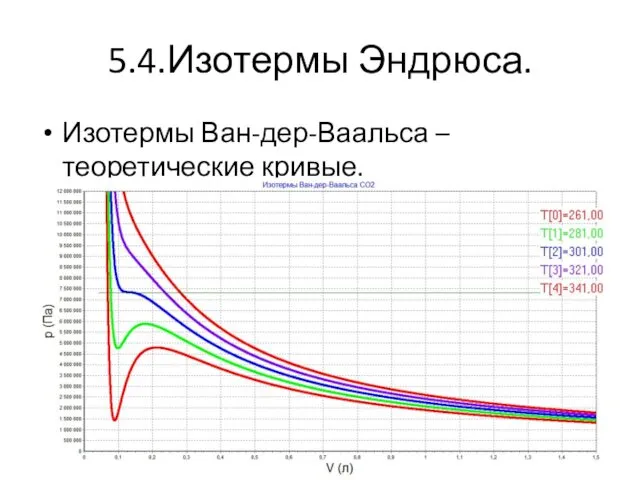
5.4.Изотермы Эндрюса.
Изотермы Ван-дер-Ваальса – теоретические кривые.
Слайд 24

Эксперименты Марума.
Экспериментальные изотермы выглядят иначе.
Марум обнаружил возможность сжижения газов. При 7
Атм. Давление преставало изменяться.
Слайд 25

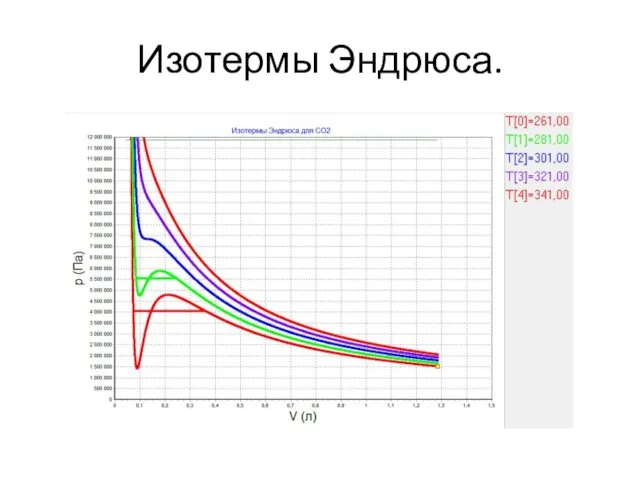
Исследование Эндрюса.
Английский химик Томас Эндрюс (1813 – 1885) исследовал углекислый газ.
Заметил появление капелек жидкости, которые постепенно разрастались и заполнили весь объём под поршнем.
Слайд 26
Слайд 27

Исследование изотерм Эндрюса.
Progr D: Progr E: Progr F: Progr G: Progr
H:
Слайд 28

Слайд 29

Условие сжижения газов.
Чтоб сжидить газ его нужно охладить до температуры ниже
критической.
Этим объясняется неудача многих экспериментаторов, старавшихся превратить в жидкость такие газы, как кислород, азот и т.п.
Слайд 30

Правило рычага. Обозначения.
Слайд 31
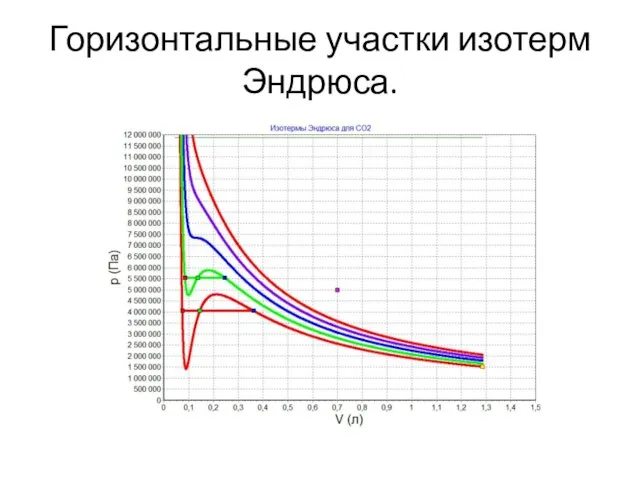
Горизонтальные участки изотерм Эндрюса.
Слайд 32

Плотности жидкости и газа.
Слайд 33

Слайд 34

Отрезки на горизонтальном участке
Слайд 35

Формулировка правила рычага.
Таким образом, массы фаз, жидкой и газообразной, обратно пропорциональны
величинам отрезков от текущей точки на горизонтальной части изотерм Эндрюса до концов горизонтального отрезка.
Это утверждение и носит название правило рычага, т.к. оно совпадает с условием равновесия рычага, на концах которого подвешены грузы.
Слайд 36

5.5. Внутренняя энергия газа Ван-дер-Ваальса.
Слайд 37

Зависимость внутренней энергии от температуры.
Слайд 38

Полная зависимость внутренней энергии
Слайд 39

Слайд 40

5.6.Эффект Джоуля-Томсона.
Работы по сжижению газов.
Опыты Джоуля и Томсона по дросселированию.
Определение.
Дросселированием называется
процесс пропускания газа через какое-либо препятствие.
Слайд 41

Слайд 42

Определение эффекта Джоуля-Томсона.
Эффектом Джоуля-Томсона называется явление изменения температуры газа при дросселировании.
Слайд 43

Слайд 44

Изменение внутренней энергии.
Слайд 45

Слайд 46

Слайд 47

Производная температуры по давлению.
Слайд 48

Теплоёмкость при постоянном давлении.
Слайд 49

Естественные параметры.
Определение.
Естественными параметрами некоторой термодинамической функции состояния называются параметры, через дифференциалы
которых выражается дифференциал этой функции, исходя из первого начала термодинамики.
Слайд 50

Слайд 51

Дифференциал внутренней энергии.
Слайд 52

Преобразование первого начала термодинамики.
Слайд 53

Дифференциал энтальпии в естественных параметрах.
Слайд 54

Производная энтальпии по давлению
Слайд 55

Формула эффекта Джоуля-Томсона.
Слайд 56

Термодинамический потенциал Гиббса
Слайд 57

Математическая формула дифференциала потенциала Гиббса.
Слайд 58

Выражения для давления и энтропии.
Слайд 59

Общая формула Эффекта Джоуля-Томсона.
Слайд 60

Слайд 61

5.7.Идеальный и реальный газы.
Слайд 62

Слайд 63

Производная от объёма по температуре.
Слайд 64

Слайд 65

Слайд 66

Слайд 67

Слайд 68



















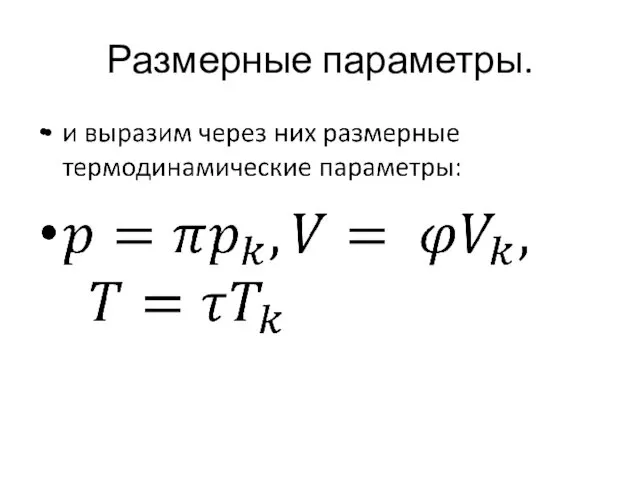
















































 Буклет на звуки Ч, Щ.
Буклет на звуки Ч, Щ. Обеспечение реализации прав граждан на социальное обслуживание в Российской Федерации
Обеспечение реализации прав граждан на социальное обслуживание в Российской Федерации Подготовка к ОГЭ 2021. Синтаксический анализ предложения
Подготовка к ОГЭ 2021. Синтаксический анализ предложения The articulation bases of English and Russian
The articulation bases of English and Russian Внешняя политика Николая I. Крымская война 1853-1856 гг
Внешняя политика Николая I. Крымская война 1853-1856 гг Ты сам-мастер. Моя неповторимая ваза
Ты сам-мастер. Моя неповторимая ваза Особенности ГИС в наклонно-направленных скважинах с горизонтальным окончанием
Особенности ГИС в наклонно-направленных скважинах с горизонтальным окончанием ТЦ Жәңгір Хан
ТЦ Жәңгір Хан Артистические профессии средневековья
Артистические профессии средневековья Презентация о Тамбове
Презентация о Тамбове Термическая и химико-термическая обработка металлов и сплавов
Термическая и химико-термическая обработка металлов и сплавов Функции. Лекция 5 по алгоритмизации и программированию
Функции. Лекция 5 по алгоритмизации и программированию Презентация к докладу Дифференциррованный подход в обучении химии
Презентация к докладу Дифференциррованный подход в обучении химии Юнармия. Реализация социального проекта Равнение на старшего, чтобы стать лучшим
Юнармия. Реализация социального проекта Равнение на старшего, чтобы стать лучшим Буквы Р р. Звуки [ р ] [ р’ ]
Буквы Р р. Звуки [ р ] [ р’ ] Презентация Руссая народная кукла. Домашние обрядовые куклы
Презентация Руссая народная кукла. Домашние обрядовые куклы 20230617_stefan_banah-_vydayushchiysya_polskiy_matematika_20_veka
20230617_stefan_banah-_vydayushchiysya_polskiy_matematika_20_veka Ненаправленная защита от замыканий на землю в сетях 6-35 кВ
Ненаправленная защита от замыканий на землю в сетях 6-35 кВ Презентация к уроку химии по теме: Хром
Презентация к уроку химии по теме: Хром классный час Моя малая Родина
классный час Моя малая Родина Амурский тигр (11 класс)
Амурский тигр (11 класс) Методологические принципы психологии
Методологические принципы психологии LW-P series IPG Fiber laser tube cutting machine. Technical solutions and quotations
LW-P series IPG Fiber laser tube cutting machine. Technical solutions and quotations Деление. Порядок выполнения действий. Степень числа. Квадрат и куб числа. Формулы. Площадь. Формулы площади. (5 класс)
Деление. Порядок выполнения действий. Степень числа. Квадрат и куб числа. Формулы. Площадь. Формулы площади. (5 класс) Международный день памятников и исторических мест
Международный день памятников и исторических мест Эоловые процессы
Эоловые процессы Ориентирование на местности. Стороны горизонта
Ориентирование на местности. Стороны горизонта Интелек-т карты
Интелек-т карты