Содержание
- 2. История открытия 1811 г. – в чистом виде кремний впервые выделили Жозеф Луи Гей-Люссак и Луи
- 3. Характеристика элемента «кремний» Неметалл Химический знак: Si Относительная атомная масса (Ar): 28,086 3 период, IV группа,
- 4. Характеристика элемента «кремний» Высший оксид: SiO2 (кислотный оксид) Летучее водородное соединение: SiH4 (силан)
- 5. Кремний Кристаллический Вещество серого цвета с металлическим блеском, имеет структуру алмаза, обладает большой твёрдостью и хрупкостью.
- 6. Распространение Кремний – второй по распространённости элемент на земле. В чистом виде практически не встречается. В
- 7. Способы получения SiO2 + 2Mg → 2MgO + Si (при этом, образуется аморфный кремний) В промышленности
- 8. Химические свойства Si – окислитель. Присоединяет 4 недостающих электрона и получает минимальную степень окисления: -4 Пример
- 9. Химические свойства Si – восстановитель. Отдаёт 4 валентных электрона и приобретает максимальную степень окисления: +4 Примеры
- 10. Химические свойства Восстановительные свойства кремний также проявляет по отношению к некоторым сложным веществам. Примеры: Si +
- 11. Диоксид кремния Формула – SiO2. Имеет атомную кристаллическую решётку Нерастворим в воде (SiO2 + H2O →)
- 12. Химические свойства диоксида кремния Как кислотный оксид: 1) Взаимодействует со щелочами: 2NaOH + SiO2 → Na2SiO3
- 13. Кремниевая кислота Формула: H2SiO3, правильнее: SiO2 nH2O Имеет атомную кристаллическую решётку Нерастворима в воде Слабая, непрочная
- 14. Применение Главная область применения – силикатная промышленность: Производство стекла, строительных материалов (цемент, кирпич); Изготовление изделий из
- 15. Сырьё для производства стекла: Na2CO3 (сода), CaCO3 (известняк) и SiO2 (песок). Обобщённая формула: Na2O x CaO
- 16. Если CaO в стекле заменить на PbO2, получится хрусталь
- 17. Солнечные батареи Кремний обладает способностью преобразовывать световую энергию в электрическую 25.04.1954 – впервые созданы солнечные батареи
- 18. Кремний и полимеры Силиконовый каучук, силиконовые смазки и герметики
- 20. Скачать презентацию

















 Презентация к уроку Основы светской этики по теме: Россия - наша Родина
Презентация к уроку Основы светской этики по теме: Россия - наша Родина Имя твое несу через года как святыню
Имя твое несу через года как святыню Радиоактивные методы
Радиоактивные методы Современный детский писатель - Андрей Алексеевич Усачёв
Современный детский писатель - Андрей Алексеевич Усачёв Оборотный капитал. Тема 5
Оборотный капитал. Тема 5 Жоламан Тіленшіұлы және Саржан Қасымұлы бастаған көтерілістер
Жоламан Тіленшіұлы және Саржан Қасымұлы бастаған көтерілістер Игра Ребусы. Животные
Игра Ребусы. Животные Защита прав предпринимателей при проведении в отношении них проверок органами власти
Защита прав предпринимателей при проведении в отношении них проверок органами власти Ордер. Архитектурные ордера
Ордер. Архитектурные ордера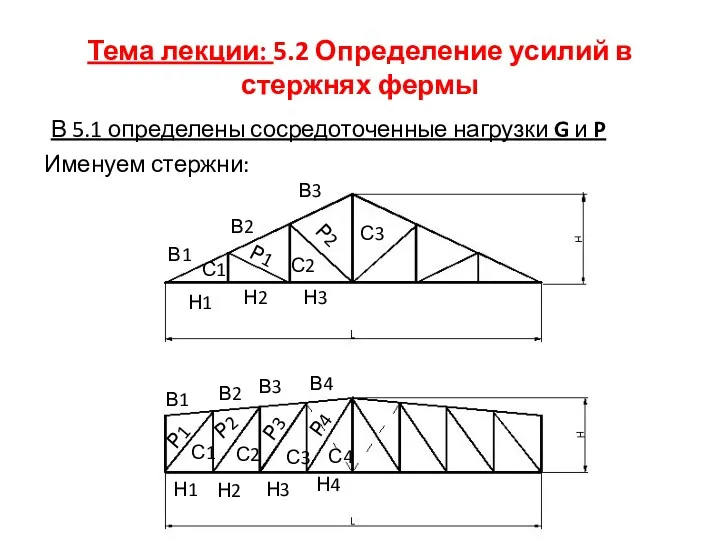 Определение усилий в стержнях фермы
Определение усилий в стержнях фермы Фантазируем. Мастер изображения
Фантазируем. Мастер изображения Внедрение системы 5S в заготовительном отделении цеха
Внедрение системы 5S в заготовительном отделении цеха Строение тела человека
Строение тела человека виртуальное общение благо или зло
виртуальное общение благо или зло Перечень и комплектность документов на ИС согласно ЕСПД и ЕСКД. Понятия и задачи документирования
Перечень и комплектность документов на ИС согласно ЕСПД и ЕСКД. Понятия и задачи документирования Мини-музей в детском саду Морское царство
Мини-музей в детском саду Морское царство Основная образовательная программа подготовки магистра
Основная образовательная программа подготовки магистра Водопоглощения. Форма зерен заполнителя и их взаимная укладка. Зерновой состав заполнителя
Водопоглощения. Форма зерен заполнителя и их взаимная укладка. Зерновой состав заполнителя Классный час Вредные привычки. Презентация.
Классный час Вредные привычки. Презентация. Мангазея. Культура Ямала. Средние века
Мангазея. Культура Ямала. Средние века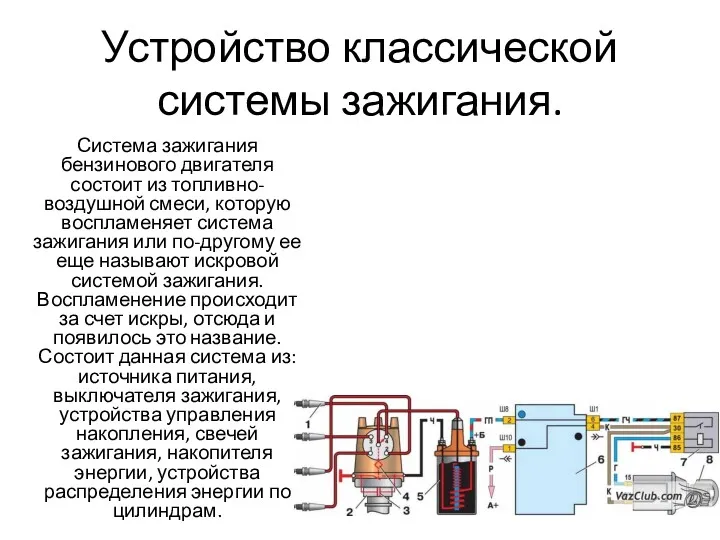 Устройство классической системы зажигания бензинового двигателя
Устройство классической системы зажигания бензинового двигателя Кристалы и их свойства
Кристалы и их свойства Future Simple tense - Будущее простое время. lesson 7
Future Simple tense - Будущее простое время. lesson 7 Культурно-религиозное наследие народов России
Культурно-религиозное наследие народов России НЕОБЫЧНЫЕ КРУГОСВЕТНЫЕ ПУТЕШЕСТВИЯ
НЕОБЫЧНЫЕ КРУГОСВЕТНЫЕ ПУТЕШЕСТВИЯ World Animal Day
World Animal Day презентация классного часа ко Дню Знаний
презентация классного часа ко Дню Знаний Презентация к уроку география Смоленщины -8 класс История формирования Смоленской области
Презентация к уроку география Смоленщины -8 класс История формирования Смоленской области