Содержание
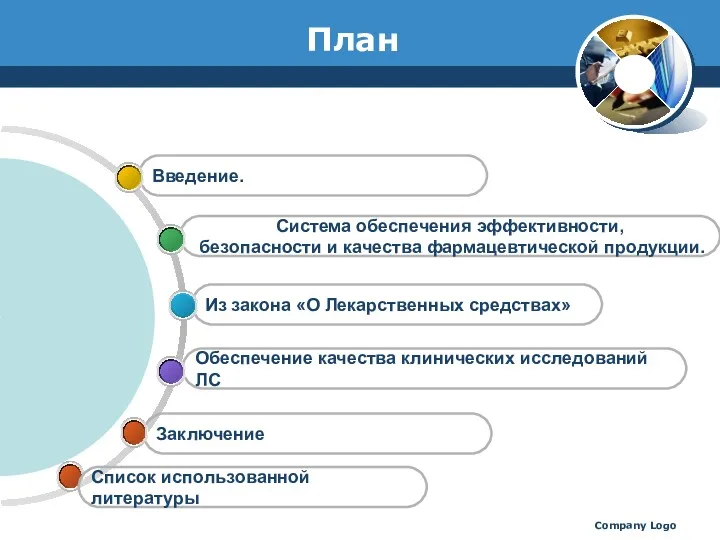
- 2. Company Logo План Заключение Обеспечение качества клинических исследований ЛС Из закона «О Лекарственных средствах» Система обеспечения
- 3. Лекарственное средство может исцелить пациента или причинить вред здоровью!
- 5. Более 120 ЛС средств отозваны с рынка ЕС за последние 10 лет в связи с проблемами
- 6. Проблемы, связанные с фармакотерапией Неблагоприятные побочные реакции Осложнения, связанные с применением ЛС с нарушениями предписаний инструкций
- 7. Талидомид
- 8. www.thmemgallery.com Company Logo Введение В условиях казахстанского фармацевтического рынка государственный контроль качества ЛС является основной функцией
- 9. www.thmemgallery.com Company Logo Определение этих терминов содержится в статье Закона "О лекарственных средствах": - безопасность лекарственных
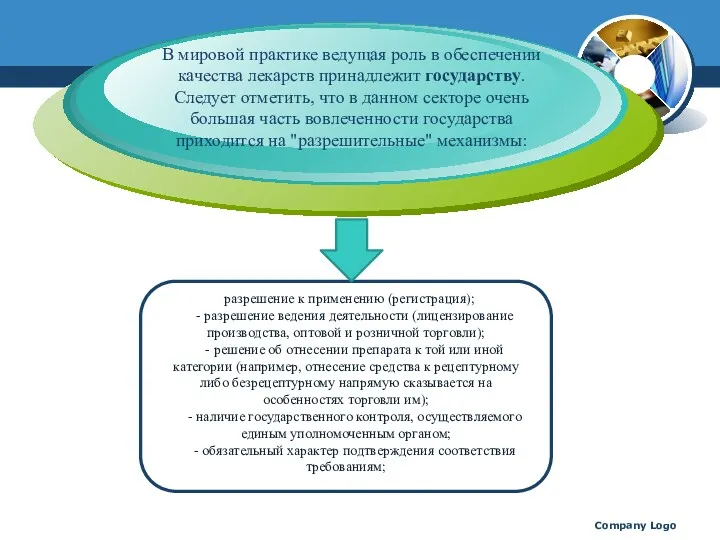
- 10. Company Logo В мировой практике ведущая роль в обеспечении качества лекарств принадлежит государству. Следует отметить, что
- 11. www.thmemgallery.com Company Logo Глава III Закона «О лекарственных средствах» устанавливает государственную систему контроля качества, эффективности и
- 12. www.thmemgallery.com Company Logo В то же время из государственной системы контроля качества, эффективности, безопасности лекарственных средств
- 13. www.thmemgallery.com Company Logo Пункт 5 Закона «О лекарственных средствах» утверждает информационную систему, обеспечивающую субъекты обращения лекарственных
- 14. www.thmemgallery.com Company Logo В этих условиях одной из актуальных проблем современной фармации является разработка эффективной системы
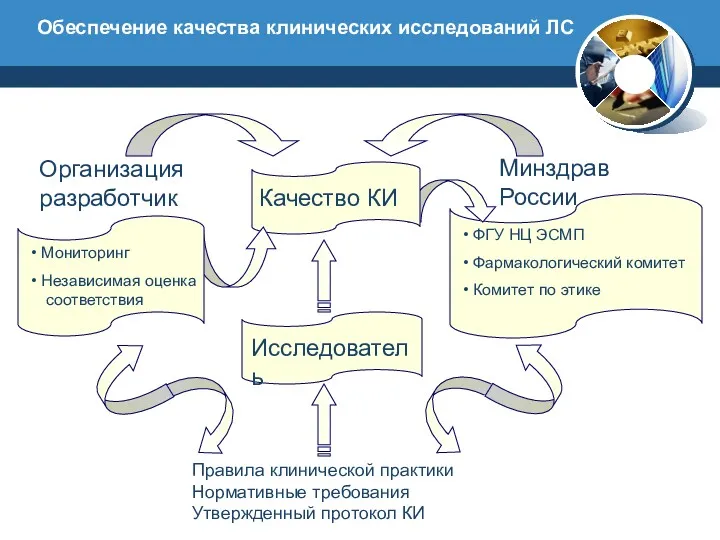
- 15. Правила клинической практики Нормативные требования Утвержденный протокол КИ Организация разработчик Мониторинг Независимая оценка соответствия Минздрав России
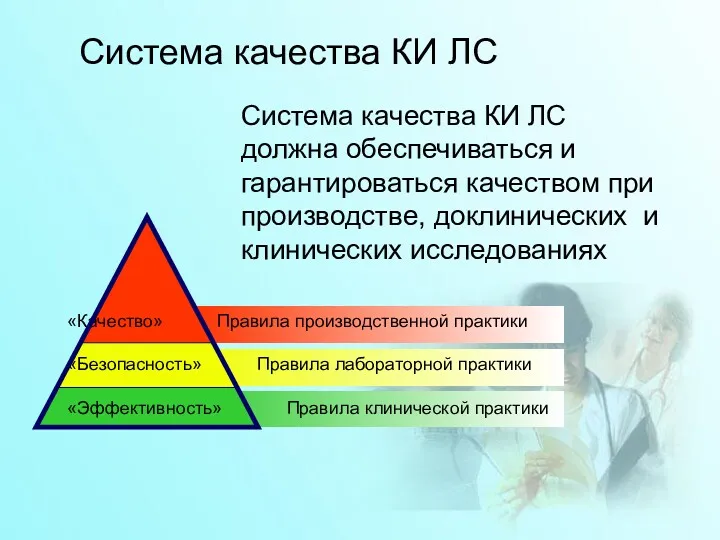
- 16. Система качества КИ ЛС Система качества КИ ЛС должна обеспечиваться и гарантироваться качеством при производстве, доклинических
- 17. Система качества КИ ЛС Качество – философ., одна из важнейших категорий, совокупность всех свойств, дающих… Ф.А.Брокгауз
- 18. Правила клинической практики – признанный во всем мире этический и научный стандарт качества КИ
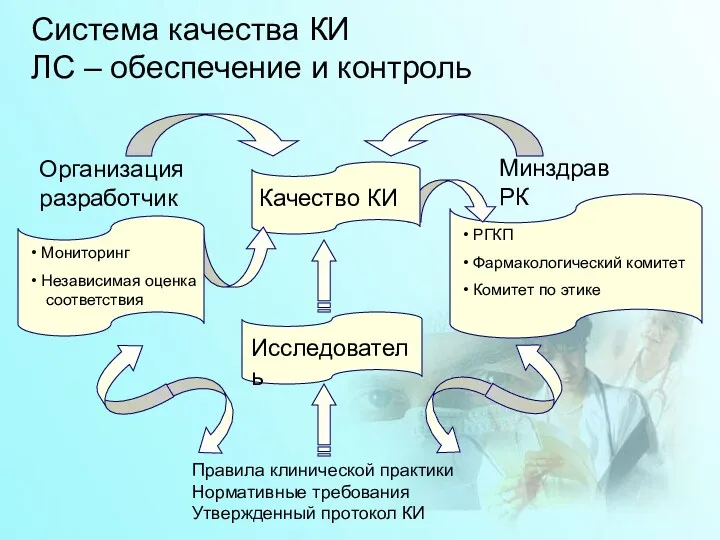
- 19. Система качества КИ ЛС – обеспечение и контроль Правила клинической практики Нормативные требования Утвержденный протокол КИ
- 20. Организация-разработчик Обеспечивает качество КИ на всех этапах проведения и несет ответственность за соответствие КИ требованиям законодательства
- 21. МОНИТОРИНГ Мониторинг проводится с целью обеспечения прав, безопасности и охраны здоровья испытуемых; подтверждения точности и полноты,
- 22. НЕЗАВИСИМАЯ ОЦЕНКА СООТВЕТСТВИЯ Независимая оценка соответствия является самостоятельной процедурой, задачей которой является проведение организацией-разработчиком всесторонней проверки
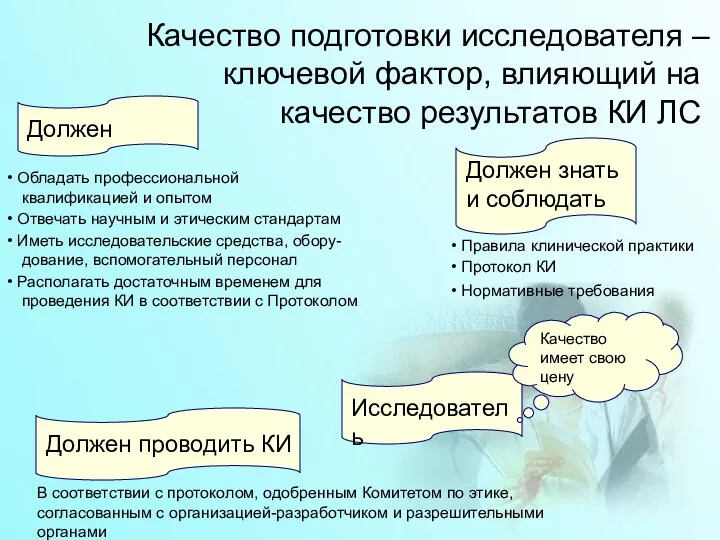
- 23. Качество подготовки исследователя – ключевой фактор, влияющий на качество результатов КИ ЛС Должен проводить КИ Обладать
- 24. www.thmemgallery.com Company Logo Заключение Высокое качество ЛС (а для ЛС термин "низкое качество" неприменим) может быть
- 25. www.themegallery.com Company Logo Список использованной литературы 1.Управление и экономика фармации: учебник / под ред. В.Л. Багировой.
- 27. Скачать презентацию


















 Методологические основы создания ИС и ИТ в управлении предприятием. Информационные технологии в менеджменте
Методологические основы создания ИС и ИТ в управлении предприятием. Информационные технологии в менеджменте Моё родословное древо
Моё родословное древо Підвищення пропускної здатності телекомунікаційних мереж 4G та 5G
Підвищення пропускної здатності телекомунікаційних мереж 4G та 5G Что такое кризис и как помочь своему ребёнку справиться с кризисной ситуацией. ( для родителей подростков).
Что такое кризис и как помочь своему ребёнку справиться с кризисной ситуацией. ( для родителей подростков). Основы безопасного управления транспортным средством. Безопасность дорожного движения. Тема 1
Основы безопасного управления транспортным средством. Безопасность дорожного движения. Тема 1 Источники оптического когерентного излучения для информационных систем I
Источники оптического когерентного излучения для информационных систем I Skaner
Skaner Береги здоровье смолоду!
Береги здоровье смолоду! Активизация творческой деятельности
Активизация творческой деятельности Мультимедийная дидактическая игра Цвет и форма
Мультимедийная дидактическая игра Цвет и форма Региональная экономика
Региональная экономика Население и страны Европы
Население и страны Европы Курить-здоровью вредить
Курить-здоровью вредить Консервативное лечение в послеоперационном периоде
Консервативное лечение в послеоперационном периоде Презентация проекта Народная игрушка в 1 младшей группе.
Презентация проекта Народная игрушка в 1 младшей группе. Пасха. Традиции
Пасха. Традиции Картотека прогулок для детей младшей группы.
Картотека прогулок для детей младшей группы. презентация по технологии
презентация по технологии Презентация по патриотическому воспитанию
Презентация по патриотическому воспитанию Россия - морская держава
Россия - морская держава Афиша, плакат к спектаклю
Афиша, плакат к спектаклю Дәрілік заттардың әсерінің ағзаның қасиетіне тәуелділігі
Дәрілік заттардың әсерінің ағзаның қасиетіне тәуелділігі Произведения искусства
Произведения искусства Современный компьютер. Перспективы развития
Современный компьютер. Перспективы развития Презентация учителя-дефектолога
Презентация учителя-дефектолога Викторина на тему Автомобили
Викторина на тему Автомобили Народные промыслы России
Народные промыслы России Wikipedia. How it works and why it works
Wikipedia. How it works and why it works