Содержание
- 2. Скорость химической реакции Определяется изменением концентрации реагирующих или образующихся веществ в единицу времени С – молярная
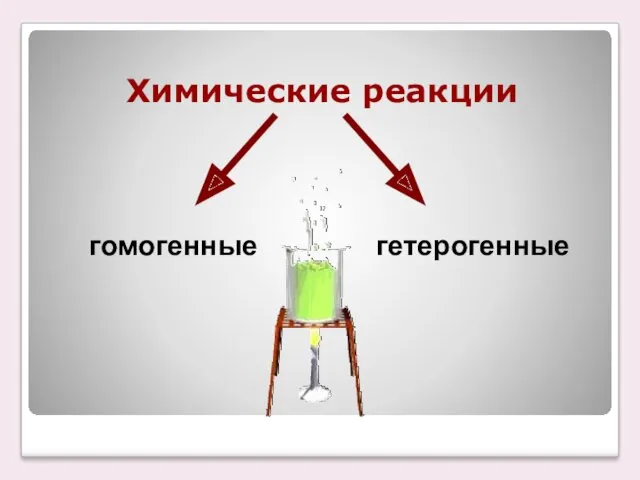
- 3. Химические реакции гомогенные гетерогенные
- 4. Скорость гомогенной реакции Определяется изменением количества вещества, вступившего в реакцию или образовавшегося в результате реакции за
- 5. Скорость гетерогенной реакции Определяется изменением количества вещества, вступившего в реакцию или образовавшегося в результате реакции за
- 6. Факторы, влияющие на скорость химических реакций Природа реагирующих веществ Поверхность соприкосновения Температура Концентрация Действие катализатора
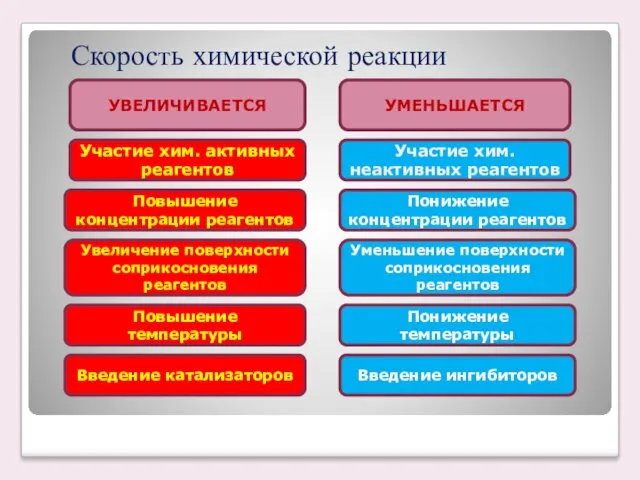
- 7. Скорость химической реакции УВЕЛИЧИВАЕТСЯ Участие хим. активных реагентов УМЕНЬШАЕТСЯ Повышение концентрации реагентов Участие хим. неактивных реагентов
- 8. Классификация химических реакций по признаку обратимости Реакции могут быть необратимыми, когда реагенты полностью превращаются в продукты
- 9. Правило Вант-Гоффа: При повышении температуры на каждые 100 C скорость большинства реакций увеличивается в 2-4 раза.
- 10. Лабораторный прибор для сравнения скорости химических реакций.
- 11. Тестовое задание Вопрос № 1Вопрос № 1 Вопрос № 3 Вопрос № 2Вопрос № 2 Вопрос
- 12. ВЕРНО!!!
- 13. Попробуй еще раз…
- 14. Попробуй еще раз…
- 15. Попробуй еще раз…
- 16. Попробуй еще раз…
- 17. Вопрос № 1 Какая из факторов не оказывает влияния на скорость химической реакции в растворах? 1)
- 18. Вопрос № 2 Скорость химической реакции между металлом и серой не зависит 1) от температуры 2)
- 19. Взаимодействие какой пары веществ будет протекать с большей скоростью, если известно, что концентрация раствора кислот во
- 21. Скачать презентацию
















 Патентное исследование в области строительства на грунтах, подверженных морозному пучению
Патентное исследование в области строительства на грунтах, подверженных морозному пучению Клещевой боррелиоз
Клещевой боррелиоз Презентация урока учащихся 2 кл. хореографического отделения. Предмет: Классический танец.Тема: В стране вальса.
Презентация урока учащихся 2 кл. хореографического отделения. Предмет: Классический танец.Тема: В стране вальса. Сварочные трансформаторы
Сварочные трансформаторы Родительское собрание.Тема: Детская агрессия
Родительское собрание.Тема: Детская агрессия Комплекс решений в строительстве скважин с большим отходом от вертикали
Комплекс решений в строительстве скважин с большим отходом от вертикали Родительское собрание Факторы, влияющие на здоровье ребенка
Родительское собрание Факторы, влияющие на здоровье ребенка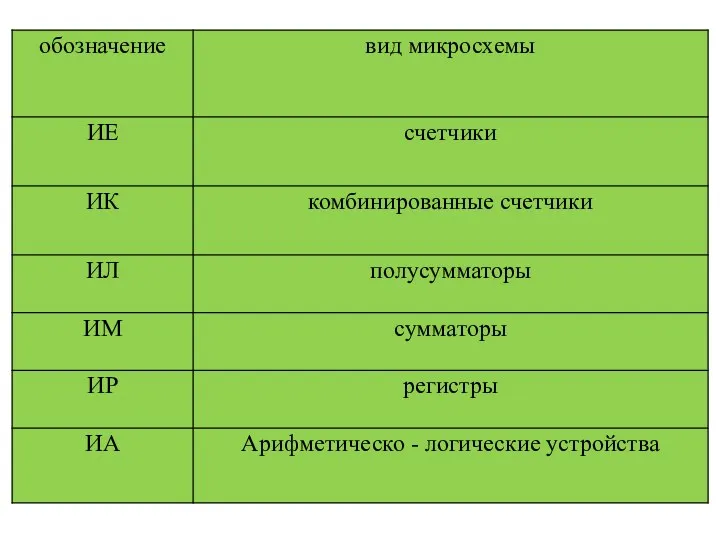 Характеристики интегральных схем (ИС)
Характеристики интегральных схем (ИС) В весеннем лесу (объёмная аппликация)
В весеннем лесу (объёмная аппликация) Gold-Coast
Gold-Coast Витамины. Авитаминоз
Витамины. Авитаминоз Подготовка к олимпиаде. Занятие Школы юного филолога. Писатели
Подготовка к олимпиаде. Занятие Школы юного филолога. Писатели Краткая биография Марии Сергеевны Петровых
Краткая биография Марии Сергеевны Петровых Основы поисковой оптимизации
Основы поисковой оптимизации Презентация к уроку технологии Ёлочка
Презентация к уроку технологии Ёлочка Типы и конструкции микроэлектромеханических систем. Сенсоры. Классификация сенсоров
Типы и конструкции микроэлектромеханических систем. Сенсоры. Классификация сенсоров Презентация Зона арктических пустынь России
Презентация Зона арктических пустынь России Презентация Ацетилен и его гомологи.
Презентация Ацетилен и его гомологи. Семья как малая социальная группа
Семья как малая социальная группа Требования к оформлению психологического заключения обследования ребенка при направлении его на ПМПК
Требования к оформлению психологического заключения обследования ребенка при направлении его на ПМПК Дыхательные пути. Дыхательные расстройства
Дыхательные пути. Дыхательные расстройства Презентация Семейный театр
Презентация Семейный театр Скоро в школу
Скоро в школу Техническое обслуживание и ремонт автотранспорта МДК 01.01. Устройство автомобилей
Техническое обслуживание и ремонт автотранспорта МДК 01.01. Устройство автомобилей Профстандарт и персональные компетенции специалиста по коммуникациям
Профстандарт и персональные компетенции специалиста по коммуникациям Музыка эпохи классицизма в России
Музыка эпохи классицизма в России Спасо-Казанский женский монастырь. Епитрахиль И.Кронштадтского
Спасо-Казанский женский монастырь. Епитрахиль И.Кронштадтского Презентация к совместной театрализованной деятельности Проказы Бабушки-Яги для детей старшей возрастной группы
Презентация к совместной театрализованной деятельности Проказы Бабушки-Яги для детей старшей возрастной группы