Содержание
- 2. Цель урока: Сформировать у учащихся знания о факторах, влияющих на скорость химических реакций.
- 3. Задачи: 1. Исследовать факторы, влияющие на скорость химических реакций и механизм их выполнения; 2. Продолжить развитие
- 4. Методы и методологические приёмы: Диалогический метод изложения знаний с элементами исследования, выполнения демонстрационного и лабораторного эксперимента,
- 5. Средства обучения: - инструкция для выполнения лабораторного эксперимента; - инструкция по технике безопасности; - демонстрационное оборудование;
- 6. Подготовка учащихся к уроку. 1. Деление класса на группы по 5 человек (в каждой группе есть
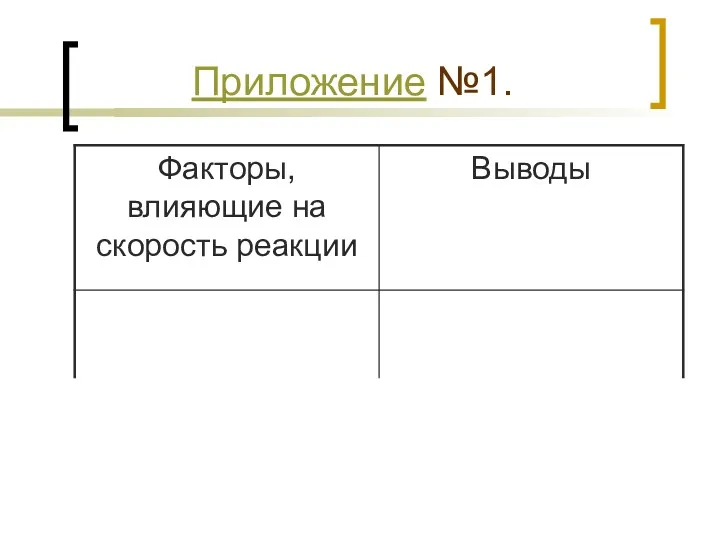
- 7. Приложение №1.
- 8. 3.Группа получает оборудования и реактивы для проведения эксперимента. 4. Каждый учащийся получает рабочую карту урока (Приложение
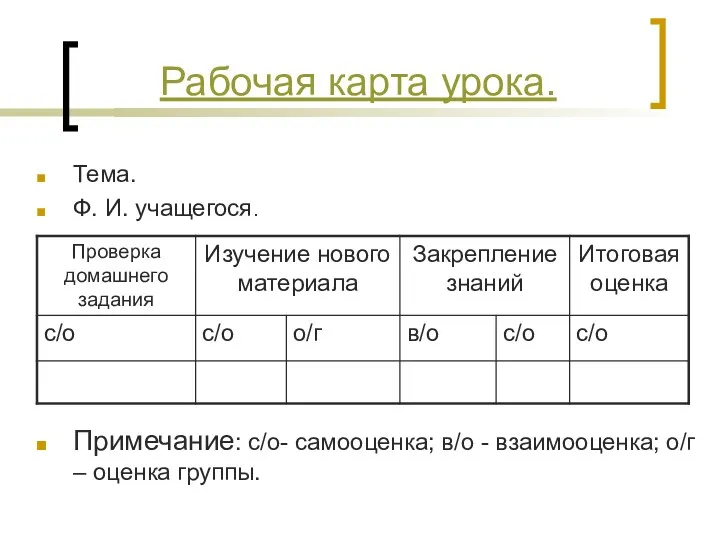
- 9. Тема. Ф. И. учащегося. Примечание: с/о- самооценка; в/о - взаимооценка; о/г – оценка группы. Рабочая карта
- 10. Структура урока. 1. Организационный этап. 2. Актуализация знаний (фронтальная форма работы) 3. Изучение нового материала. 4.
- 11. ХОД УРОКА. I. Организационный этап. II. Актуализация знаний. Примеры реакций. Гомогенные Гетерогенные газ + газ газ
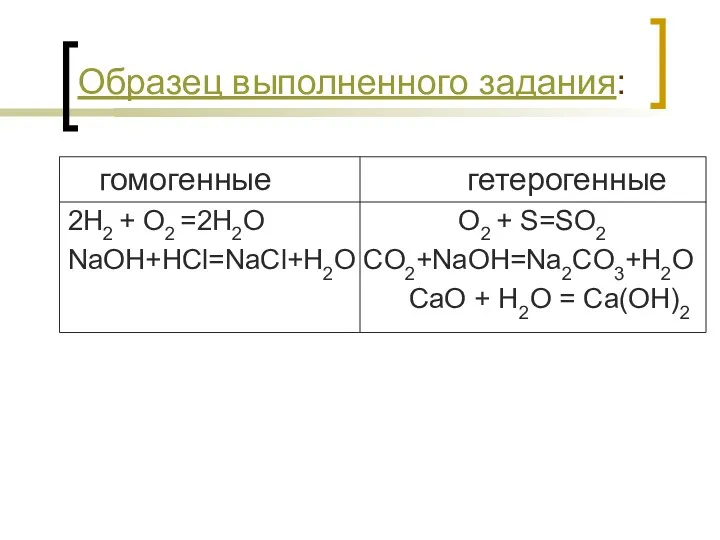
- 12. Образец выполненного задания: гомогенные гетерогенные 2H2 + O2 =2H2O O2 + S=SO2 NaOH+HCl=NaCl+H2O CO2+NaOH=Na2CO3+H2O CaO +
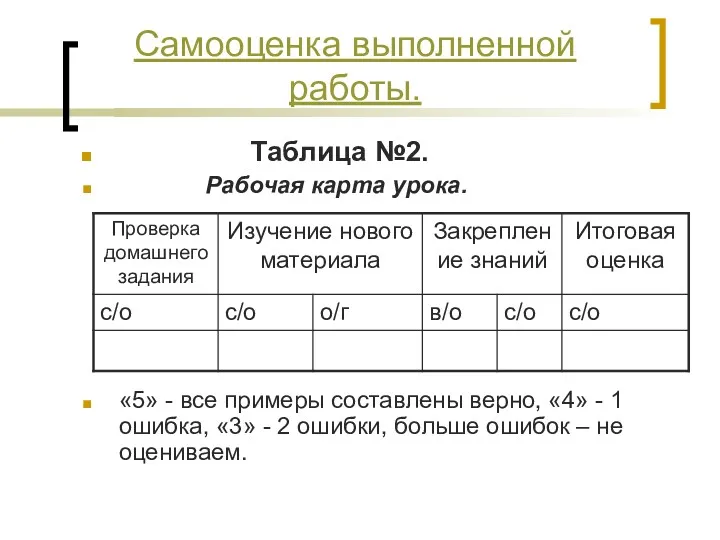
- 13. Таблица №2. Рабочая карта урока. «5» - все примеры составлены верно, «4» - 1 ошибка, «3»
- 14. IIIIII. Изучение нового материала. Тема урока: «Факторы, влияющие на скорость химических реакций». Лабораторный эксперимент. Лабораторный опыт
- 15. Правило Я. Вант-Гоффа V2/V1=γt2-t1/10 Я. Вант-Гофф (1852 -1911). Голландский химик. Один из основателей физической химии и
- 16. Закон действующих масс. Гульдберг (1836-1902). Норвежский физикохимик. П. Вааге (1833-1900). Норвежский ученый. V=kcAacBb
- 17. IVIV. Закрепление знаний (работа в группах, тестирование). Задачи на применение правила Вант-Гоффа и закона действующих масс
- 18. Образцы решенныхОбразцы решенных задач I I группа. N2+3H2=2NH3 V=k·CN2·CH23 V2=k·3CN2·(3CH2)3=81·kCN2CH23 V2/V1=81·kCN2CH23/kCN2CH23=81 V2=81V1
- 19. IIII группаII группа. V2/V1=j(to2-to1) /10 V2/V1=3 (80о-20о) /10о V2/V1=36 V2=729 V1
- 20. III III группа. V2/V1=j(to2-to1) /10 V2/V1=3 (200о -150о) /10о V2/V1=35 V2=243 V1
- 21. IV IV группа. H2 + Cl2= 2HCl V1 = kCH2·CCl2 V2 = k·(4CH2) ·1/2 CCl2 V2
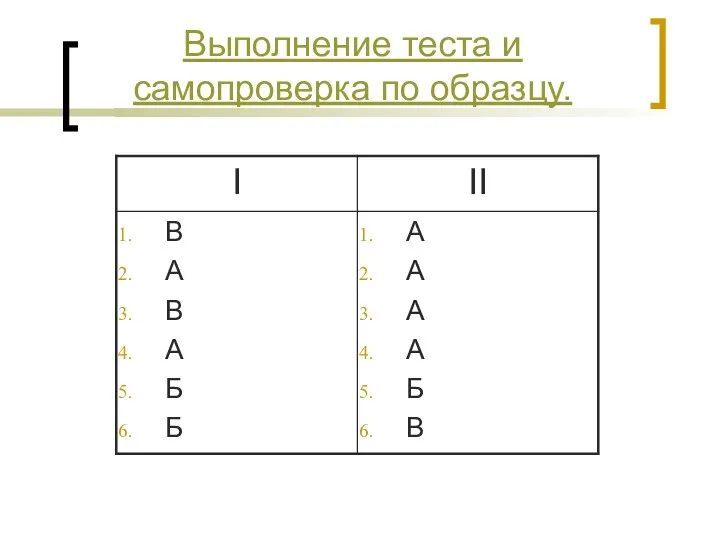
- 22. Выполнение теста и самопроверка по образцу.
- 23. VV.V. V. Рефлексия (самооценка). Каждый учащийся выставляет себе итоговую оценку за урок в рабочей карте и
- 25. Скачать презентацию

















 Проект Умный дом
Проект Умный дом Космологический аргумент. Христианская апологетика
Космологический аргумент. Христианская апологетика Мультимедийная презентация к семинару Формирование лексико-грамматических категорий у дошкольников
Мультимедийная презентация к семинару Формирование лексико-грамматических категорий у дошкольников Antalis в мире и в России. Бумажная лавка в Москве и Санкт-Петербурге
Antalis в мире и в России. Бумажная лавка в Москве и Санкт-Петербурге Формирование микроклимата в помещении
Формирование микроклимата в помещении ЭРДУ аппарата Smart 1
ЭРДУ аппарата Smart 1 Презентация Выдающиеся спортсмены Саратовской области
Презентация Выдающиеся спортсмены Саратовской области Правописание суффиксов разных частей речи и личных окончаний глаголов. (ОГЭ. Задание 5)
Правописание суффиксов разных частей речи и личных окончаний глаголов. (ОГЭ. Задание 5) Інформаційні основи маркетингових рішень
Інформаційні основи маркетингових рішень Изучение и совершенствование техники волейбола. 5-11 класс
Изучение и совершенствование техники волейбола. 5-11 класс Общеучебные умения и навыки- необходимые условия успешного обучения
Общеучебные умения и навыки- необходимые условия успешного обучения Захист навколишнього середовища
Захист навколишнього середовища ЕГЭ 2018. Результаты ГИА выпускников, освоивших программу среднего общего образования по биологии
ЕГЭ 2018. Результаты ГИА выпускников, освоивших программу среднего общего образования по биологии Проценты и отношения. Решение задач
Проценты и отношения. Решение задач Информационные технологии и информационные системы. (Лекция 2)
Информационные технологии и информационные системы. (Лекция 2) Решение задач с помощью уравнений
Решение задач с помощью уравнений Основные виды помех средствам активной радиолокации
Основные виды помех средствам активной радиолокации Просвещенный абсолютизм. Союз государей с философами
Просвещенный абсолютизм. Союз государей с философами Плакат. Цілі і види плаката
Плакат. Цілі і види плаката Административное наказание
Административное наказание Школьный историко-краеведческий музей с. Среднее Погромное – хранитель славных страниц истории родного края
Школьный историко-краеведческий музей с. Среднее Погромное – хранитель славных страниц истории родного края Отдел Покрытосеменные. Общая характеристика и значение. 6 класс
Отдел Покрытосеменные. Общая характеристика и значение. 6 класс Магистральные трубопроводы
Магистральные трубопроводы Подготов к ГИА.
Подготов к ГИА. Конспект занятия по развитию мелкой моторики с использованием пескографии Sand-art и ИКТ во второй младшей группе. Тема: Помогите рыбкам
Конспект занятия по развитию мелкой моторики с использованием пескографии Sand-art и ИКТ во второй младшей группе. Тема: Помогите рыбкам Prezentatsia_VKR_BUrdin
Prezentatsia_VKR_BUrdin Скрининг–программа, ее содержание и роль в диагностике ранних отклонений в состоянии здоровья детей
Скрининг–программа, ее содержание и роль в диагностике ранних отклонений в состоянии здоровья детей Gianni Versace
Gianni Versace