Содержание
- 2. ОТВЕТЫ: 1 ВАРИАНТ 1. Cu2O + C = 2Cu + CO Cu2O + CO = 2Cu
- 3. Соединения металлов. Оксиды и гидроксиды.
- 4. Металлы I и II групп ПСХЭ III группы ПСХЭ 1 – 2 ē 3 ē Оксиды
- 5. Различные соединения хрома CrO – основной оксид Cr2O3 – амфотерный оксид CrO3 – кислотный оксид +2
- 6. Соединения металлов и их свойства Основные оксиды Образованы металлами со с.о. +1, +2 Na2O, CaO, MgO,
- 7. Соединения металлов и их свойства Амфотерные оксиды Образованы металлами со с.о. +2, +3 Al2O3, ZnO, BeO,
- 8. Соединения металлов и их свойства Кислотные оксиды Образованы металлами побочных подгрупп с высшими с.о. (больше +3)
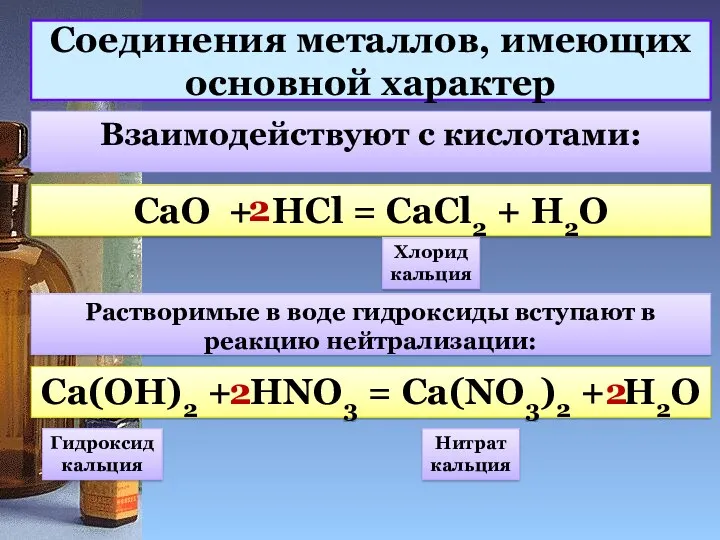
- 9. Соединения металлов, имеющих основной характер Взаимодействуют с кислотами: CaO + HCl = CaCl2 + H2O 2
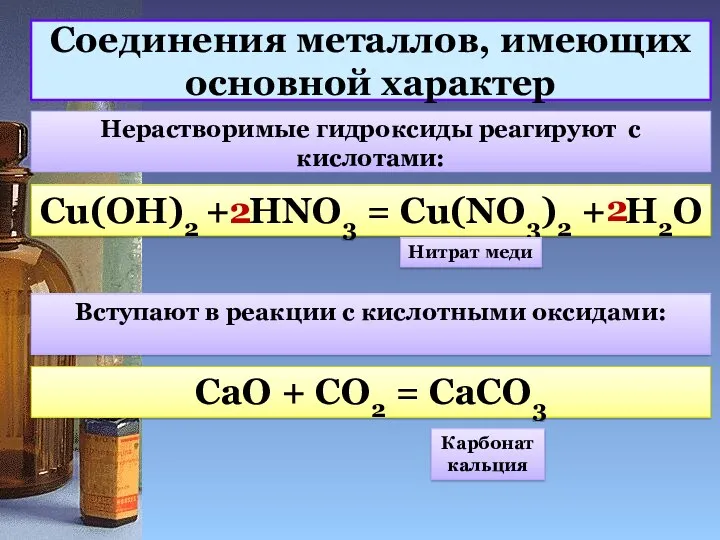
- 10. Соединения металлов, имеющих основной характер Нерастворимые гидроксиды реагируют с кислотами: Cu(OH)2 + HNO3 = Cu(NO3)2 +
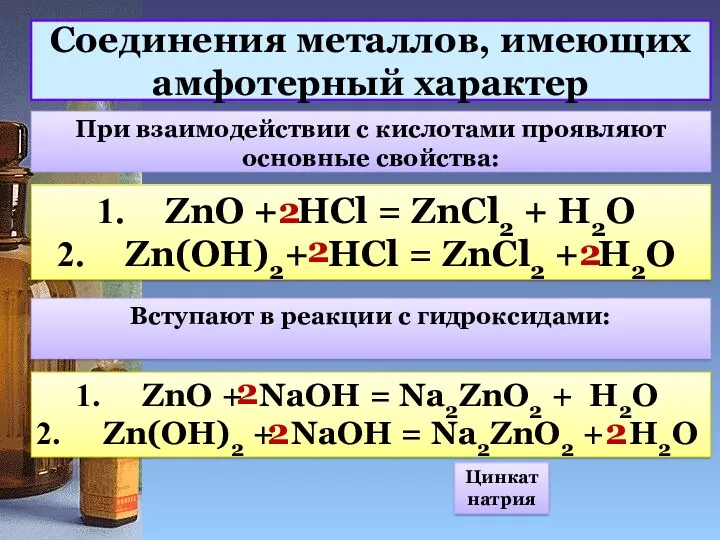
- 11. Соединения металлов, имеющих амфотерный характер При взаимодействии с кислотами проявляют основные свойства: ZnO + HCl =
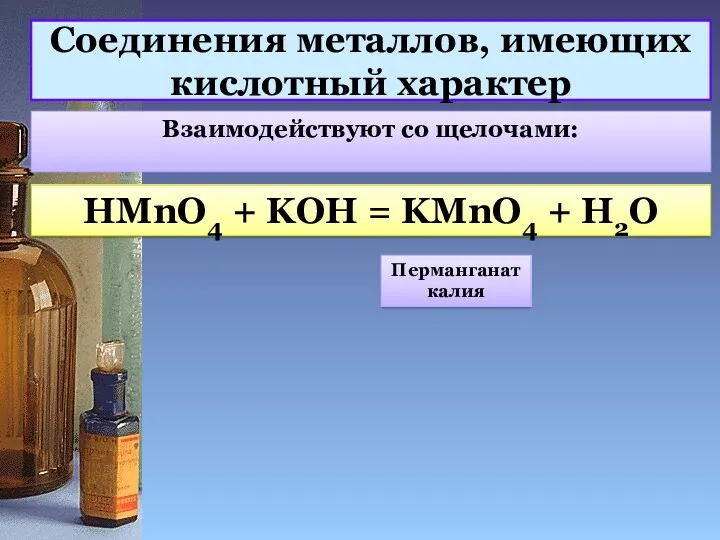
- 12. Соединения металлов, имеющих кислотный характер Взаимодействуют со щелочами: HMnO4 + KOH = KMnO4 + H2O Перманганат
- 14. Скачать презентацию







 Психология межличностных и межгрупповых отношений
Психология межличностных и межгрупповых отношений Выжигание
Выжигание Внеурочная работа в начальной школе
Внеурочная работа в начальной школе ВИЧ
ВИЧ Международный союз электросвязи (ITU)
Международный союз электросвязи (ITU) Фундаменты мелкого заложения. Виды фундаментов
Фундаменты мелкого заложения. Виды фундаментов Профилактика речевых нарушений у детей в детском саду
Профилактика речевых нарушений у детей в детском саду Способы решения показательных уравнений
Способы решения показательных уравнений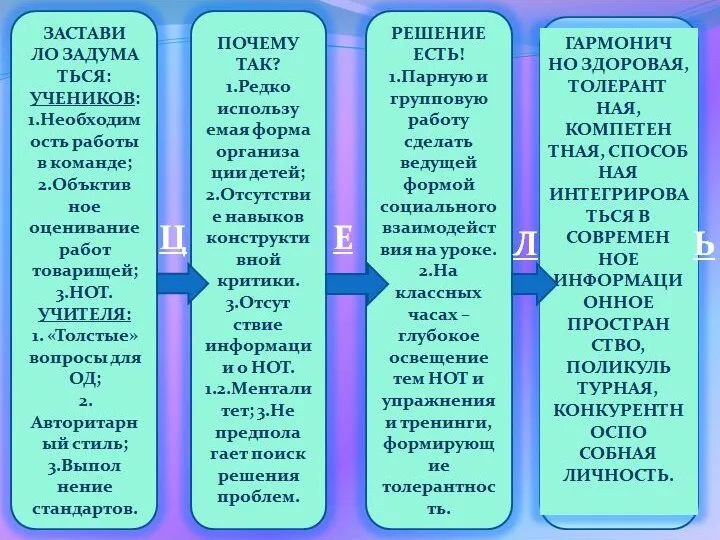 презентация для самообразования учителей о Кембриджской Программе внедрения семи модулей, как Новых подходах в воспитании и обучении детей.
презентация для самообразования учителей о Кембриджской Программе внедрения семи модулей, как Новых подходах в воспитании и обучении детей. Мой город Саранск
Мой город Саранск Дары Фребеля: первые дидактические материалы для детей дошкольного возраста.
Дары Фребеля: первые дидактические материалы для детей дошкольного возраста. Менингококковая инфекция
Менингококковая инфекция Социальное партнёрство с родителями, как условие развития творческих способностей обучающихся
Социальное партнёрство с родителями, как условие развития творческих способностей обучающихся  Различение звуков К-Т (подготовительная группа).
Различение звуков К-Т (подготовительная группа). Презентация к проекту Получение коллоидного раствора серебра и изучение его свойств
Презентация к проекту Получение коллоидного раствора серебра и изучение его свойств Исследовательская работа Я на радугу-дугу полюбуюсь, побегу!
Исследовательская работа Я на радугу-дугу полюбуюсь, побегу! Парламент против короля. Революция в Англии
Парламент против короля. Революция в Англии Презентация межпредметной игры по математике,информатике, физике и химии для 8-10 классов 30 пятёрок
Презентация межпредметной игры по математике,информатике, физике и химии для 8-10 классов 30 пятёрок презентация к логопедическому занятию Весна идет! Весне дорогу!
презентация к логопедическому занятию Весна идет! Весне дорогу! Zoobazar. Методическое пособие
Zoobazar. Методическое пособие Презентация Тематические карточки как новый метод использования раздаточных материалов в работе с детьми 6 – 7 лет
Презентация Тематические карточки как новый метод использования раздаточных материалов в работе с детьми 6 – 7 лет Презентация Формирование здорового образа жизни
Презентация Формирование здорового образа жизни Вспомогательные здания и помещения промышленных предприятий
Вспомогательные здания и помещения промышленных предприятий Организация деятельности общероссийской детско-юношеской организации Российское движение школьников
Организация деятельности общероссийской детско-юношеской организации Российское движение школьников Армения, государство на севере Азии
Армения, государство на севере Азии Строительство первого интегрированного газохимического комплекса в Атырауской области
Строительство первого интегрированного газохимического комплекса в Атырауской области Притча о мытаре и фарисее
Притча о мытаре и фарисее Welcome to Java India
Welcome to Java India