Содержание
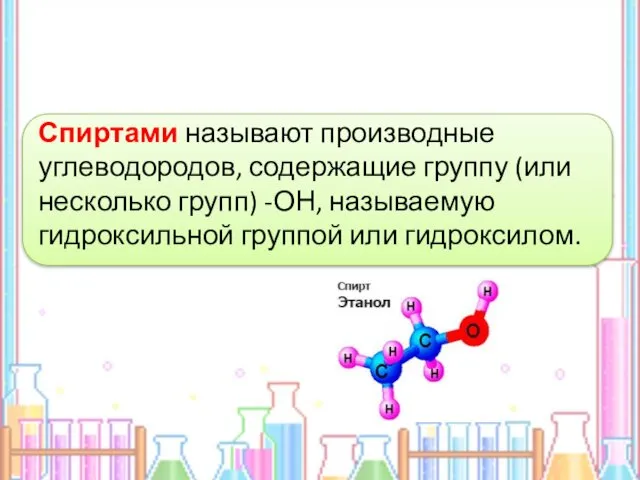
- 2. Спиртами называют производные углеводородов, содержащие группу (или несколько групп) -ОН, называемую гидроксильной группой или гидроксилом.
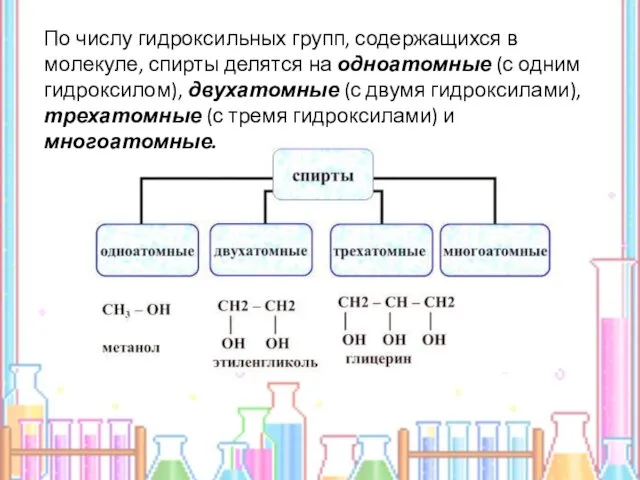
- 3. По числу гидроксильных групп, содержащихся в молекуле, спирты делятся на одноатомные (с одним гидроксилом), двухатомные (с
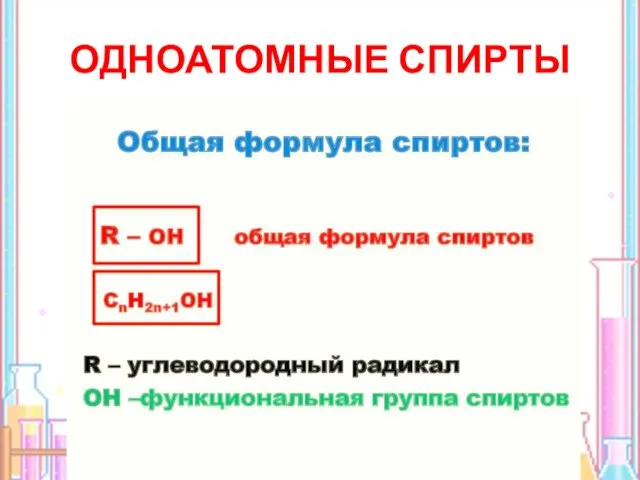
- 4. ОДНОАТОМНЫЕ СПИРТЫ
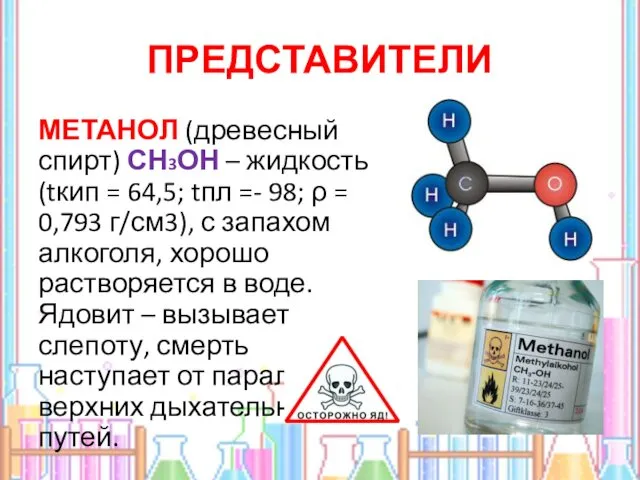
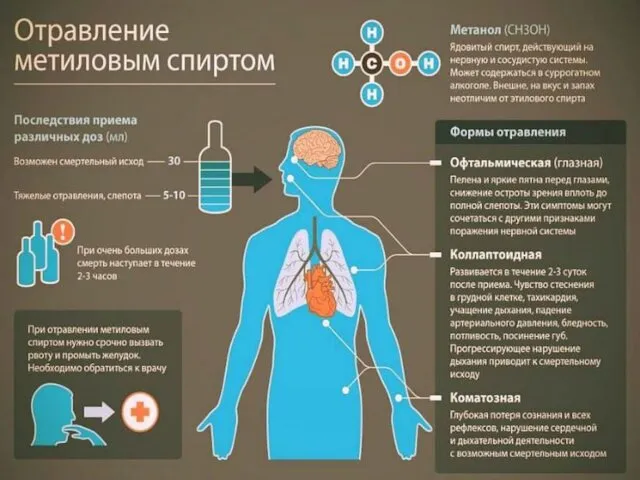
- 5. ПРЕДСТАВИТЕЛИ МЕТАНОЛ (древесный спирт) СН3ОН – жидкость (tкип = 64,5; tпл =- 98; ρ = 0,793
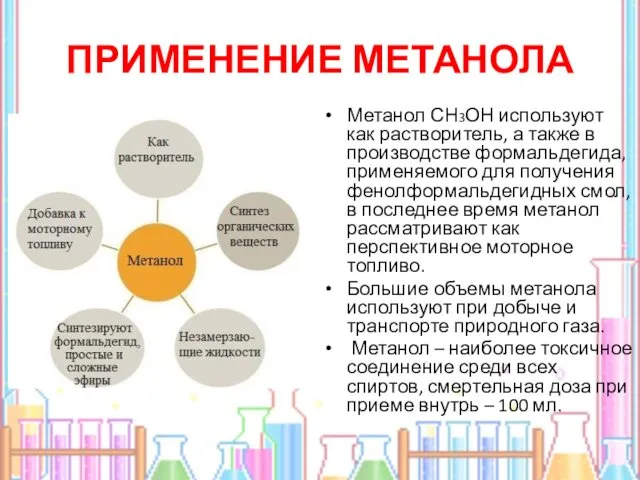
- 6. ПРИМЕНЕНИЕ МЕТАНОЛА Метанол СН3ОН используют как растворитель, а также в производстве формальдегида, применяемого для получения фенолформальдегидных
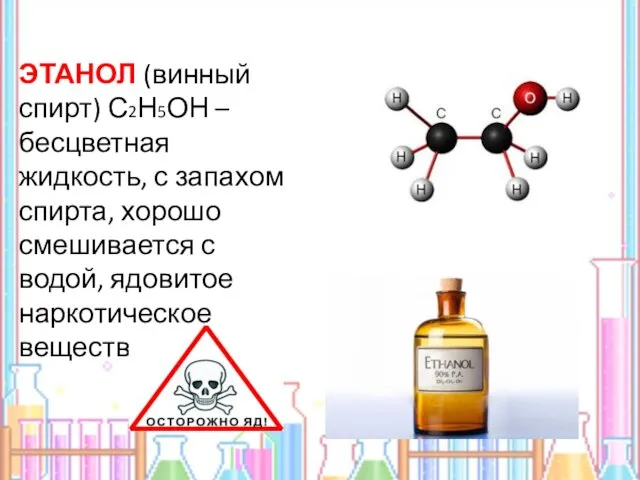
- 8. ЭТАНОЛ (винный спирт) С2Н5ОН – бесцветная жидкость, с запахом спирта, хорошо смешивается с водой, ядовитое наркотическое
- 9. ПРИМЕНЕНИЕ ЭТАНОЛА Этанол С2Н5ОН – исходное соединение для получения ацетальдегида, уксусной кислоты, а также для производства
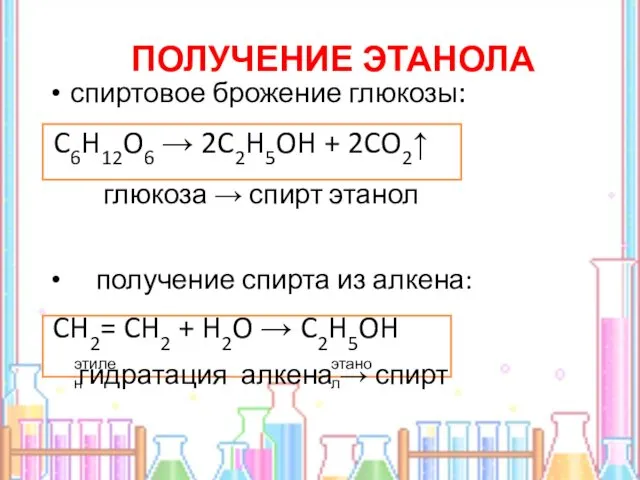
- 10. спиртовое брожение глюкозы: C6H12O6 → 2C2H5OH + 2CO2↑ глюкоза → спирт этанол получение спирта из алкена:
- 11. СВОЙСТВА СПИРТОВ Спирты горят в кислороде и на воздухе, как и углеводороды: 2CH3OH + 3O2 →
- 12. МНОГОАТОМНЫЕ СПИРТЫ Многоатомные спирты – органические соединения, в молекулах которых содержится несколько гидроксильных групп (-ОН), соединённых
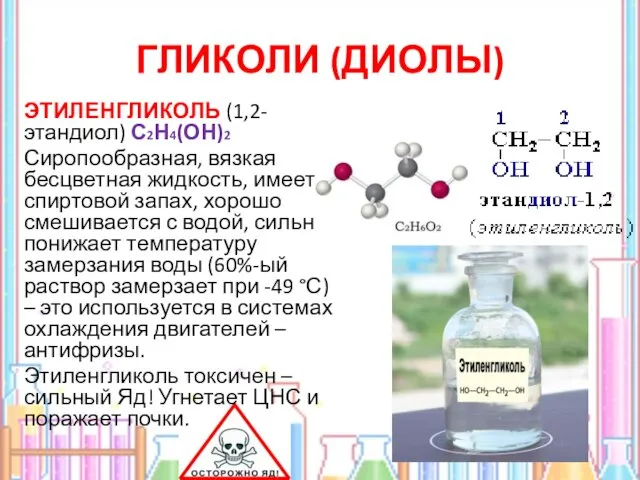
- 13. ГЛИКОЛИ (ДИОЛЫ) ЭТИЛЕНГЛИКОЛЬ (1,2- этандиол) С2Н4(ОН)2 Сиропообразная, вязкая бесцветная жидкость, имеет спиртовой запах, хорошо смешивается с
- 14. ПРИМЕНЕНИЕ ЭТИЛЕНГЛИКОЛЯ Этиленгликоль для производства лавсана и для приготовления антифризов — водных растворов, замерзающих значительно ниже
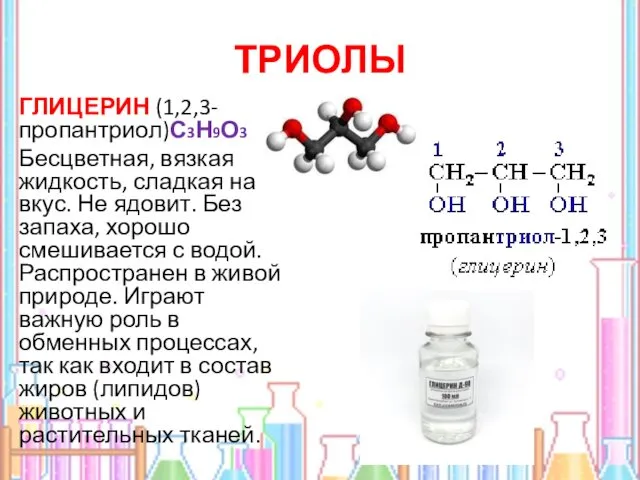
- 15. ТРИОЛЫ ГЛИЦЕРИН (1,2,3-пропантриол)С3Н9О3 Бесцветная, вязкая жидкость, сладкая на вкус. Не ядовит. Без запаха, хорошо смешивается с
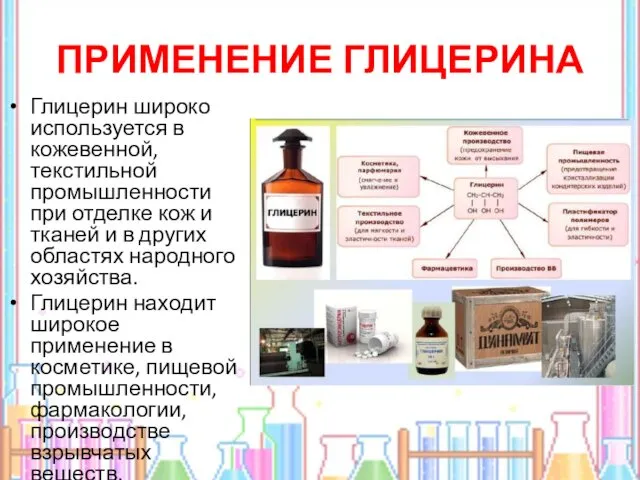
- 16. ПРИМЕНЕНИЕ ГЛИЦЕРИНА Глицерин широко используется в кожевенной, текстильной промышленности при отделке кож и тканей и в
- 17. НИТРОГЛИЦЕРИН Чистый нитроглицерин взрывается даже при слабом ударе; он служит сырьем для получения бездымных порохов и
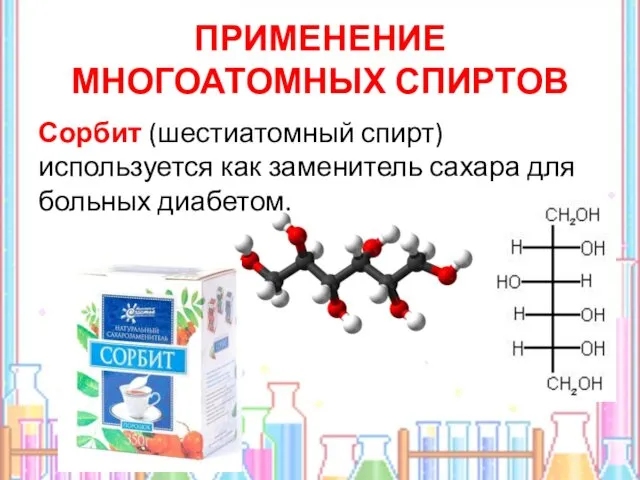
- 18. ПРИМЕНЕНИЕ МНОГОАТОМНЫХ СПИРТОВ Сорбит (шестиатомный спирт) используется как заменитель сахара для больных диабетом.
- 19. ВОПРОСЫ И ЗАДАНИЯ Задание 1. Метанол начинает гомологический ряд предельных одноатомных спиртов. Запишите молекулярные и структурные
- 20. Задание 2. Гомологом этанола является соединение: А) СН4 Б) СН3ОН В) С6Н5ОН Г) С2Н4(ОН)2
- 21. Задание 3. В результате горения этанола в кислороде образуется А) С и Н2О Б) СО и
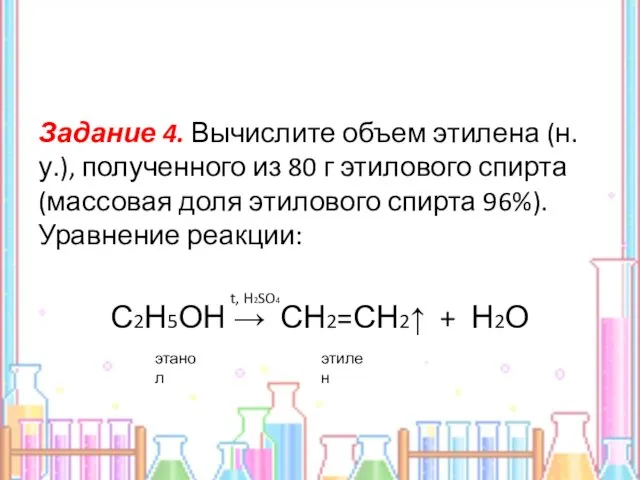
- 22. Задание 4. Вычислите объем этилена (н.у.), полученного из 80 г этилового спирта (массовая доля этилового спирта
- 24. Скачать презентацию








 Притяжательные местоимения
Притяжательные местоимения Заповедники и парки России
Заповедники и парки России Системы утилизации тепла, рекуператоры
Системы утилизации тепла, рекуператоры Презентация к уроку: Создание и использование таблиц на Web-страницах
Презентация к уроку: Создание и использование таблиц на Web-страницах Мастер-класс Театральный грим состаривание.
Мастер-класс Театральный грим состаривание. Чемпіонат України з велотріалу 2019 в м. Бровари
Чемпіонат України з велотріалу 2019 в м. Бровари Регулирование внешнеторговой деятельности в Таможенном союзе
Регулирование внешнеторговой деятельности в Таможенном союзе Количество теплоты
Количество теплоты Из истории наших предков. Боги славян.
Из истории наших предков. Боги славян. Гражданская война в Енисейской губернии
Гражданская война в Енисейской губернии Життєвий шлях і наукова діяльність С.П. Корольова
Життєвий шлях і наукова діяльність С.П. Корольова Поклонимся великим тем годам...
Поклонимся великим тем годам... Биография Жан-Жака Руссо
Биография Жан-Жака Руссо Проект Нашей школе юбилей
Проект Нашей школе юбилей Секта және олардың түрлері
Секта және олардың түрлері Презентация Природные зоны Африки
Презентация Природные зоны Африки Цели бизнес-проекта
Цели бизнес-проекта Дөңгелек ауыздылар мен сүйекті балықтар кластарының систематикалық топтарын анықтаудын әдістері
Дөңгелек ауыздылар мен сүйекті балықтар кластарының систематикалық топтарын анықтаудын әдістері Будь здоров! Проект по укреплению и сохранению здоровья детей
Будь здоров! Проект по укреплению и сохранению здоровья детей Строение зуба человека
Строение зуба человека Интеллектуальная игра 60 секунд
Интеллектуальная игра 60 секунд Правила дорожного движениядля средней группы
Правила дорожного движениядля средней группы Судовое вспомогательное энерегтическое оборудование
Судовое вспомогательное энерегтическое оборудование Уравнения. 5 класс
Уравнения. 5 класс Презентация рабочей программы Обучаем бережно в соответствии с ФГОС ДО
Презентация рабочей программы Обучаем бережно в соответствии с ФГОС ДО Средства выразительности
Средства выразительности Презентация по географии Особенности ЭГП Австралии
Презентация по географии Особенности ЭГП Австралии Предвыборная программа Кругловой Яны, кандидата на пост культурного организатора ассоциации студентов деревни универсиады
Предвыборная программа Кругловой Яны, кандидата на пост культурного организатора ассоциации студентов деревни универсиады