Содержание
- 2. Спирты (алкоголи) – это производные углеводородов, содержащие в молекуле одну или несколько гидроксильных групп – OH
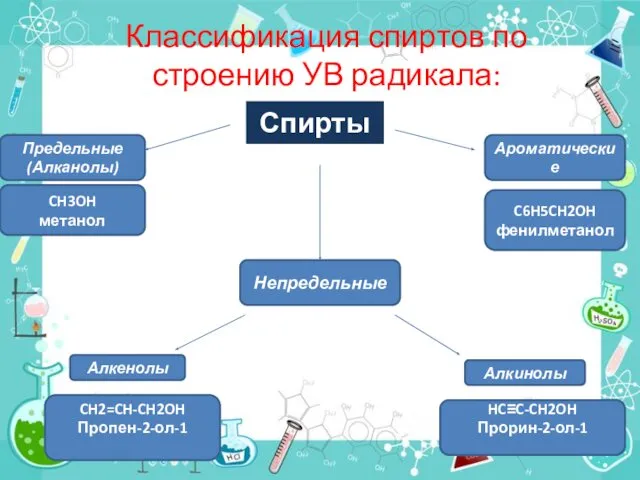
- 3. Классификация спиртов по строению УВ радикала: Спирты Ароматические Предельные (Алканолы) CH3OH метанол C6H5CH2OH фенилметанол Непредельные Алкенолы
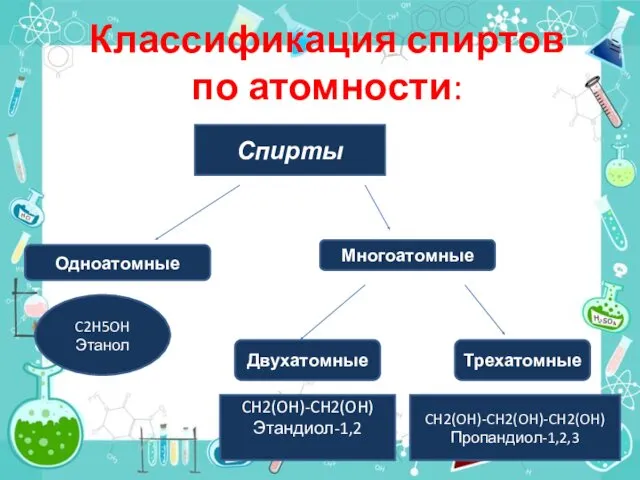
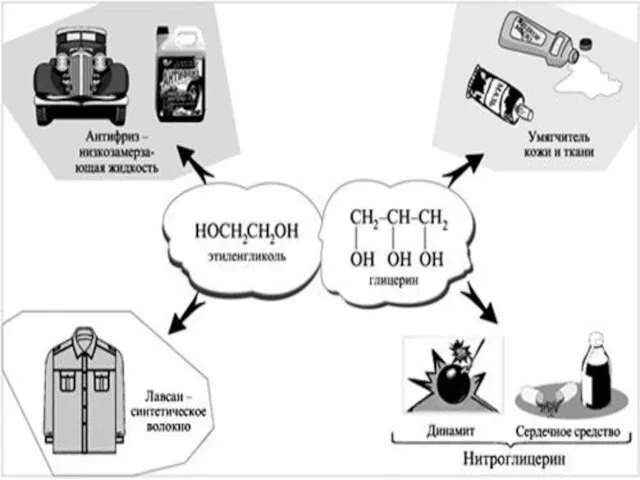
- 4. Классификация спиртов по атомности: Спирты Многоатомные Одноатомные C2H5OH Этанол Двухатомные Трехатомные CH2(OH)-CH2(OH) Этандиол-1,2 CH2(OH)-CH2(OH)-CH2(OH) Пропандиол-1,2,3
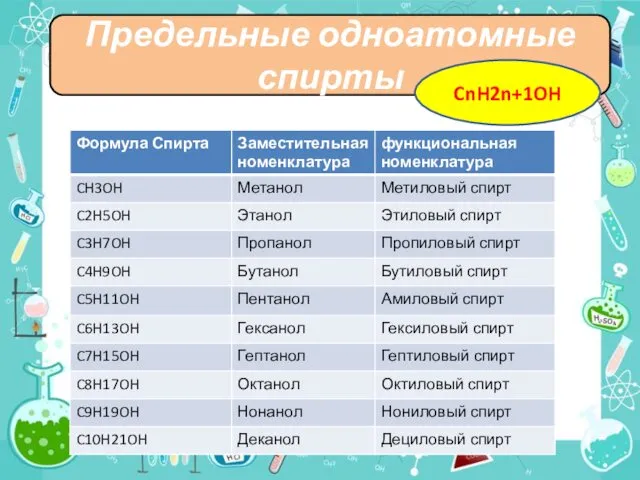
- 5. H Предельные одноатомные спирты CnH2n+1OH
- 6. Изомерия и номенклатура: Название спиртов включает в себя наименование соответствующего углеводорода с добавлением суффикса -ол (положение
- 9. Карбоновые Кислоты.
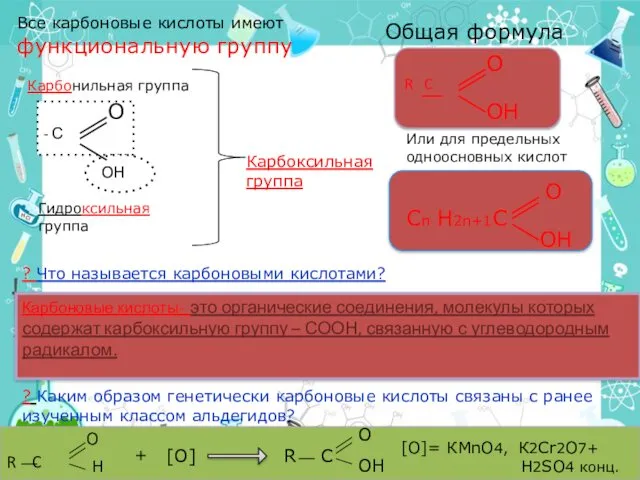
- 10. Все карбоновые кислоты имеют функциональную группу - С ОН О Карбонильная группа Гидроксильная группа Карбоксильная группа
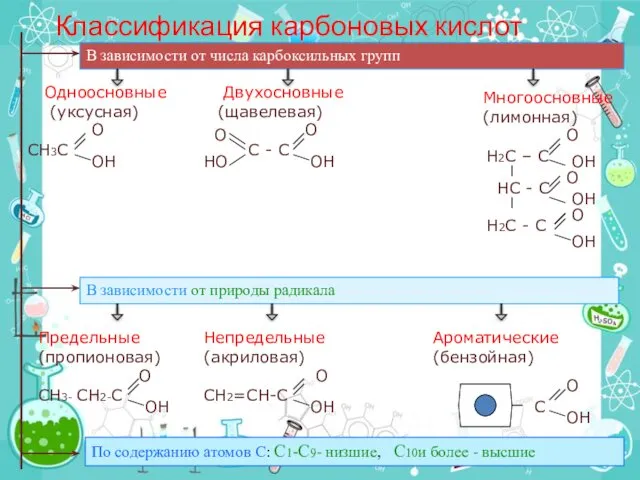
- 11. Классификация карбоновых кислот В зависимости от числа карбоксильных групп Одноосновные Двухосновные (уксусная) (щавелевая) СН3С С -
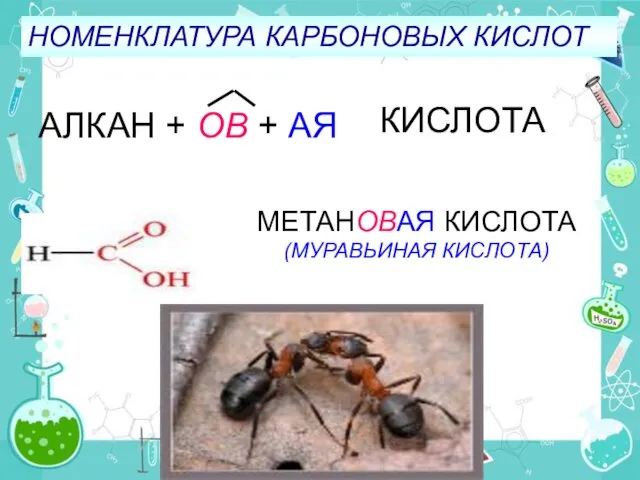
- 12. НОМЕНКЛАТУРА КАРБОНОВЫХ КИСЛОТ АЛКАН + ОВ + АЯ КИСЛОТА МЕТАНОВАЯ КИСЛОТА (МУРАВЬИНАЯ КИСЛОТА)
- 13. СН3 – СООН 1 2 ЭТАНОВАЯ КИСЛОТА (УКСУСНАЯ КИСЛОТА) СН3 – СН2 – СН2 - СООН
- 14. СН3 – СН2 – СН2 – СН2 – СООН ПЕНТАНОВАЯ КИСЛОТА (ВАЛЕРИАНОВАЯ КИСЛОТА) 1 2 3
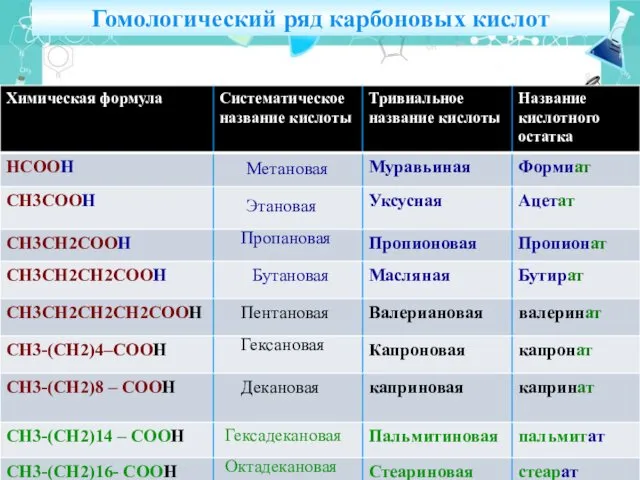
- 15. Гомологический ряд карбоновых кислот Метановая Этановая Пропановая Бутановая Пентановая Гексановая Декановая Гексадекановая Октадекановая
- 16. Вопрос: Почему нельзя смачивать водой место муравьиного укуса или ожога крапивой? Это приводит только к усилению
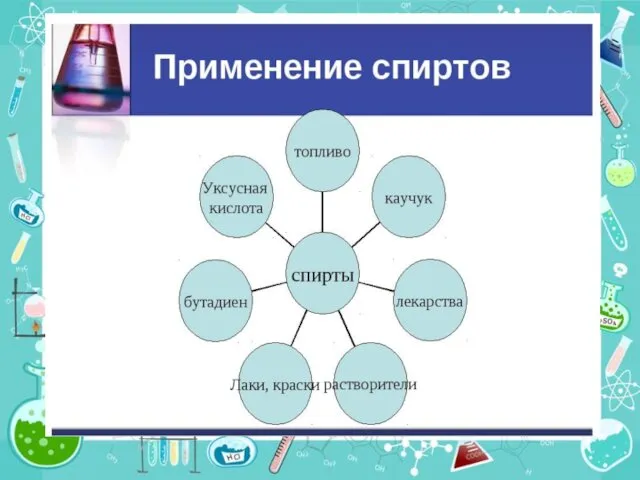
- 17. Уксусная кислота (этановая кислота) Это – первая кислота, полученная и использованная человеком. «Родилась» более 4 тыс.лет
- 21. Белки
- 22. Это надо знать! Белки - русское название данного класса, международное– протеины. Современное название белков- ферментов –
- 23. А знаете ли Вы 1.Белок никогда не переходит в жир 2. Образование морщин связано с уменьшением
- 24. 5. Все белки в организме человека постоянно разрушаются и синтезируются. Период полураспада белков в теле человека
- 25. Местонахождение известных нам белков! * кератин - рога, шерсть * коллаген - кожа * гемоглобин -
- 26. Примеры источников белка Мясо, рыба, молоко, соя, бобы, горох. Вывод: Белки встречаются в растительных и животных
- 27. Какие элементы входят в состав белков?
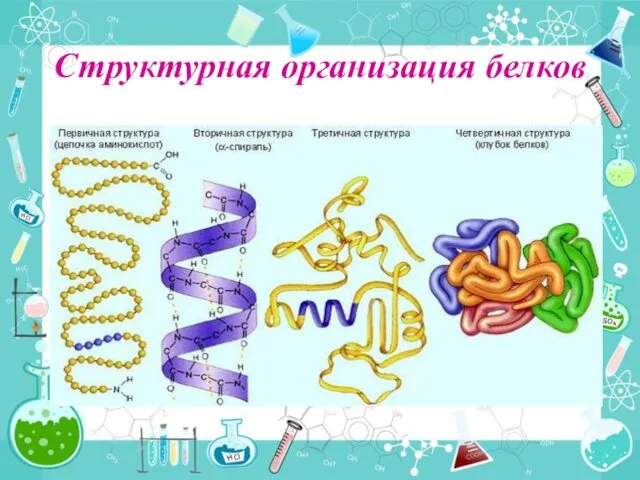
- 28. Структурная организация белков
- 30. Под воздействием уксусной кислоты или лимонной происходит частичный гидролиз белков. Белки распадаются на поли – и
- 31. ДЕНАТУРАЦИЯ Необратимое - (денатурация): Какой реакцией можно доказать наличие в белках углерода, водорода, кислорода? (Реакцией разложения
- 32. Биологическое значение белков Белки входят в состав мозга, всех внутренних органов, скелета и суставов, кожи, волосяного
- 34. Скачать презентацию





















 Профилактика асоциального поведения в детской среде
Профилактика асоциального поведения в детской среде Велимир Хлебников
Велимир Хлебников Вакансии компании Вияр
Вакансии компании Вияр Try-in and correction of the PRD. Remodeling and repair of removable dentures
Try-in and correction of the PRD. Remodeling and repair of removable dentures Monefy
Monefy Пособия по временной нетрудоспособности и безработице
Пособия по временной нетрудоспособности и безработице Понятие сестринского процесса. Лекция 4
Понятие сестринского процесса. Лекция 4 Выступление на МО Туапсеведение
Выступление на МО Туапсеведение Строение и функции мембран клеток
Строение и функции мембран клеток Мой дорогой сын
Мой дорогой сын Водород как альтернативный источник топлива
Водород как альтернативный источник топлива Правоохранительные органы
Правоохранительные органы Путешествие в страну здоровья
Путешествие в страну здоровья Урок труда Волшебные нитки, иголки и пуговицы
Урок труда Волшебные нитки, иголки и пуговицы Силы в природе
Силы в природе Международная академия исследования лжи
Международная академия исследования лжи Металлы в природе. Общие способы получения металлов
Металлы в природе. Общие способы получения металлов Модель психологической службы в организациях образования РК
Модель психологической службы в организациях образования РК Породы древесины
Породы древесины Презентация: Олимпийское движение. ГТО.
Презентация: Олимпийское движение. ГТО. Швейные ручные работы
Швейные ручные работы Производство битумов
Производство битумов Атом энергиясын бейбіт мақсатта пайдалану. Радиоактивті изотоптар мен иондаушы сәулелер көздерін медицинада қолдану
Атом энергиясын бейбіт мақсатта пайдалану. Радиоактивті изотоптар мен иондаушы сәулелер көздерін медицинада қолдану 01-график линейной функции
01-график линейной функции Презентация к уроку
Презентация к уроку Формирование гендерной принадлежности детей дошкольного возраста
Формирование гендерной принадлежности детей дошкольного возраста Готовность ребёнка к школе
Готовность ребёнка к школе Проект Загадки с грядки (сад и огород) для ясельной группы №1
Проект Загадки с грядки (сад и огород) для ясельной группы №1