Содержание
- 2. Красноярск, 2008 Кафедра химии Химия Для студентов нехимических специальностей технических вузов
- 3. УДК 54 ББК 24 Х46 Электронный учебно-методический комплекс по дисциплине «Химия» подготовлен в рамках инновационной образовательной
- 4. Строение атома и периодическая система элементов Д. И. Менделеева Теория химической связи и строение молекул Комплексные
- 5. Строение атома и периодическая система элементов Д. И. Менделеева
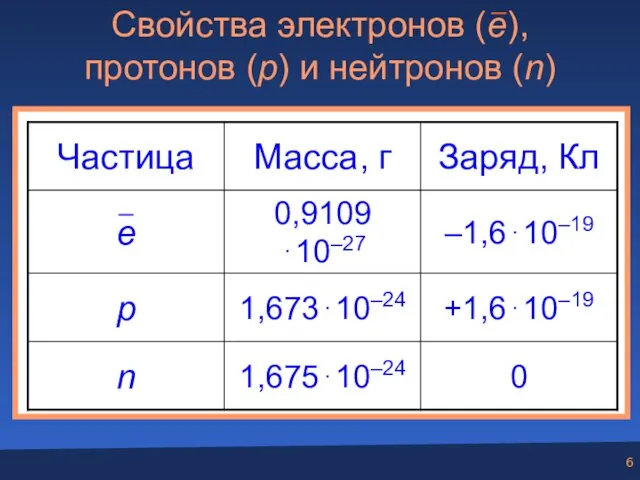
- 6. Свойства электронов (e), протонов (p) и нейтронов (n)
- 7. Соотношение масс электрона и атома водорода
- 8. Изотопы и изобары Изотопы имеют одинаковые заряды ядер,но различные атомные массы: 24Mg и 25Mg; 35Cl и
- 9. Двойственные свойства электрона Как частицы: Как волны: 1. Дифракция. 2. Интерференция. 3. Неопределенность положения в пространстве
- 10. Волновое уравнение Шредингера (1926 г.) Волновые функции Ψ, являющиеся решениями уравнения Шредингера, называют орбиталями (s-, p-,
- 11. Квантовые числа главное (n) и орбитальное (l) n – характеризует энергию электрона на энергетическом уровне и
- 12. Формы электронных облаков
- 13. Квантовые числа: магнитное (ml) и спиновое (ms) ml – определяет количество ориентаций электронных облаков в пространстве
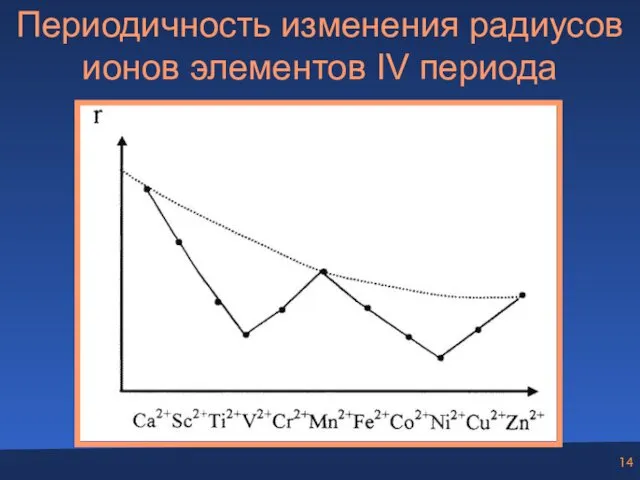
- 14. Периодичность изменения радиусов ионов элементов IV периода
- 15. Теория химической связи и строение молекул
- 16. Ковалентная связь Неполярная ковалентная связь ЭОА=ЭОВ А=В H2, Cl2, O2, N2 … H : H μ
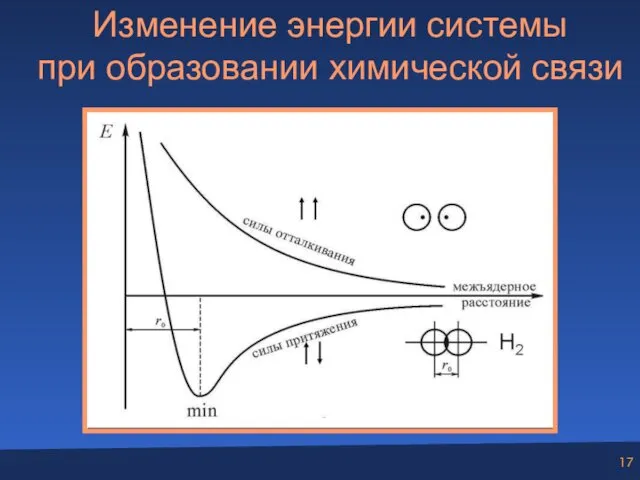
- 17. Изменение энергии системы при образовании химической связи
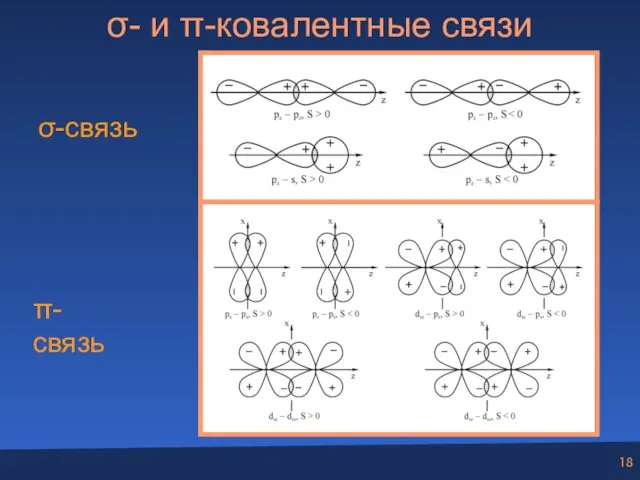
- 18. σ- и π-ковалентные связи σ-связь π-связь
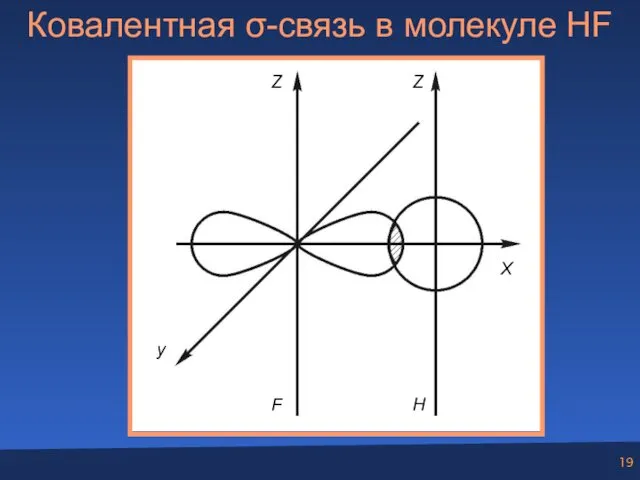
- 19. Ковалентная σ-связь в молекуле HF
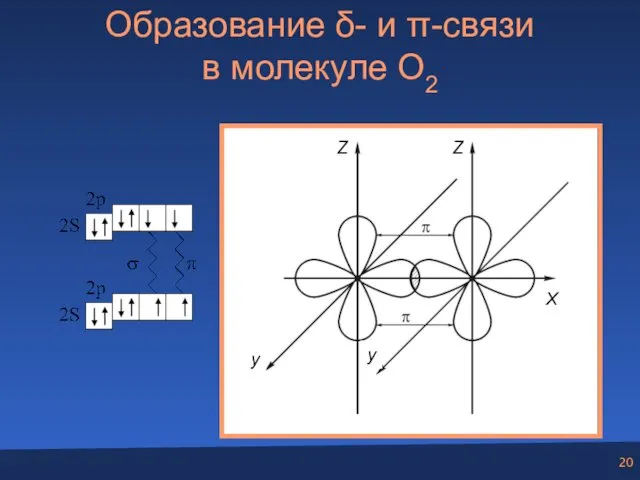
- 20. Образование δ- и π-связи в молекуле O2
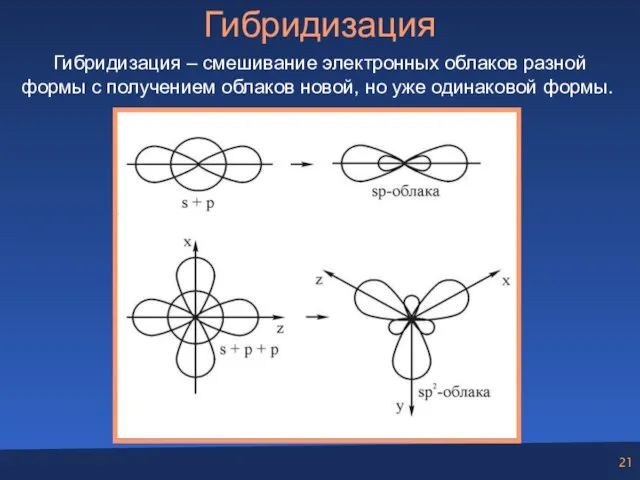
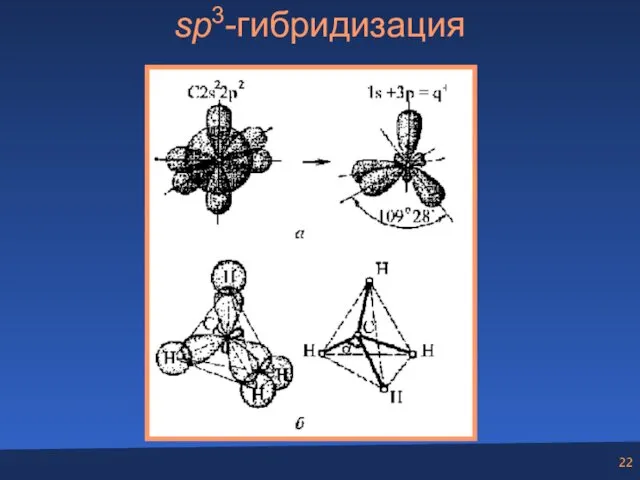
- 21. Гибридизация Гибридизация – смешивание электронных облаков разной формы с получением облаков новой, но уже одинаковой формы.
- 22. sp3-гибридизация
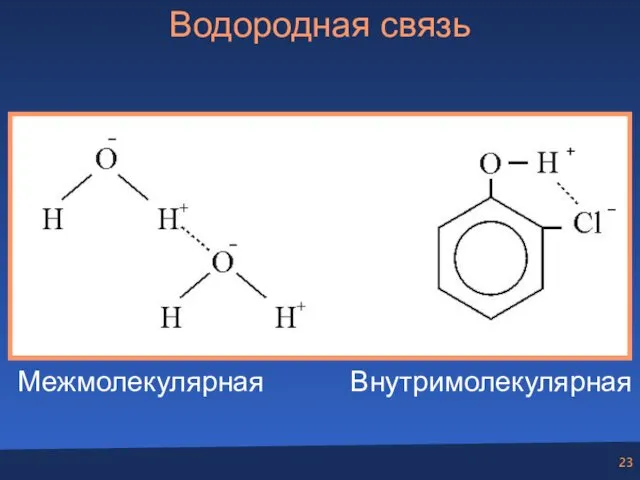
- 23. Водородная связь Межмолекулярная Внутримолекулярная
- 24. Межмолекулярное взаимодействие (силы Ван-дер-Ваальса, E) E = Eориент. + Eинд. + Eдисп. E – энергия ориентационного,
- 25. Комплексные соединения
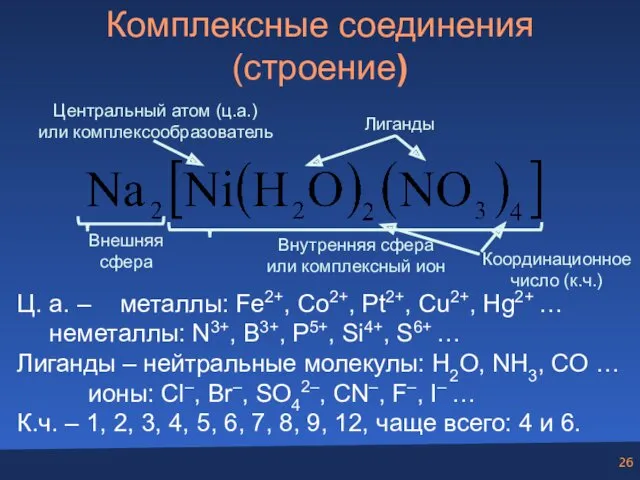
- 26. Комплексные соединения (строение) Центральный атом (ц.а.) или комплексообразователь Лиганды Координационное число (к.ч.) Внешняя сфера Внутренняя сфера
- 27. Комплексные соединения Константа нестойкости
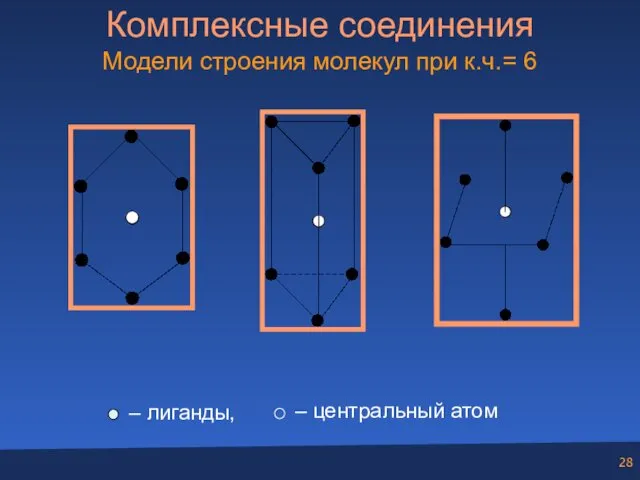
- 28. Комплексные соединения Модели строения молекул при к.ч.= 6
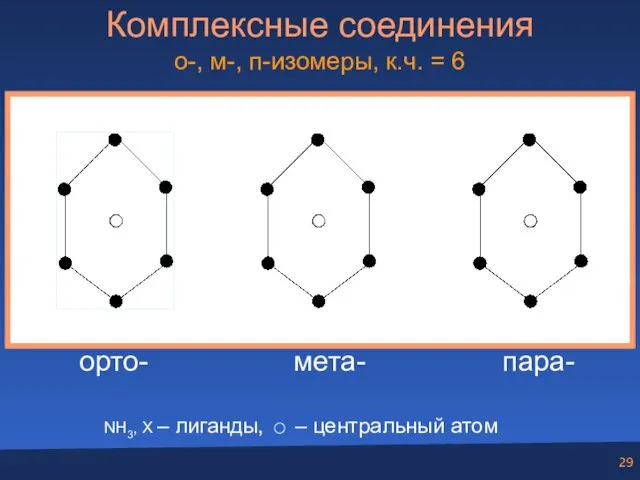
- 29. Комплексные соединения о-, м-, п-изомеры, к.ч. = 6 NH3, X – лиганды, NH3 NH3 NH3 NH3
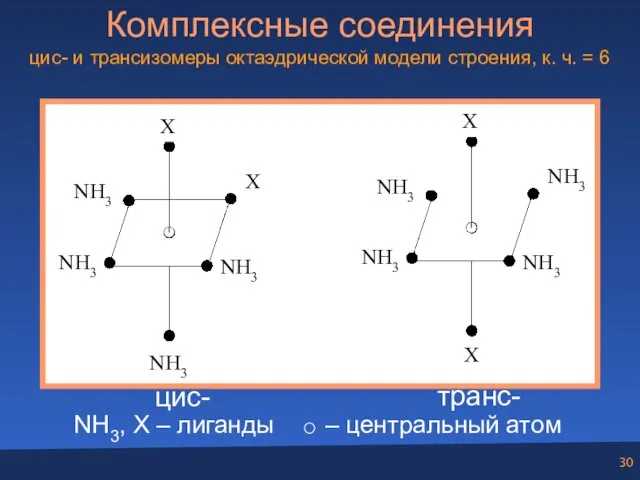
- 30. Комплексные соединения цис- и трансизомеры октаэдрической модели строения, к. ч. = 6 NH3, X – лиганды
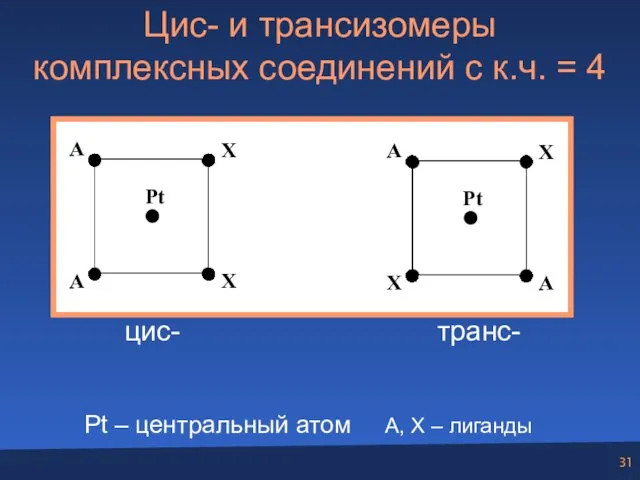
- 31. Цис- и трансизомеры комплексных соединений с к.ч. = 4 Pt – центральный атом A, X –
- 32. Энергетика химических процессов
- 33. Внутренняя энергия (U) U=U1+U2+U3+U4+U5, где U1 – энергия поступательного движения молекул; U2 – энергия вращательного движения
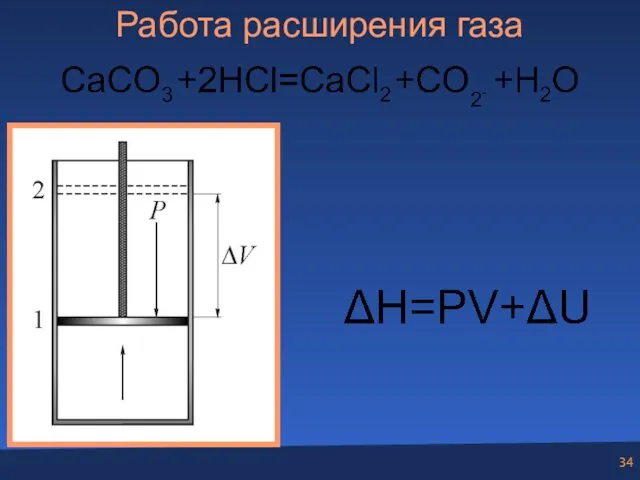
- 34. Работа расширения газа
- 35. Энтальпия (ΔН), кДж/моль .
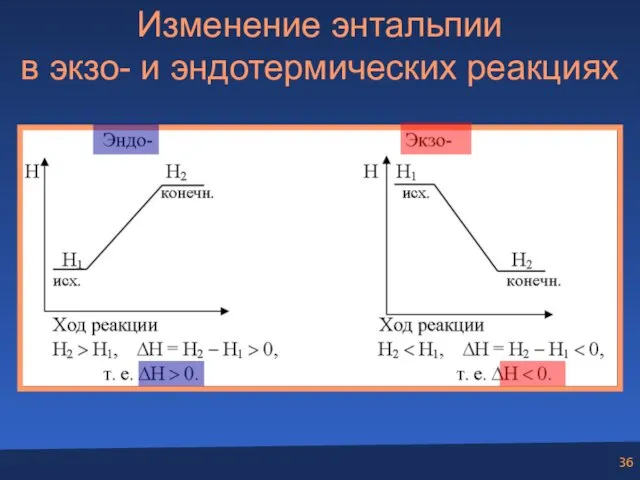
- 36. Изменение энтальпии в экзо- и эндотермических реакциях
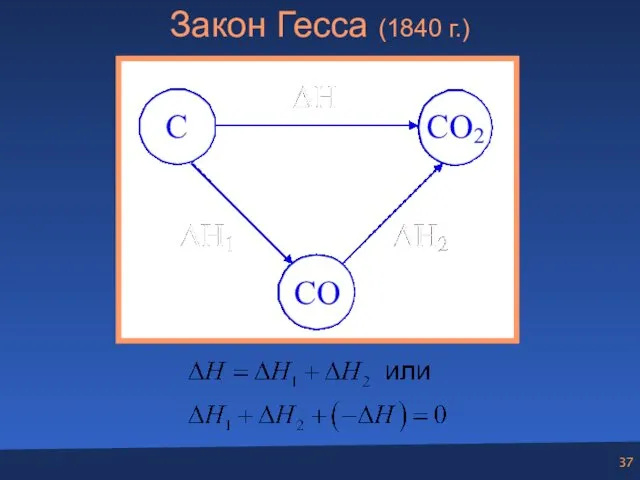
- 37. Закон Гесса (1840 г.)
- 38. Следствие из закона Гесса
- 39. Энтропия (S), Дж/моль⋅К Стандартные условия: T = 298 К, P = 101,3 кПа = 1 атм.
- 40. Энергия Гиббса (ΔG) (изобарно-изотермический потенциал) – стандартная энергия Гиббса образования вещества.
- 41. Направленность химических реакций 1. При ΔG 2. При ΔG > 0 невозможно протекание прямой реакции, но
- 42. Химическая кинетика и равновесие
- 43. Закон действия масс При постоянной температуре скорость реакции прямо пропорциональна произведению концен-траций реагирующих веществ в степенях,
- 44. Влияние температуры на скорость химической реакции Правило Вант-Гоффа При повышении температуры на каждые 10 градусов скорость
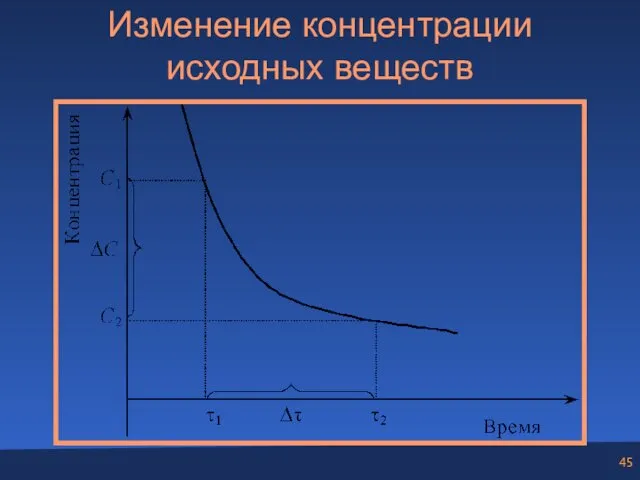
- 45. Изменение концентрации исходных веществ
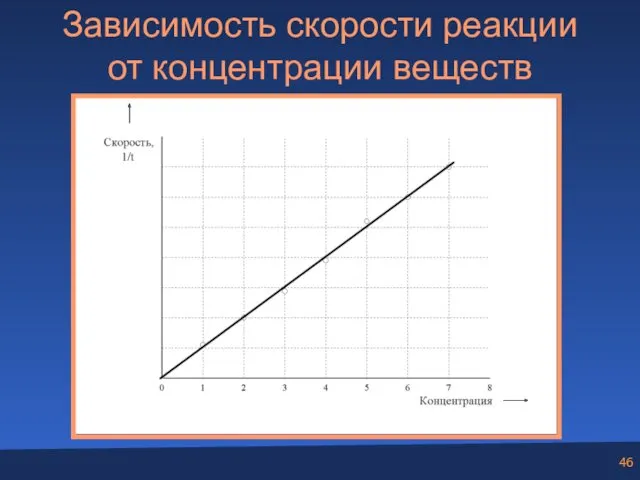
- 46. Зависимость скорости реакции от концентрации веществ
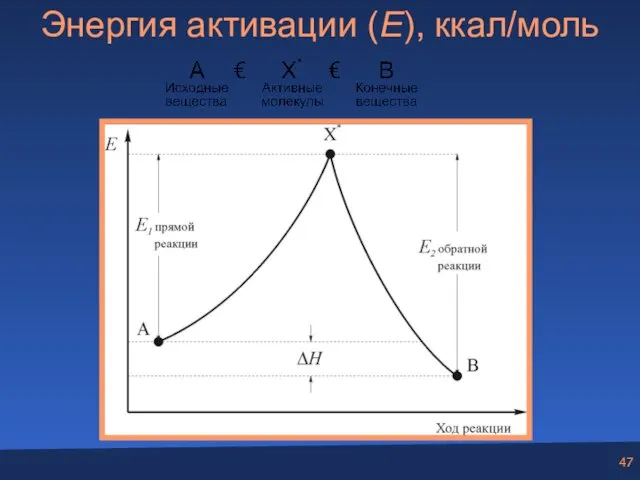
- 47. Энергия активации (E), ккал/моль
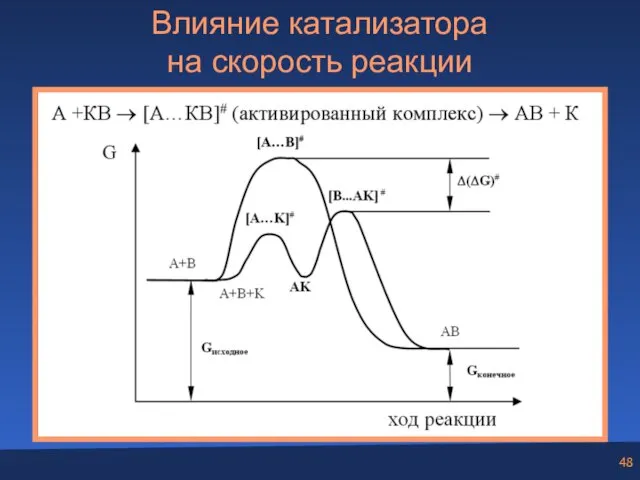
- 48. Влияние катализатора на скорость реакции
- 49. Химическое равновесие Константа равновесия Гомогенная реакция: 2H2(г) + O2(г) ↔ 2H2O(пар) Гетерогенная реакция: CaCO3(т) = CaO(т)+CO2(г).
- 50. Фазовые равновесия Правило фаз Гиббса: С = k – f + n, где k – число
- 51. Растворы
- 52. Растворы Разбавленные Концентрированные Насыщенные Виды концентрации растворов 1. ω – массовая доля вещества, % или доли
- 53. Растворы Способы выражения их концентрации 1. Массовая доля вещества (ω) показывает, какая масса растворенного вещества содержится
- 54. Растворы (продолжение) 3. Нормальная или эквивалентная концентрация (СH) равна количеству (nЭ) эквивалентов растворенного вещества в 1
- 55. Молярные массы эквивалентов (Мэ) ,
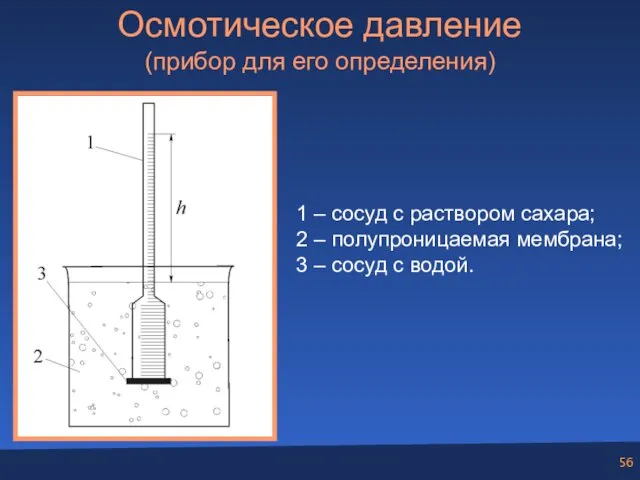
- 56. Осмотическое давление (прибор для его определения) 1 – сосуд с раствором сахара; 2 – полупроницаемая мембрана;
- 57. Гидролиз солей по аниону I ступень II ступень
- 58. Гидролиз солей по катиону I ступень II ступень
- 59. Жесткость воды Соли временной жесткости воды: Ca(HCO3)2, Mg(HCO3)2. Соли постоянной жесткости воды: CaCl2, CaSO4, Ca(NO3)2, MgCl2,
- 60. Способы устранения жесткости воды
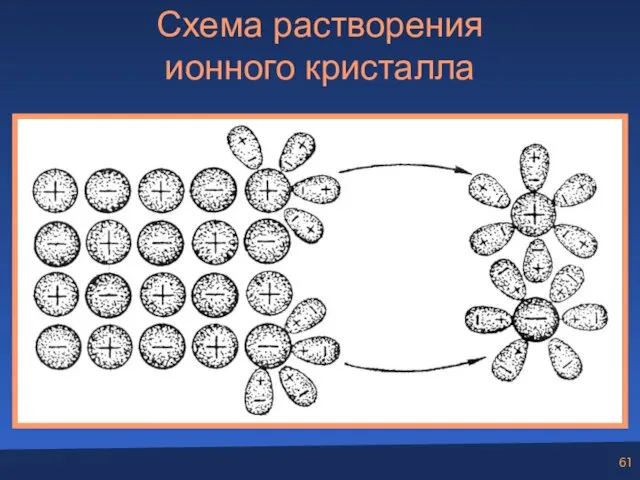
- 61. Схема растворения ионного кристалла
- 62. Дисперсные системы
- 63. Классификация дисперсных частиц
- 64. Строение мицеллы {m[AgJ] ⋅ nJ– ⋅ (n – x) K+}x K+ m[AgJ] – агрегат; m[AgJ] ⋅
- 65. Электрохимические системы
- 66. Окислительно-восстановительные реакции Окисление – процесс отдачи электронов атомом или ионом. Восстановление – процесс присоединения электронов атомом
- 67. Окислительно-восстановительные свойства металлов
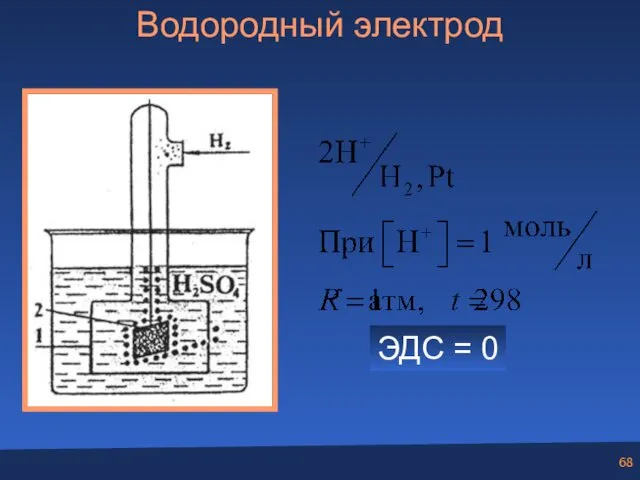
- 68. Водородный электрод
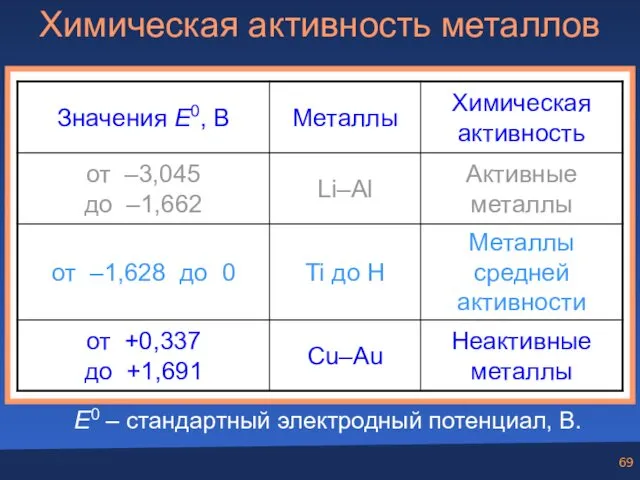
- 69. Химическая активность металлов E0 – стандартный электродный потенциал, В.
- 70. Гальванические элементы
- 71. Уравнение Нернста Концентрационный гальванический элемент
- 72. Электролиз Закон Фарадея Перенапряжение (En)
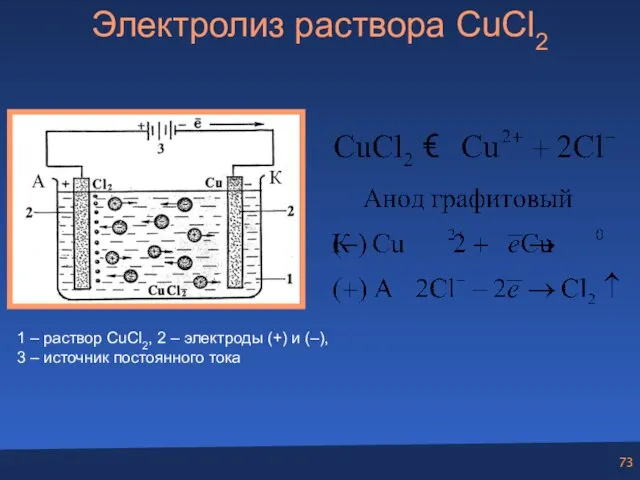
- 73. Электролиз раствора CuCl2 1 – раствор CuCl2, 2 – электроды (+) и (–), 3 – источник
- 74. Электролиз. Процессы на катоде 1. Катионы активных металлов на катоде не восстанавливаются, вместо них выделяется водород
- 75. Электролиз. Процессы на аноде Нерастворимый анод 1. Бескислородные кислотные остатки окисляются на аноде: (+) А 2Cl−
- 76. Электролиз расплава NaCl
- 77. Электролиз водного раствора NaCl
- 78. Коррозия металлов
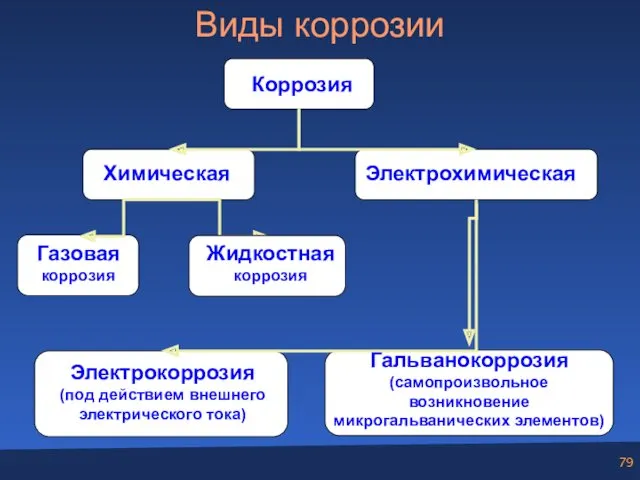
- 79. Виды коррозии
- 80. Контактная электрохимическая коррозия
- 81. Анодное покрытие Fe (+) K
- 82. Катодное покрытие Fe (–) A
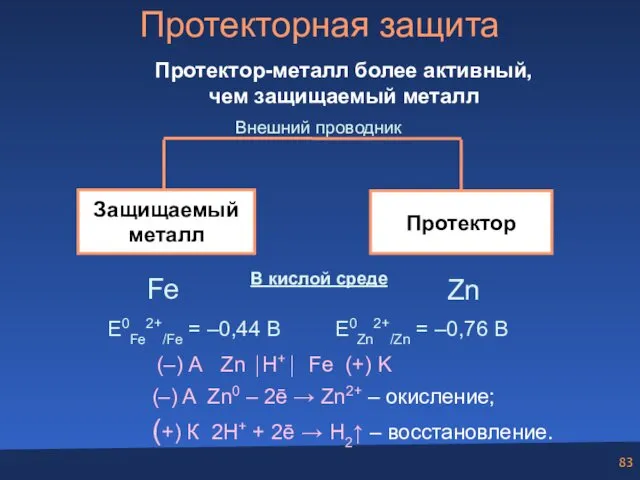
- 83. Протекторная защита Протектор-металл более активный, чем защищаемый металл В кислой среде Fe E0Fe2+/Fe = –0,44 В
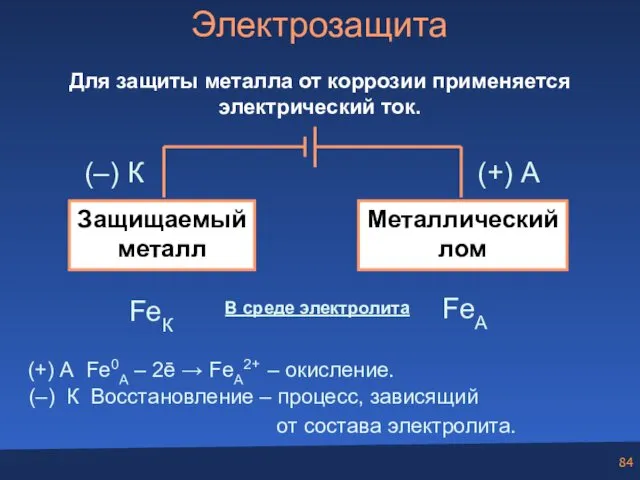
- 84. Электрозащита Для защиты металла от коррозии применяется электрический ток. В среде электролита FeК FeА (+) А
- 85. Общая характеристика металлов
- 86. Минералы металлов в природе Оксиды Fe2O3 – гематит, Al2O3⋅nH2O – боксит, Cu2O – куприт Сульфиды FeS2
- 87. Взаимодействие металлов с водой, щелочами
- 88. Взаимодействие металлов с разбавленными HCl и H2SO4 . ; . ; .
- 89. Взаимодействие металлов с концентрированной серной кислотой Сера изменяет степень окисления от +6 до: а) – 2;
- 90. Взаимодействие металлов с разбавленной азотной кислотой Азот изменяет степень окисления от +5 до: а) –3; б)
- 91. Взаимодействие металлов с концентрированной азотной кислотой . ;
- 92. Взаимодействие металлов с неметаллами Оксиды – Na2O, BaO. Нитриды – Na3N, AlN. Пероксиды – Na2O2, BaO2.
- 93. Способы получения металлов из руд пирометаллургия; гидрометаллургия; электрометаллургия; химические методы.
- 94. Пирометаллургические способы получения металлов из руд 1. Карботермический (восстановители C и CO): 2. Металлотермический (восстановители Mg,
- 95. Электрометаллургический способ Al2O3 → Al3+ + AlO33– (–) К Al3+ + 3ē → Al (+) А
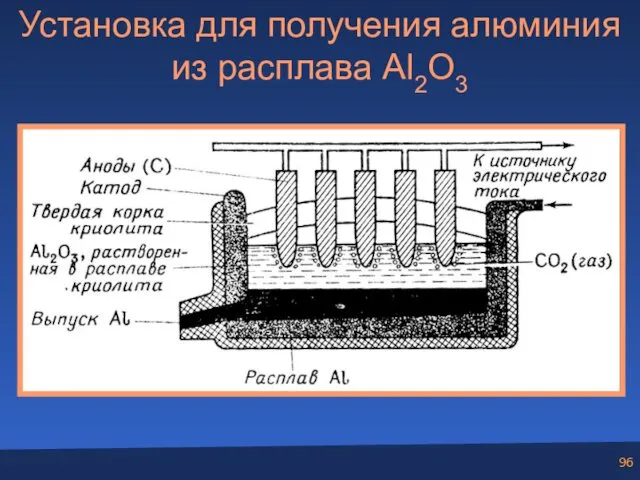
- 96. Установка для получения алюминия из расплава Al2O3
- 97. Химический метод очистки металлов
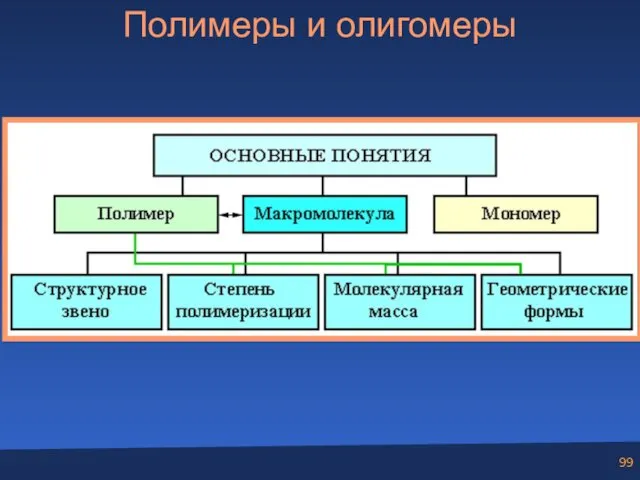
- 98. Полимеры и олигомеры
- 99. Полимеры и олигомеры
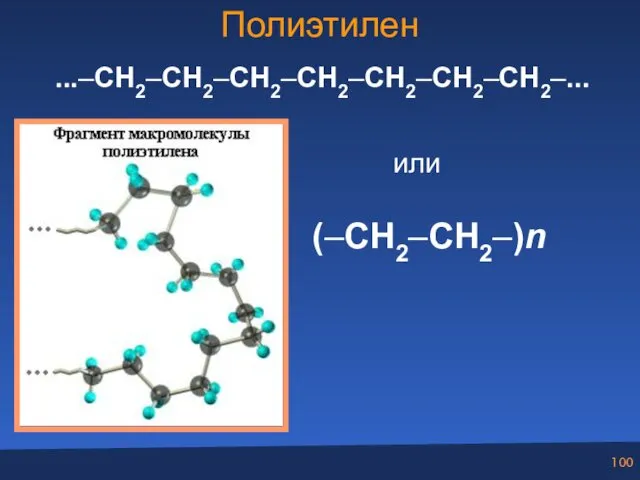
- 100. Полиэтилен ...–CH2–CH2–CH2–CH2–CH2–CH2–CH2–... или (–CH2–CH2–)n
- 101. Мономеры и полимеры Пропилен СН2=СH–CH3 – мономер полипропилена α-аминокислоты – мономеры природных полимеров – белков (полипептидов):
- 102. Степень полимеризации Степень полимеризации (n) показывает, сколько молекул мономера соединилось в макромолекулу. n >> 1
- 103. Классификация полимеров По происхождению ∙ природные ∙ синтетические ∙ искусственные По геометрической форме ∙ линейные ∙
- 104. Гомоцепные полимеры Полиэтилен Полиизобутилен Поливинилхлорид (полихлорвинил) Политетрафтор- этилен Поливинилацетат Полиакриловая кислота
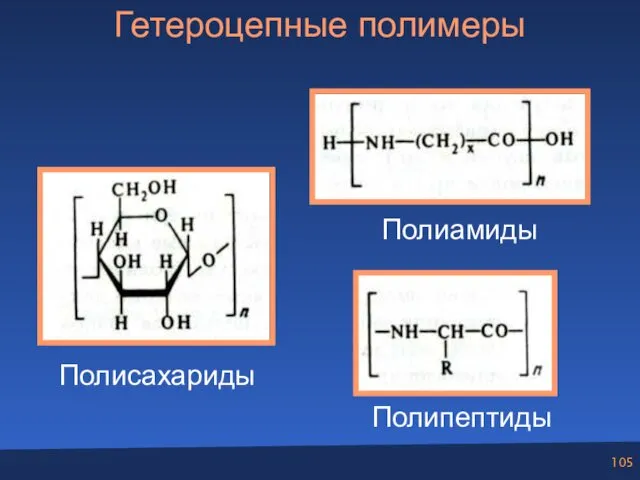
- 105. Гетероцепные полимеры Полисахариды Полиамиды Полипептиды
- 106. Физико-химические методы анализа
- 107. Оптические методы анализа 1. Атомный спектральный анализ 2. Молекулярный спектральный анализ Эмиссионная фотометрия пламени Атомно-абсорбционная спектроскопия
- 108. Оптические методы анализа (продолжение) 3. Люминисцентный метод анализа Нефелометрия Турбидиметрия 4. Рефрактометрический анализ 5. Поляриметрический метод
- 109. Классификация электрохимических методов анализа
- 111. Скачать презентацию






































![Строение мицеллы {m[AgJ] ⋅ nJ– ⋅ (n – x) K+}x](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/41643/slide-63.jpg)

































 Педагогическое общение
Педагогическое общение Презентация. Православные праздники русского народа.
Презентация. Православные праздники русского народа. Классный час Секреты Ромео и Джульетты
Классный час Секреты Ромео и Джульетты Векторная алгебра. Лекционно-практические занятия
Векторная алгебра. Лекционно-практические занятия Особенности коррозии в морской воде
Особенности коррозии в морской воде Строительные материалы и изделия
Строительные материалы и изделия Музейная педагогика
Музейная педагогика Встреча – медитация по сакральной геометрии
Встреча – медитация по сакральной геометрии Элементы внешней среды. АО Костромской завод автокомпонентов
Элементы внешней среды. АО Костромской завод автокомпонентов презентация к проекту Вагоны грузовогои пассажирского парков
презентация к проекту Вагоны грузовогои пассажирского парков Дөңгелек ауыздылар мен сүйекті балықтар кластарының систематикалық топтарын анықтаудын әдістері
Дөңгелек ауыздылар мен сүйекті балықтар кластарының систематикалық топтарын анықтаудын әдістері Техническое обслуживание железнодорожного пути
Техническое обслуживание железнодорожного пути Тема урока: Австралия – страна-материк
Тема урока: Австралия – страна-материк Судебно-психиатрическая экспертиза
Судебно-психиатрическая экспертиза Отрасли производства
Отрасли производства Автомобили
Автомобили Кольчурина А.С. СОШ №21
Кольчурина А.С. СОШ №21 Африка: рельеф, тектоническое строение, полезные ископаемые
Африка: рельеф, тектоническое строение, полезные ископаемые Клещевой сыпной тиф Северной Азии
Клещевой сыпной тиф Северной Азии Что такое дружба
Что такое дружба Влияние музыки на речевое развитие детей
Влияние музыки на речевое развитие детей Театрализованная деятельность в первой младшей группе
Театрализованная деятельность в первой младшей группе С днем рождения
С днем рождения Методическая разработка урока химии для 9 класса в соответствии с требованиями ФГОС второго поколения.Тема:Предельные углеводороды(мультимедийное сопровождение)
Методическая разработка урока химии для 9 класса в соответствии с требованиями ФГОС второго поколения.Тема:Предельные углеводороды(мультимедийное сопровождение) Welcome to the Zoo
Welcome to the Zoo Комплекс упражнений для разминки баскетболиста
Комплекс упражнений для разминки баскетболиста Методы экономического анализа
Методы экономического анализа Презентация Птицы перелетные в дорогу собираются… Диск
Презентация Птицы перелетные в дорогу собираются… Диск