Содержание
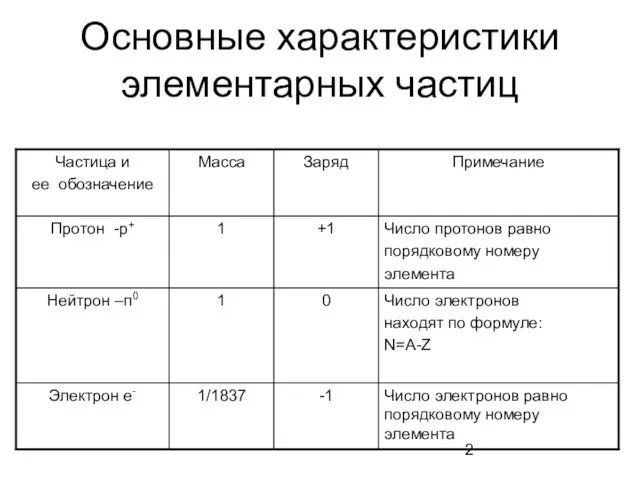
- 2. Основные характеристики элементарных частиц
- 3. Главное квантовое число(n) n - 1, 2, 3,…∞, определяет энергию электрона в атоме Энергетический уровень -
- 4. Орбитальное квантовое число (l) харак-ет форму электронного облака l = 0, 1, 2, 3….n-1 Подуровень: s,
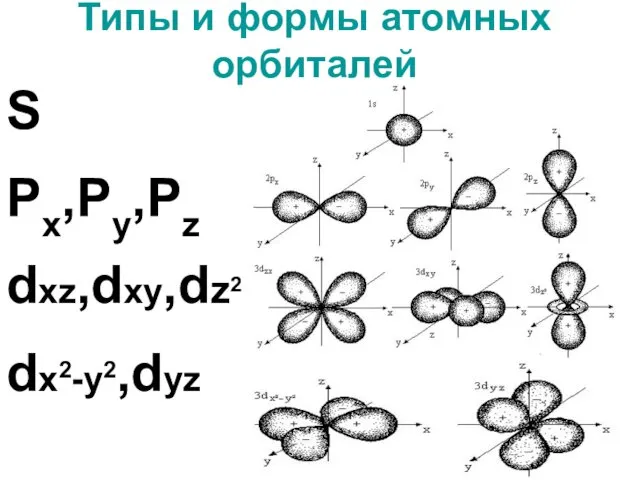
- 5. Типы и формы атомных орбиталей S Px,Py,Pz dxz,dxy,dz2 dx2-y2,dyz
- 6. Магнитное квантовое число (ml) характеризует ориентацию электронных облаков в пространстве ml меняется от –l до +l,
- 7. Спиновое квантовое число (ms) характеризует собственный магнитный момент электрона, который или совпадает с ориентацией орбитального момента,
- 8. Атомная орбиталь (АО) это состояние электрона в атоме, которое описывается волновой функцией с набором из трех
- 9. Закономерности формирования электронных структур Принцип наименьшей энергии: электрон размещается на АО c min энергией Принцип Паули:
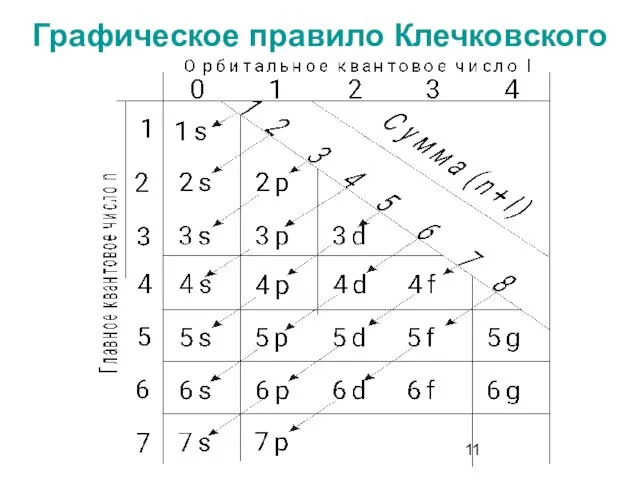
- 10. Правила Клечковского Ниже по энергии находится та орбиталь для которой сумма (n + l) минимальна Если
- 11. Графическое правило Клечковского
- 12. Последовательность заполнения АО по правилам Клечковского 1sι 2s2pι 3s3pι 4s3d4pι 5s4d5pι ⇒6s4f5d6pι 7s5f6d7p
- 13. Способы изображения электронных структур Электронная формула Графическая структура Энергетическая диаграмма
- 14. Примеры электронных структур Полная электронная формула Se - 1s22s22p63s23p64s23d104p4 Краткая формула Se - 4s24p4 Электроно-графическая формула
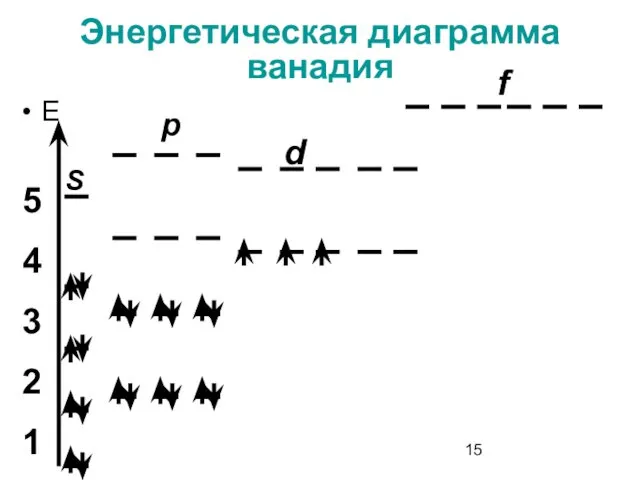
- 15. Энергетическая диаграмма ванадия Е 5 4 3 2 1 S p d f
- 16. Maксимальная емкость подуровня: 2(2l+1)e Максимальная емкость уровня: 2n2е
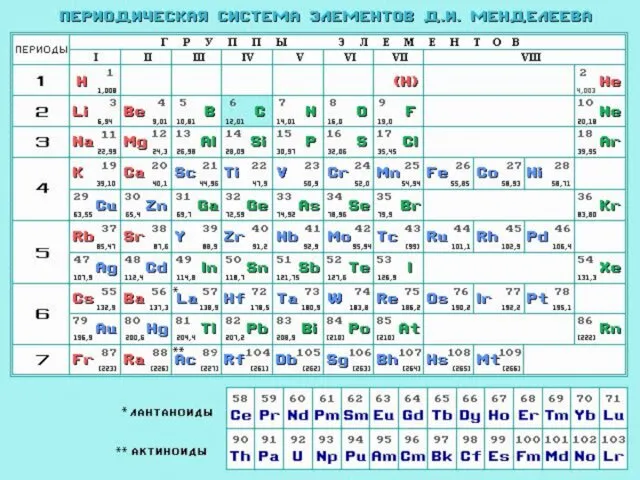
- 17. Периодическая система элементов Д.И. Менделеева (1869г.) Свойства элементов, а также формы и свойства их соединений находятся
- 18. Неясные моменты В чем причина периодичности? Почему элементы одной группы имеют одинаковую валентность и образуют одинаковые
- 19. Периодический закон Свойства элементов, а также формы и свойства их соединений находятся в периодической зависимости от
- 20. Причина периодичности Определенная последовательность формирования электронных оболочек (принципы и правила Паули, Хунда, Клечковского) Периодическое повторение сходных
- 21. Короткие периоды 1 период (n=1): (2n2) 2 элемента (1s2) 2 период (n=2): (2n2) 8 элементов (2s22p6)
- 22. Длинные периоды 4 период (n=4): (2n2 -2*7) 18 элементов (4s23d104p6) 5 период (n=5): (2n2 -2(7 +
- 23. Период - горизонтальная последовательность эл-тов, атомы которых имеют равное число энергетических уровней, частично или полностью заполненных
- 24. Группа - вертикальная последовательность элементов с однотипной электроной конфигурацией атомов, равным числом внешних эл-нов, одинаковой max
- 26. Периодичность свойств элементов атомные и ионные радиусы энергия ионизации сродство к электрону электроотрицательность валентность элементов
- 27. Валентность Валентность определяется электронами внешнего уровня, поэтому высшая валентность элементов главных подгрупп равна номеру группы
- 28. Периодичность свойств простых веществ и соединений температура плавления и кипения длина химической связи энергия химической связи
- 29. Атомные и ионные радиусы химических элементов Орбитальный радиус атома (иона) – это расстояние от ядра до
- 30. Радиус ум-ся р а с т е т
- 31. Эффективные радиусы атомов и ионов определяют по межъядерным расст-ям в молекулах и кристаллах, предполагая, что атомы
- 32. Ковалентные радиусы - это эффективные радиусы, определяемые по межъядерным расстояниям в ковалентных молекулах Металлические радиусы -
- 33. Энергия и потенциал ионизации атомов Энергия ионизации – это энергия, необходимая для отрыва электро-на от атома
- 34. Сродство к электрону это энергия, выделяющаяся или поглощающаяся при захвате электрона атомом или энергия, необходимая для
- 35. Периодические свойства соединений основно-кислотные свойства оксидов и гидроксидов: в периодах ум-ся основные свойства, но ув-ся кислотные
- 37. Скачать презентацию





























 Физкультминутка Зима Диск
Физкультминутка Зима Диск Своя игра к интегрированному уроку по теме Творчество зарубежных поэтов
Своя игра к интегрированному уроку по теме Творчество зарубежных поэтов Памятные места Ивана Сергеевича Тургенева. Виртуальное путешествие
Памятные места Ивана Сергеевича Тургенева. Виртуальное путешествие суриков детство отрывок наизусть
суриков детство отрывок наизусть День православной книги
День православной книги Углеводороды. Природные источники углеводородов. Нефть, ее состав и переработка. Нефтепродукты. Бензин. Природный газ как топливо. Состав природного газа. 10 класс
Углеводороды. Природные источники углеводородов. Нефть, ее состав и переработка. Нефтепродукты. Бензин. Природный газ как топливо. Состав природного газа. 10 класс Инструментальные материалы в современном машиностроении. (Лекция 3)
Инструментальные материалы в современном машиностроении. (Лекция 3) Введение в направление подготовки. Управление: ключевые понятия
Введение в направление подготовки. Управление: ключевые понятия Строки, опаленные войной С.П. Гудзенко
Строки, опаленные войной С.П. Гудзенко Научно- исследовательская работа по теме: Календарные праздники и традиционная обрядность российских немцев Омского Прииртышья в сохранении календарной обрядности российскими немцами села Солнцевки Исилькульского района Омской области .
Научно- исследовательская работа по теме: Календарные праздники и традиционная обрядность российских немцев Омского Прииртышья в сохранении календарной обрядности российскими немцами села Солнцевки Исилькульского района Омской области . Амурская область
Амурская область Поздравляю с 23 февраля
Поздравляю с 23 февраля Порядок организации и осуществления подготовки различных групп населения в области гражданской обороны и защиты от ЧС
Порядок организации и осуществления подготовки различных групп населения в области гражданской обороны и защиты от ЧС Победа греков над персами в Марафонской битве
Победа греков над персами в Марафонской битве Mindset branding
Mindset branding Образовательный проект Моя инициатива в сфере образования
Образовательный проект Моя инициатива в сфере образования Части речи. Существительное
Части речи. Существительное Внеклассное чтение 12 - 14 лет
Внеклассное чтение 12 - 14 лет Ты помнишь, Тихвин, о войне. Хронология событий
Ты помнишь, Тихвин, о войне. Хронология событий Толерантность в ученических коллективах
Толерантность в ученических коллективах Установка умывальника с монтажом сифона и подключением к системе водоотведения
Установка умывальника с монтажом сифона и подключением к системе водоотведения Воспаление. Фазы воспалительной реакции
Воспаление. Фазы воспалительной реакции Одуванчики из салфеток
Одуванчики из салфеток Бизнес-план проекта. План менеджмента. (Лекция 11.3)
Бизнес-план проекта. План менеджмента. (Лекция 11.3) Географическое положение России. Тренажер 9 кл
Географическое положение России. Тренажер 9 кл Будущее простое время. Future simple tense
Будущее простое время. Future simple tense Эволюция государственного управления в Московском государстве во II половине XVI - XVII веков
Эволюция государственного управления в Московском государстве во II половине XVI - XVII веков Гигиенические требования к белью, комнатной одежде, одежде для прогулок и обуви детей первого года жизни
Гигиенические требования к белью, комнатной одежде, одежде для прогулок и обуви детей первого года жизни