Содержание
- 2. Окончательное решение ψ(r, ϑ, ϕ) = Rn,l(r)* Yl,m(ϑ, ϕ)=f(n,l,m) Атомная орбиталь (АО) это волновая функция описывающая
- 3. Энергетическая диаграмма. n =1 E = -Z2/2n2 = -1/2 а.е. = -1/2*27,2 эВ = - 13,6
- 4. Правила отбора для переходов с АО Состояние атома с наименьшей энергией Е(n) называют основным состоянием n
- 5. Спектральные серии ϖ = Ry* (1/ n12 - 1/ n22 ) Ry= me4/8ε20 h3 c =
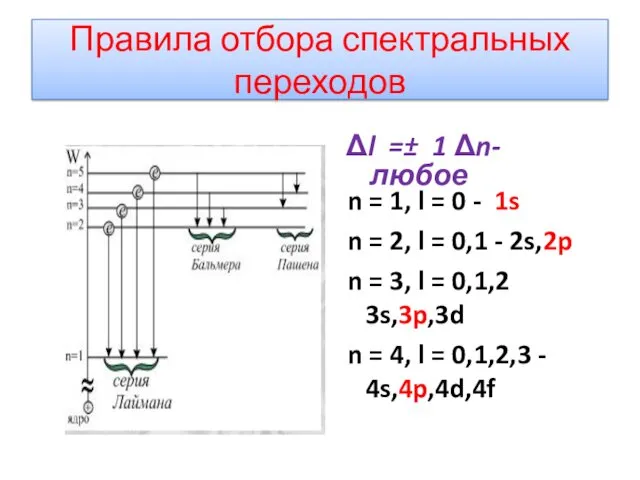
- 6. Правила отбора спектральных переходов Δl =± 1 Δn-любое n = 1, l = 0 - 1s
- 7. Взаимосвязь квантовых чисел l и m Угловой момент количества движения электрона квантуется по уравнению: Также квантуется
- 8. Спин электрона. (Уленбек и Гаудсмит) Для объяснении расщеплений в атомных спектрах в магнитном поле ввели понятие
- 9. Спин-орбиталь электрона χi = Ψ(n, l, m)*σ(ms) = f(n, l, m, ms) Спин-орбитальный момент количества движения
- 10. Спин – орбитальное расщепление линий J меняется от l +S до l – S Рассмотрим АО-
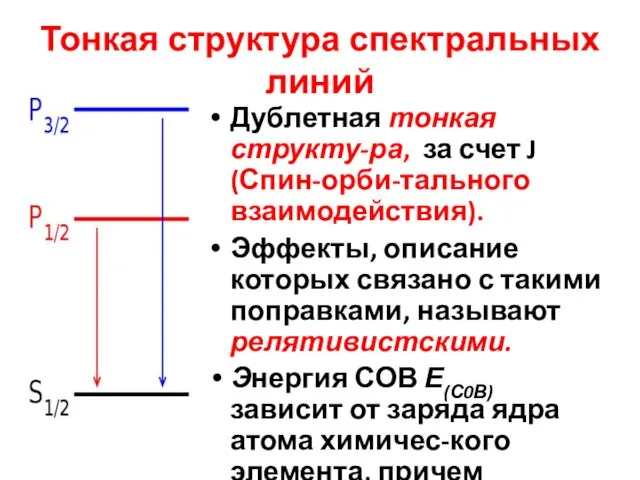
- 11. Тонкая структура спектральных линий Дублетная тонкая структу-ра, за счет J (Спин-орби-тального взаимодействия). Эффекты, описание которых связано
- 12. Типы CОB атомов Нормальная связь Рассел-Саундерса. Орбитальные моменты взаимодействуют между собой сильнее чем со спиновыми моментами.
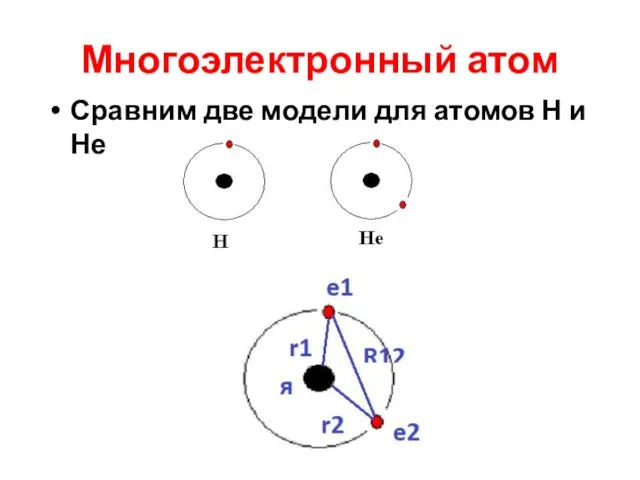
- 13. Многоэлектронный атом Сравним две модели для атомов Н и Не
- 14. Многоэлектронный атом. Рассмотрим модель атома He с двумя е. Т = Σ Ti = Te1 +
- 15. Приближенные методы решения уравнения Шредингера Нулевое приближение. Пренебрежении отталкиванием электронов: ∑∑ 1/rij = 0 EHe =2*EH
- 16. Метод Слейтера. Джон Слейтер 1901- 1976 гг. Американский физик, профессор, директор отдела физики в Массачусетском технологическом
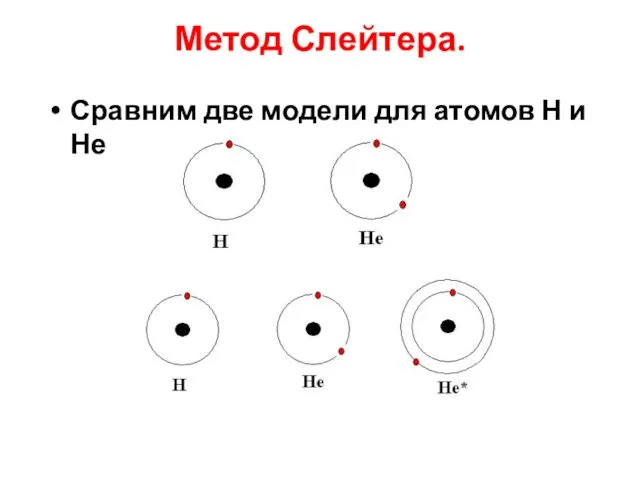
- 17. Метод Слейтера. Сравним две модели для атомов Н и Не
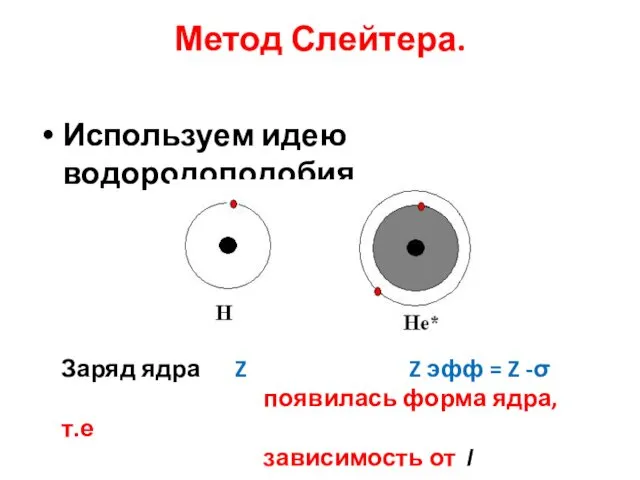
- 18. Метод Слейтера. Используем идею водородоподобия Заряд ядра Z Z эфф = Z -σ появилась форма ядра,
- 19. Метод Слейтера. В метода Слейтера реализована идея водородоподобия, т.е. вместо модели многоэлектронного атома, рассматри-вается одноэлектронное приближение.
- 20. Метод Слейтера. Н = 1/2∇2е1+1/2∇2е2 + Z/r1+ Z/r2 - 1/r12 (1/2∇2е1+1/2∇2е2 + E + Z/r1+ Z/r2
- 21. Атомная орбиталь ψ(r, ϕ,ϑ , )= Rn,l(r)* θl,m (ϑ)* Φm (ϕ) = f(n,l,m) Zэфф = Z
- 22. Константы экранирования σ и эффективные заряды Zэфф ядер атомов. Атом He Li Be B C N
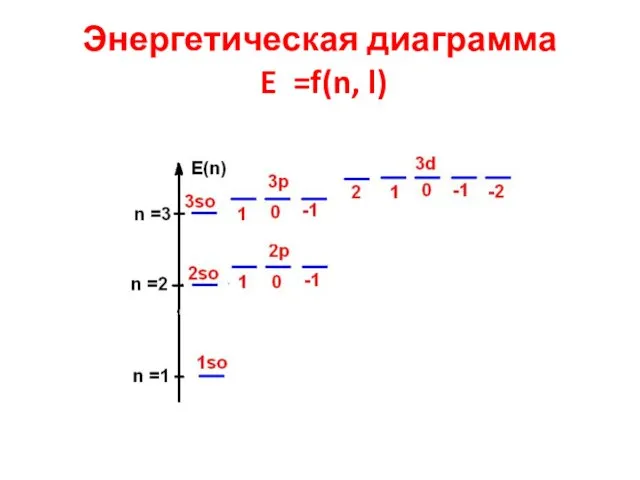
- 23. Энергетическая диаграмма E =f(n, l)
- 24. Выводы 1.Pезультат одноэлектроного приближения – это зависимость E = f(n,l) вместо E =f(n) для атома H.
- 25. Выводы 2. Угловые часть волновой функции полностью совпадает с Y(ϑ,ϕ ) для атома водорода. 3. Радиальная
- 26. Распределение атомных орбиталей по энергии. Принцип минимума энергии. - Энергия АО увеличивается в ряду 1s -
- 27. ПРАВИЛА КЛЕЧКОВСКОГО Клечковский Всеволод Маврикиевич - советский агрохимик, академик ВАСХНИЛ . Родился в Москве. Основное направление
- 28. ПРАВИЛА КЛЕЧКОВСКОГО E = f(n, l) 1. Энергия уровня растет с ростом (n + l) 2.
- 29. Задание АО ≡ nlm l 0 1 2 3 АО s p d f Проверим на
- 30. Проверка Проверим на 3d и 4s и для 3d и 4p 3d n = 3 l
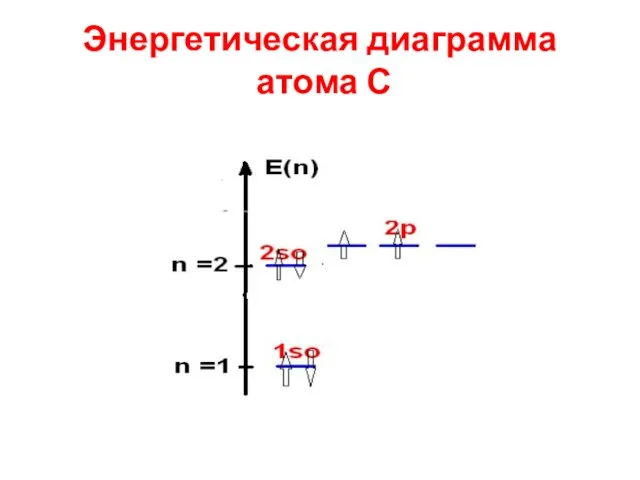
- 31. Энергетическая диаграмма атома С
- 32. Полная волновая функция атома. Состояние системы содержащей несколько электронов описывается полной волновой функцией, учитывающей квантовые состояния
- 33. Полная волновая функция атома ЭЛЕКТРОННОЙ КОНФИГУРАЦИЕЙ называется распределение электронов атома по различным квантовым состояниям (или спин-орбиталям).
- 34. АТОМНЫЙ ТЕРМ Атомный терм, является энергетической характеристикой многоэлектронного атома для схемы Рассел -Саундерса T = 2S+1LJ
- 35. Мультиплетность терма Спин Мультиплетность Обозначение S = 0 M = 2S+1 = 1 Синглет S =
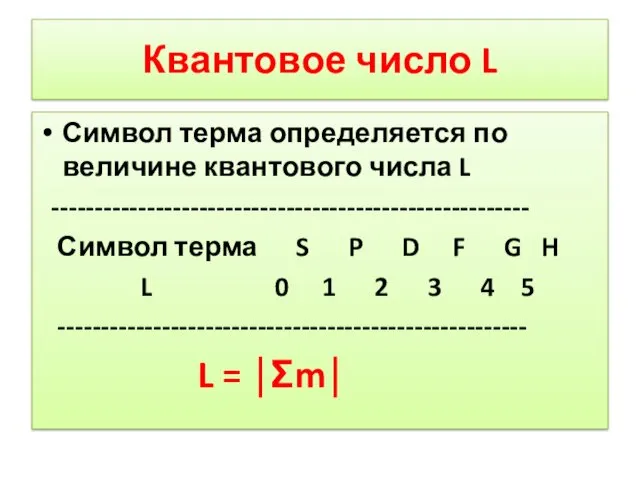
- 36. Квантовое число L Символ терма определяется по величине квантового числа L ------------------------------------------------------- Символ терма S P
- 37. Энергетическая диаграмма атома С Распределение электронов в атоме С
- 38. Правила Хунда Терм основного состояния всегда имеет максимальную мультиплетность М = 2S+1 Из двух состояний с
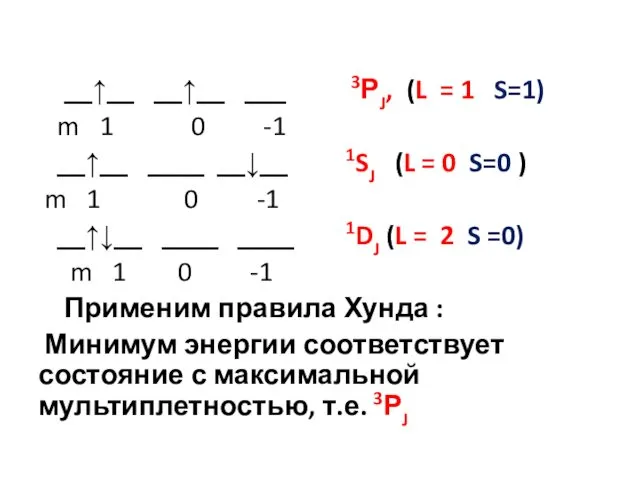
- 39. Микросостояния электронов в С Электронная конфигурация атома углерода 1s22s22p2 Рассмотреть расположения 2-х р-эл-нов. __↑__ __↑__ ___
- 40. __↑__ __↑__ ___ 3РJ, (L = 1 S=1) m 1 0 -1 __↑__ ____ __↓__ 1SJ
- 42. Скачать презентацию






























 Буклет на звуки Ч, Щ.
Буклет на звуки Ч, Щ. Обеспечение реализации прав граждан на социальное обслуживание в Российской Федерации
Обеспечение реализации прав граждан на социальное обслуживание в Российской Федерации Подготовка к ОГЭ 2021. Синтаксический анализ предложения
Подготовка к ОГЭ 2021. Синтаксический анализ предложения The articulation bases of English and Russian
The articulation bases of English and Russian Внешняя политика Николая I. Крымская война 1853-1856 гг
Внешняя политика Николая I. Крымская война 1853-1856 гг Ты сам-мастер. Моя неповторимая ваза
Ты сам-мастер. Моя неповторимая ваза Особенности ГИС в наклонно-направленных скважинах с горизонтальным окончанием
Особенности ГИС в наклонно-направленных скважинах с горизонтальным окончанием ТЦ Жәңгір Хан
ТЦ Жәңгір Хан Артистические профессии средневековья
Артистические профессии средневековья Презентация о Тамбове
Презентация о Тамбове Термическая и химико-термическая обработка металлов и сплавов
Термическая и химико-термическая обработка металлов и сплавов Функции. Лекция 5 по алгоритмизации и программированию
Функции. Лекция 5 по алгоритмизации и программированию Презентация к докладу Дифференциррованный подход в обучении химии
Презентация к докладу Дифференциррованный подход в обучении химии Юнармия. Реализация социального проекта Равнение на старшего, чтобы стать лучшим
Юнармия. Реализация социального проекта Равнение на старшего, чтобы стать лучшим Буквы Р р. Звуки [ р ] [ р’ ]
Буквы Р р. Звуки [ р ] [ р’ ] Презентация Руссая народная кукла. Домашние обрядовые куклы
Презентация Руссая народная кукла. Домашние обрядовые куклы 20230617_stefan_banah-_vydayushchiysya_polskiy_matematika_20_veka
20230617_stefan_banah-_vydayushchiysya_polskiy_matematika_20_veka Ненаправленная защита от замыканий на землю в сетях 6-35 кВ
Ненаправленная защита от замыканий на землю в сетях 6-35 кВ Презентация к уроку химии по теме: Хром
Презентация к уроку химии по теме: Хром классный час Моя малая Родина
классный час Моя малая Родина Амурский тигр (11 класс)
Амурский тигр (11 класс) Методологические принципы психологии
Методологические принципы психологии LW-P series IPG Fiber laser tube cutting machine. Technical solutions and quotations
LW-P series IPG Fiber laser tube cutting machine. Technical solutions and quotations Деление. Порядок выполнения действий. Степень числа. Квадрат и куб числа. Формулы. Площадь. Формулы площади. (5 класс)
Деление. Порядок выполнения действий. Степень числа. Квадрат и куб числа. Формулы. Площадь. Формулы площади. (5 класс) Международный день памятников и исторических мест
Международный день памятников и исторических мест Эоловые процессы
Эоловые процессы Ориентирование на местности. Стороны горизонта
Ориентирование на местности. Стороны горизонта Интелек-т карты
Интелек-т карты