Содержание
- 2. Химическая реакция — превращение одного или нескольких исходных веществ в отличающиеся от них по химическому составу
- 3. Химические реакции происходят: при смешении или физическом контакте реагентов самопроизвольно при нагревании при участии катализаторов действии
- 4. Все реакции сопровождаются тепловыми эффектами. При разрыве химических связей в реагентах выделяется энергия, которая, в основном,
- 5. Реакции, протекающие с выделением теплоты и света называются - РЕАКЦИЯМИ ГОРЕНИЯ Реакции, протекающие с выделением теплоты,
- 6. Какие условия должны выполняться, чтобы произошла химическая реакция? 1. Необходимо, чтобы реагирующие вещества соприкоснулись и чем
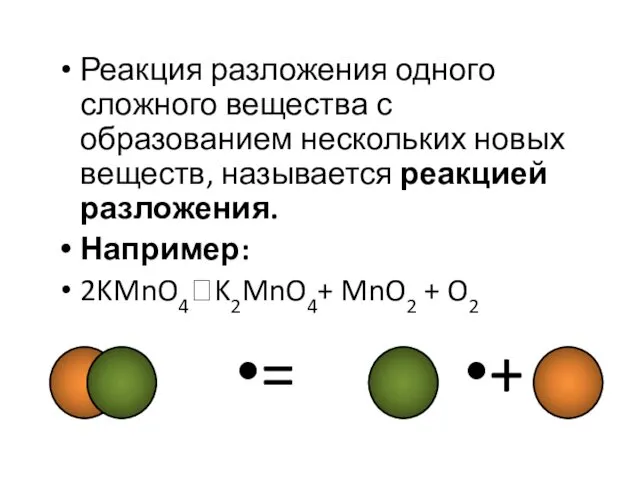
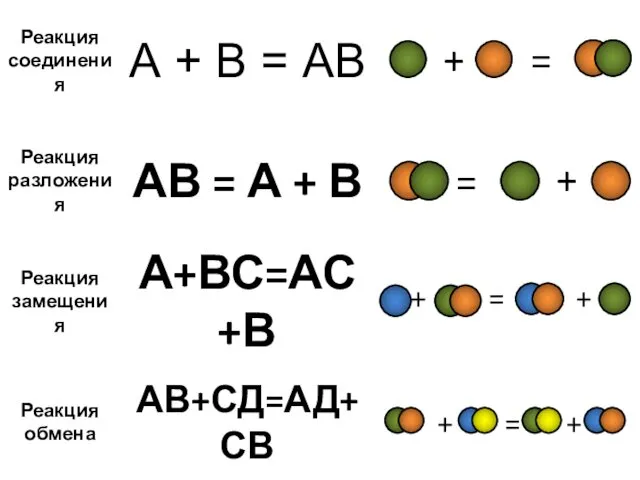
- 7. Реакция разложения одного сложного вещества с образованием нескольких новых веществ, называется реакцией разложения. Например: 2KMnO4?K2MnO4+ MnO2
- 8. Подавляющее большинство реакций разложения эндотермичны и требуют для своего проведения повышенной температуры. Например: HgO – Hg
- 9. 1) CaO + CO2 = CaCO3 2) CO2 + 2NaOH = Na2CO3 + H2O 3) Fe
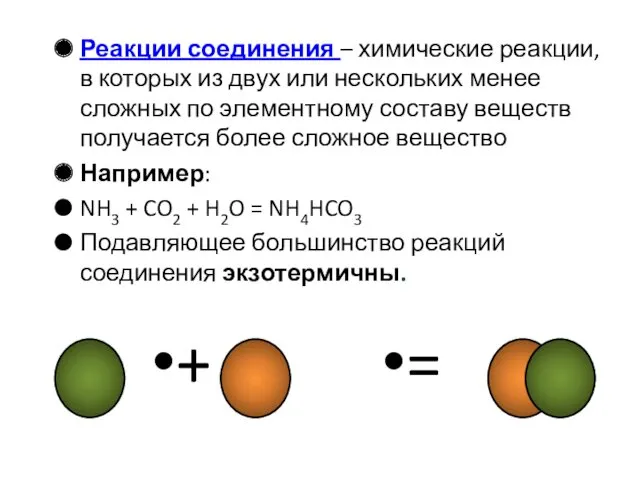
- 10. Реакции соединения – химические реакции, в которых из двух или нескольких менее сложных по элементному составу
- 11. Fe + S - FeS Zn + O2 - ZnO Fe + O2 - Fe2O3 CaO
- 12. 1) 2HgO = 2Hg + O2 2) CaCO3 = CaO + CO2 3) CuSO4 + Fe
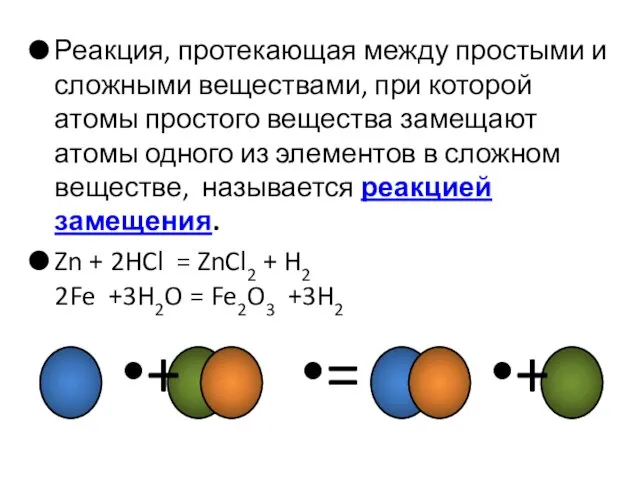
- 13. Реакция, протекающая между простыми и сложными веществами, при которой атомы простого вещества замещают атомы одного из
- 14. Zn + HCl – ZnCl2 + H2 Fe + CuCl2 – FeCl2 + Cu Cu +
- 15. Реакция, протекающая между двумя сложными веществами, при которой атомы или группы атомов одного вещества замещают атомы
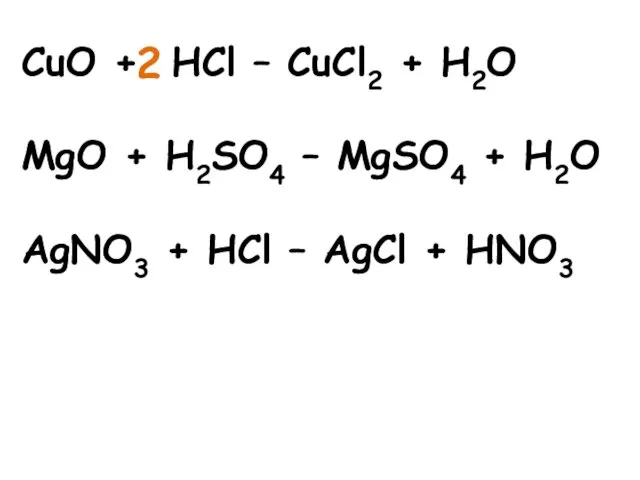
- 16. CuO + HCl – CuCl2 + H2O MgO + H2SO4 – MgSO4 + H2O AgNO3 +
- 18. Домашнее задание Учебник с. 40-41, выполнить упражнения 5-6 (с. 47). Повторить учебный материал о химической формуле
- 19. Домашнее задание: Оформить на альбомном листе работу, где необходимо привести примеры разных типов реакций и нарисовать
- 24. Скачать презентацию







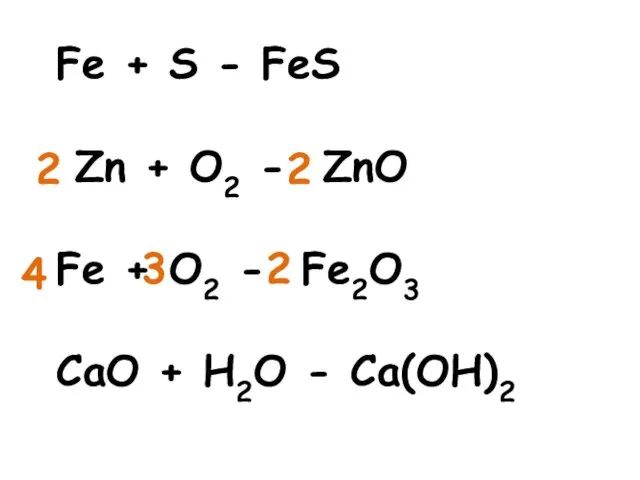

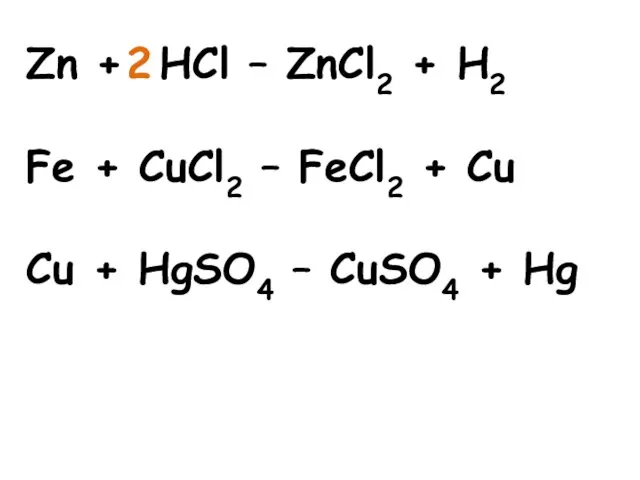






 Дизайн и архитектура. Итоговое тестирование. ИЗО. 7 класс
Дизайн и архитектура. Итоговое тестирование. ИЗО. 7 класс Выбор дверей и проемов для интерьера квартиры
Выбор дверей и проемов для интерьера квартиры Виброзащита оборудования: способы снижения вибрации машин
Виброзащита оборудования: способы снижения вибрации машин Цитаты
Цитаты Урок-презентация.Тема Химия и Первая Мировая война
Урок-презентация.Тема Химия и Первая Мировая война Структура Вселенной
Структура Вселенной Суть і способи процесів різання
Суть і способи процесів різання Урок по теме Боги древних славян 3 класс (Программа Начальная школа XXI века)
Урок по теме Боги древних славян 3 класс (Программа Начальная школа XXI века) Снегурочка Александр Николаевич Островский
Снегурочка Александр Николаевич Островский Электромагнитное излучение и его влияние на здоровье человека
Электромагнитное излучение и его влияние на здоровье человека История становления специальной педагогики в России
История становления специальной педагогики в России Презентация Блокнот
Презентация Блокнот Отстойники. Классификация
Отстойники. Классификация Презентация к проекту: Очистка поверхности медного сплава
Презентация к проекту: Очистка поверхности медного сплава Центральная и Восточная Европа
Центральная и Восточная Европа The last film I saw
The last film I saw Волонтёрское движение
Волонтёрское движение Информация ее хранение и способы передачи (2)
Информация ее хранение и способы передачи (2) Платформы
Платформы Политические и правовые учения древнего мира
Политические и правовые учения древнего мира Фенолы. Классификация фенолов
Фенолы. Классификация фенолов Организация системы контроля доступа и видеонаблюдения в учреждении образования
Организация системы контроля доступа и видеонаблюдения в учреждении образования Правовое регулирование профессиональной медицинской деятельности
Правовое регулирование профессиональной медицинской деятельности Сера. Характеристика химического элемента и простого вещества
Сера. Характеристика химического элемента и простого вещества Поиск, накопление и обработка научной информации
Поиск, накопление и обработка научной информации Проектная деятельностьСказка в нашей жизни
Проектная деятельностьСказка в нашей жизни Япония на пути модернизации
Япония на пути модернизации Презентация Пасхальная тема Диск
Презентация Пасхальная тема Диск