Содержание
- 2. Химические реакции или химические явления – это процессы, в результате которых из одних веществ образуются другие.
- 3. По каким признакам можно определить химические реакции? Выделение газа; Образование осадка; Выделение (поглощение) тепла и света;
- 4. Каковы условия возникновения реакций? Растворение; Измельчение; Смешивание веществ; Нагревание.
- 5. Химические реакции Как классифицировать?
- 6. Реакции соединения 2Аl+ 3I2 = 2 All3 NH3 + HCl = NH4Cl 1.
- 7. Реакции, в которых из нескольких простых или сложных веществ образуется одно более сложное вещество, наз. реакциями
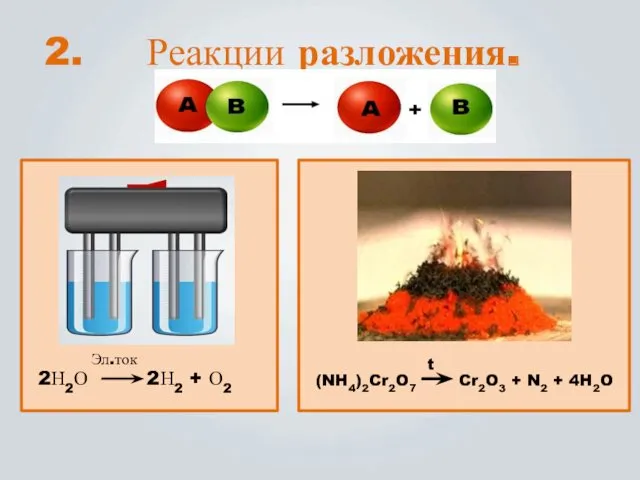
- 8. Реакции разложения. (NH4)2Cr2O7 Cr2O3 + N2 + 4H2O t 2Н2О 2Н2 + О2 Эл.ток 2.
- 9. Реакции, в которых из одного сложного вещества получается два или несколько простых или сложных веществ, наз.
- 10. Реакции замещения. SnCl2 + Zn = ZnCl2 + Sn H2SO4 + Zn = ZnSO4 + H2↑
- 11. Реакции, протекающие между простыми и сложными веществами, при которых атомы простого вещества замещают атомы одного из
- 12. Реакции обмена. Pb(NO3)2 +2KI = PbI2↓+2KNO3 2 NaOH + H2SO4 = Na2SO4 + 2H2O 4.
- 13. Реакции, происходящие между сложными веществами, в результате которых они меняются своими составными частями, наз. реакциями обмена.
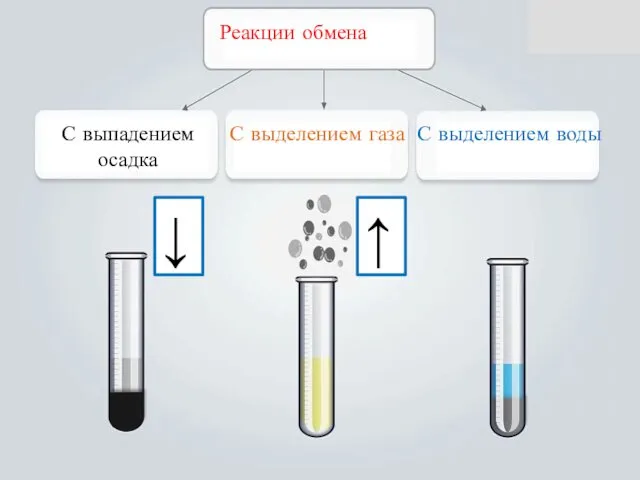
- 14. Реакции обмена С выпадением осадка С выделением газа С выделением воды ↓ ↑
- 15. Реакции обмена в растворах электролитов протекают в тех случаях, когда: 1. Образуется осадок. AgNO3 + NaCl
- 16. 2. Образуется газ (или легколетучие вещества). Na2S + H2SO4 = Na2SO4 + H2S↑ молекулярное уравнение реакции
- 17. 3. Образуется слабый электролит (малодиссоциирующее соединение). NaOH + HCl = NaCl + H2O молекулярное уравнение реакции
- 18. В том случае, если образующиеся вещества - сильные электролиты, хорошо растворимые в воде и полностью диссоциирующие
- 20. Скачать презентацию















 Забайкальский край
Забайкальский край Познавательное развитие дошкольников с задержкой психического развития
Познавательное развитие дошкольников с задержкой психического развития Зрительный анализатор. Подготовка к ЕГЭ
Зрительный анализатор. Подготовка к ЕГЭ Протон и нейтрон. Строение ядра
Протон и нейтрон. Строение ядра Педагогическая технология формирования культурно-гигиенических навыков
Педагогическая технология формирования культурно-гигиенических навыков Классный час Спорт-против наркотиков
Классный час Спорт-против наркотиков ЭП2Д. Схема электрическая силовая
ЭП2Д. Схема электрическая силовая English school
English school Сборка игрушки из помпонов
Сборка игрушки из помпонов Стратегия развития туризма в РФ
Стратегия развития туризма в РФ Основы проектирования и оборудования предприятий тонкого органического синтеза
Основы проектирования и оборудования предприятий тонкого органического синтеза Инструменты графического редактора Paint в Windows 7
Инструменты графического редактора Paint в Windows 7 20230904_prof
20230904_prof Развивающая среда в группе детей третьего года жизни
Развивающая среда в группе детей третьего года жизни Трубчатые печи. Классификация и принцип работы трубчатых печей
Трубчатые печи. Классификация и принцип работы трубчатых печей Forums_INGOs
Forums_INGOs Кровь. Состав и функции ДО
Кровь. Состав и функции ДО Ювелирное дело
Ювелирное дело Перечень и комплектность документов на ИС согласно ЕСПД и ЕСКД. Понятия и задачи документирования
Перечень и комплектность документов на ИС согласно ЕСПД и ЕСКД. Понятия и задачи документирования Возникновение государственности у славян. Образование древнерусского государства
Возникновение государственности у славян. Образование древнерусского государства Гидравлическое сопротивление в трубопроводах
Гидравлическое сопротивление в трубопроводах Дисграфия.Коррекция и предупреждение.
Дисграфия.Коррекция и предупреждение. Консерві кәсіпорнының өндірістік қуаты және жұмыс істеу режимі
Консерві кәсіпорнының өндірістік қуаты және жұмыс істеу режимі Арон Ралстон
Арон Ралстон Народная кукла, как средство приобщения детей дошкольного возраста к русской традиционной культуре
Народная кукла, как средство приобщения детей дошкольного возраста к русской традиционной культуре Артикуляционная гимнастика для постановке шипящих звуков.
Артикуляционная гимнастика для постановке шипящих звуков. Игорь Васильев. Первые 50 лет
Игорь Васильев. Первые 50 лет Федеральный проект Цифровая культура
Федеральный проект Цифровая культура