Содержание
- 2. Для этого необходимо выполнить составить уравнения реакций в молекулярном виде Определить степень окисления элементов В реакциях,
- 3. Составим молекулярные уравнения реакций 2Cu + O2 2CuO CuO + 2HCl CuCl2 + H2O
- 4. Определим степень окисления элементов 2Cu0 + O20 2Cu+2O-2 Cu +2 O-2 + 2H+Cl- Cu+2Cl2-1 +
- 5. Степень окисления элементов изменилась только в первой реакции 2Cu0 + O20 2Cu+2O-2 Определим переход электронов Найдем
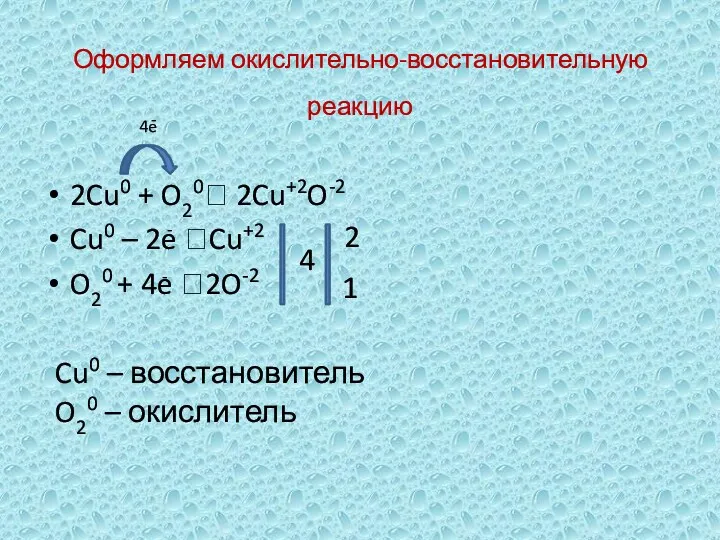
- 6. Оформляем окислительно-восстановительную реакцию 2Cu0 + O20 2Cu+2O-2 Cu0 – 2e Cu+2 O20 + 4e 2O-2 4
- 7. Составляем полные ионные уравнения CuO + 2H+ + 2Сl - Cu+2 + 2Cl - +
- 8. Составляем краткие ионные уравнения CuO + 2H+ Cu+2 + H2O Cu+2 + 2OH - Cu(OH)2
- 10. Скачать презентацию






 Нефть
Нефть Инновационные технологии в обучении географии
Инновационные технологии в обучении географии Компримирование углеводородных газов
Компримирование углеводородных газов Особенности управления персоналом в проектной деятельности
Особенности управления персоналом в проектной деятельности Технология дистанционного обучения
Технология дистанционного обучения Координационные (комплексные) соединения
Координационные (комплексные) соединения Разработка проекта на тему 10 заповедь библии - НЕ ЗАВИДУЙ
Разработка проекта на тему 10 заповедь библии - НЕ ЗАВИДУЙ Development of transportation
Development of transportation Перспективное развитие гидроэнергетики России
Перспективное развитие гидроэнергетики России Кабинет начальных классов
Кабинет начальных классов Первобытное общество. 5 класс
Первобытное общество. 5 класс Неравенства и системы неравенств с двумя переменными
Неравенства и системы неравенств с двумя переменными Cannabis Cultivation
Cannabis Cultivation Фрагмент текста. Операции над фрагментами
Фрагмент текста. Операции над фрагментами Процесуальний порядок проведення технічної інвентаризації об’єктів нерухомого майна (Тема 4)
Процесуальний порядок проведення технічної інвентаризації об’єктів нерухомого майна (Тема 4) Многоуровневый курс практической грамматики и орфографии английского языка для детей ‘Jolly Grammar?’
Многоуровневый курс практической грамматики и орфографии английского языка для детей ‘Jolly Grammar?’ Государственные символы Республики Татарстан
Государственные символы Республики Татарстан Различаем звуки! Ш-С
Различаем звуки! Ш-С Решение кейсов
Решение кейсов Все народы воспевает красоту родного края. Пейзаж в картинах художников Осетии
Все народы воспевает красоту родного края. Пейзаж в картинах художников Осетии Язык – это путь к цивилизации и культуре
Язык – это путь к цивилизации и культуре ЕГЭ по литературе. Подготовка к заданию 9 (С2): сопоставление произведений
ЕГЭ по литературе. Подготовка к заданию 9 (С2): сопоставление произведений Бетонные и железобетонные изделия для зданий и сооружений
Бетонные и железобетонные изделия для зданий и сооружений Д.Н. Мамин-Сибиряк Сказка про Воробей Воробеича, Ерша Ершовича и весёлого трубочиста Яшу
Д.Н. Мамин-Сибиряк Сказка про Воробей Воробеича, Ерша Ершовича и весёлого трубочиста Яшу Регулирование угловой скорости асинхронных двигателй
Регулирование угловой скорости асинхронных двигателй Организация прогулок для детей раннего возраста в условиях Крайнего Севера
Организация прогулок для детей раннего возраста в условиях Крайнего Севера G`alamat online school
G`alamat online school Європейські інтеграційні процеси
Європейські інтеграційні процеси