Содержание
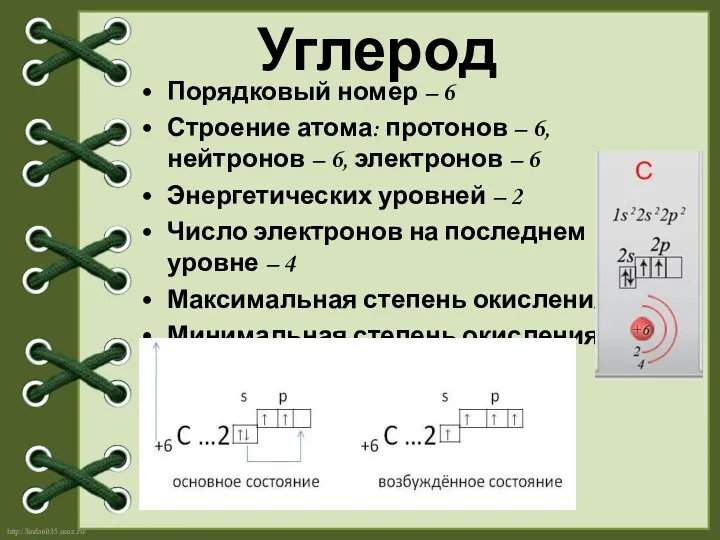
- 2. Порядковый номер – 6 Строение атома: протонов – 6, нейтронов – 6, электронов – 6 Энергетических
- 3. Нахождение в природе Углерод занимает 17-е место по распространенности в земной коре – 0,048%. Но несмотря
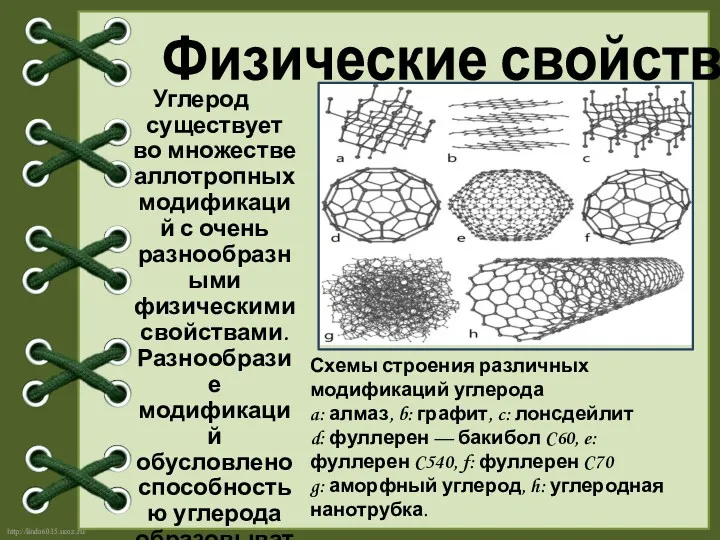
- 4. Углерод существует во множестве аллотропных модификаций с очень разнообразными физическими свойствами. Разнообразие модификаций обусловлено способностью углерода
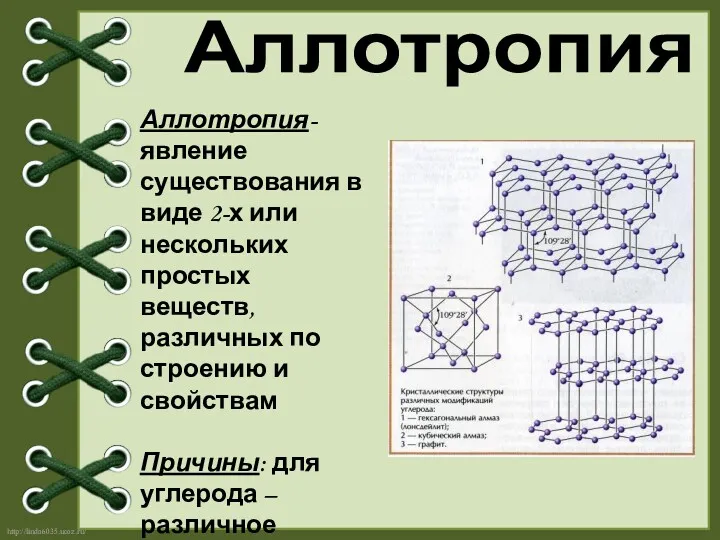
- 5. Аллотропия Аллотропия- явление существования в виде 2-х или нескольких простых веществ, различных по строению и свойствам
- 6. Алмаз - прозрачное, бесцветное вещество обладает твердостью, превосходящей твердость всех известных в природе веществ. Плотность алмаза
- 7. Графит Графит – устойчивая при нормальных условиях аллотропная модификация углерода, имеет серо-черный цвет и металлический блеск,
- 8. Карбин Карбин имеет кристаллическую структуру, в которой атомы углерода соединены чередующимися одинарными и тройными связями. Он
- 9. Фуллерены В противоположность графиту и алмазу, структура которых представляет собой периодическую решетку атомов, еще одна форма
- 10. Аморфный углерод Сорта: 1. Сажа – используется для изготовления типографской краски, картриджей, резины, косметической туши и
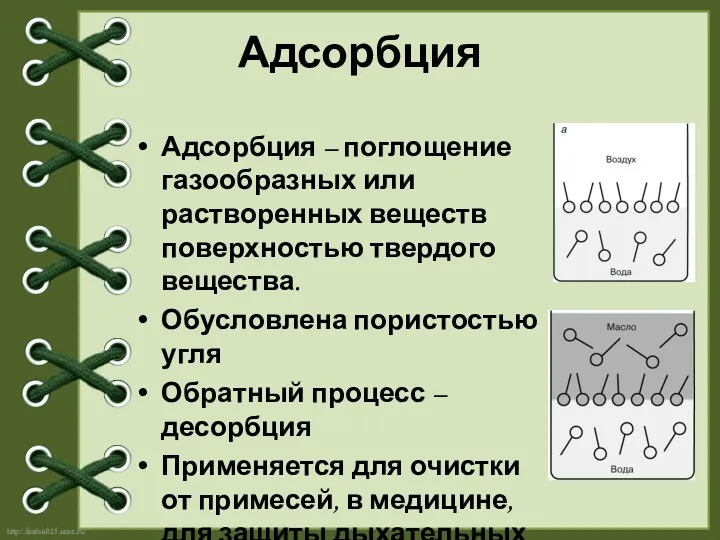
- 11. Адсорбция Адсорбция – поглощение газообразных или растворенных веществ поверхностью твердого вещества. Обусловлена пористостью угля Обратный процесс
- 12. При обычных температурах углерод химически инертен, при достаточно высоких соединяется со многими элементами, проявляет сильные восстановительные
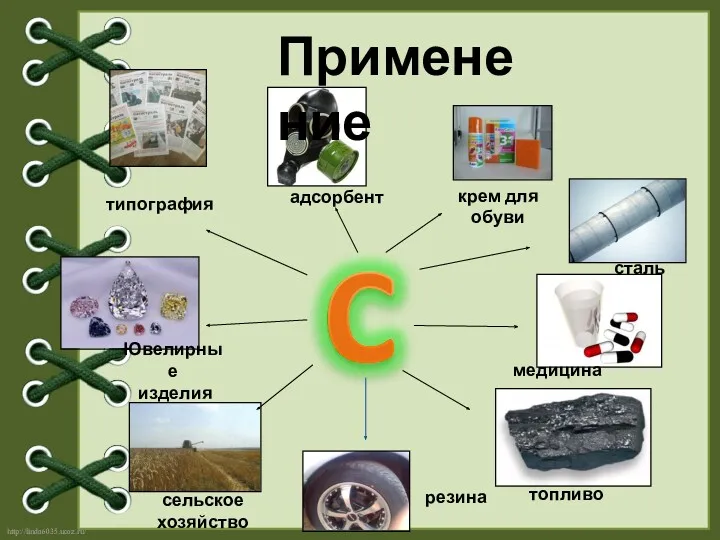
- 13. сталь сельское хозяйство топливо медицина типография Ювелирные изделия адсорбент резина крем для обуви Применение
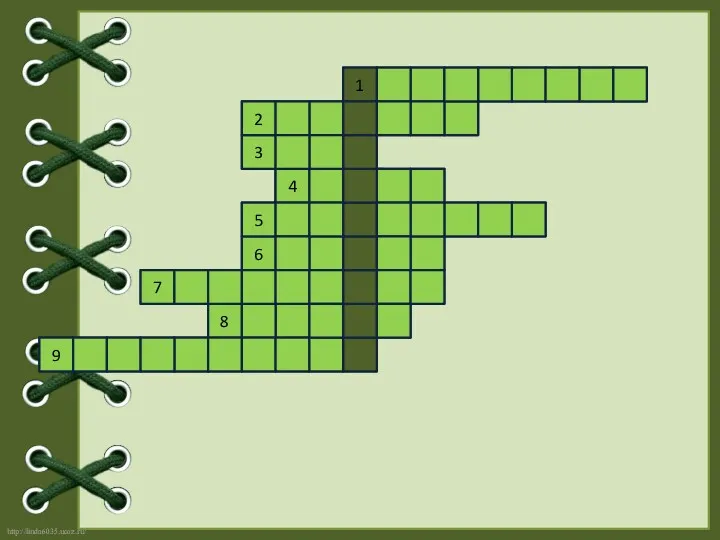
- 15. Заполните кроссворд, отгадав ключевое слово, означающее процесс выделения различных веществ поверхностью угля. Явление, преломления лучей в
- 16. у г л д о р е д и ф р а к ц и я
- 17. Т е с т 1. Конфигурация внешнего электронного уровня элементов подгруппы углерода: а) ns2np2 б) ns2np3
- 19. Скачать презентацию









 20230913_obshchenie_
20230913_obshchenie_ Управление ликвидностью и платежеспособностью банка
Управление ликвидностью и платежеспособностью банка Презентация портфолио учителя начальных классов
Презентация портфолио учителя начальных классов Rezhimy_raboty_zalezhey_080211
Rezhimy_raboty_zalezhey_080211 Anticholinergic drugs and drugs acting on autonomic ganglia
Anticholinergic drugs and drugs acting on autonomic ganglia Проект Моё имя
Проект Моё имя Выбор лечебно-диагностического алгоритма при заболеваниях органов билиопанкреатодуоденальной зоны
Выбор лечебно-диагностического алгоритма при заболеваниях органов билиопанкреатодуоденальной зоны Интенсивная технология производства зерновых и бобовых культур
Интенсивная технология производства зерновых и бобовых культур Презентация Сказка о жабе и розе Диск
Презентация Сказка о жабе и розе Диск Дмитрий Сергеевич Мережковский (1865-1941)
Дмитрий Сергеевич Мережковский (1865-1941) Комнатное цветоводство. Орхидея
Комнатное цветоводство. Орхидея Развлечение группы Кроха 8 Марта. В гости к нам пришла матрешка
Развлечение группы Кроха 8 Марта. В гости к нам пришла матрешка проект по музыкально - дидактическим играм
проект по музыкально - дидактическим играм Техническое обслуживание и ремонт автомобильного транспорта
Техническое обслуживание и ремонт автомобильного транспорта Подагра. Клиника, варианты течения подагры
Подагра. Клиника, варианты течения подагры Вопросы гендерного воспитания в условиях современного ДОУ.
Вопросы гендерного воспитания в условиях современного ДОУ. Презентация Актуальность метода проектов в начальной школе
Презентация Актуальность метода проектов в начальной школе Материалы для родительского собрания о законе об образовании
Материалы для родительского собрания о законе об образовании Внутренняя секреция. Гормоны. Адаптационный синдром
Внутренняя секреция. Гормоны. Адаптационный синдром Композиция и приемы построения очерка: соотношение понятий. Лекция 3
Композиция и приемы построения очерка: соотношение понятий. Лекция 3 Презентация к родительскому собранию Детская агрессия
Презентация к родительскому собранию Детская агрессия Present continuous
Present continuous Решение рациональных уравнений. Линейных, дробно-линейных, дробно-рациональных, квадратных
Решение рациональных уравнений. Линейных, дробно-линейных, дробно-рациональных, квадратных Презентация 3
Презентация 3 Международные сравнительные исследования и Украина
Международные сравнительные исследования и Украина Понятие цифровых электронных схем. Классификация и определения
Понятие цифровых электронных схем. Классификация и определения Термическая обработка сталей
Термическая обработка сталей Қазақстанда әлеуметтік маңызы бар аурулар. Аса қауіпті инфекциялар
Қазақстанда әлеуметтік маңызы бар аурулар. Аса қауіпті инфекциялар