Содержание
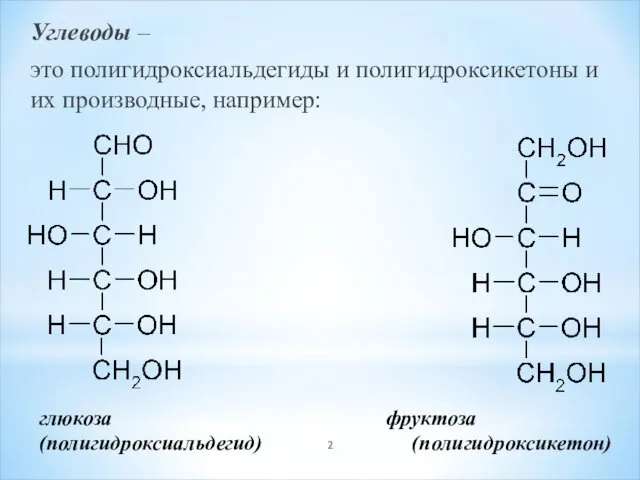
- 2. Углеводы – это полигидроксиальдегиды и полигидроксикетоны и их производные, например: глюкоза фруктоза (полигидроксиальдегид) (полигидроксикетон)
- 3. Общая формула простых моносахаридов может быть представлена как Cn(H2O)m, где m и n >= 3 Молекулярная
- 4. Классификация углеводов Моносахариды (простые сахара, например, глюкоза) Олигосахариды (углеводы, содержащие 2-10 остатков моносахаридов, например сахароза) Полисахариды
- 5. Моносахариды Моносахариды – простейшие углеводы, не гидролизующиеся на более простые углеводы Классификация моносахаридов a) по числу
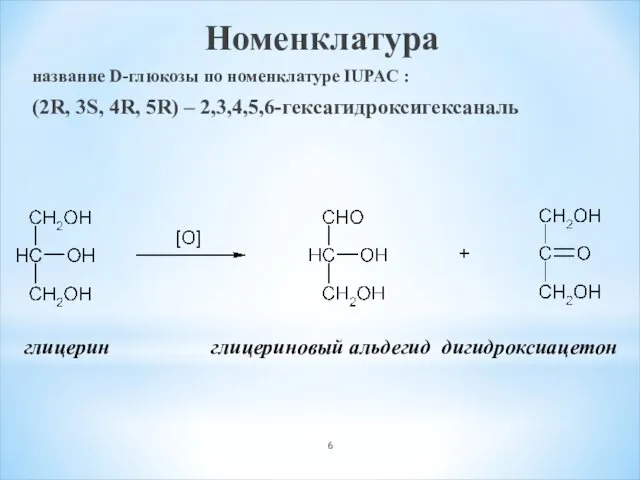
- 6. Номенклатура название D-глюкозы по номенклатуре IUPAC : (2R, 3S, 4R, 5R) – 2,3,4,5,6-гексагидроксигексаналь глицерин глицериновый альдегид
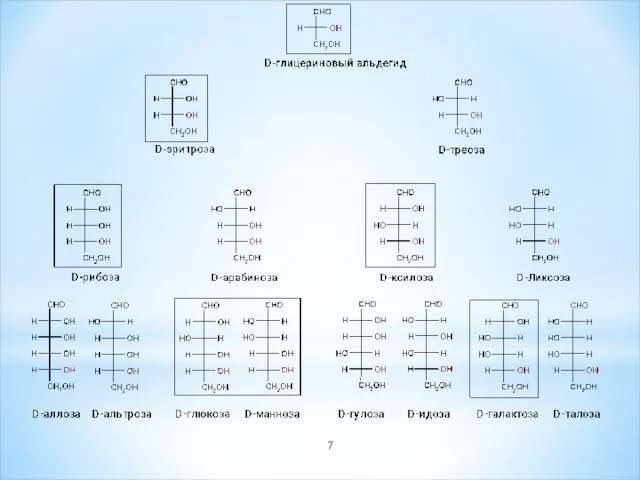
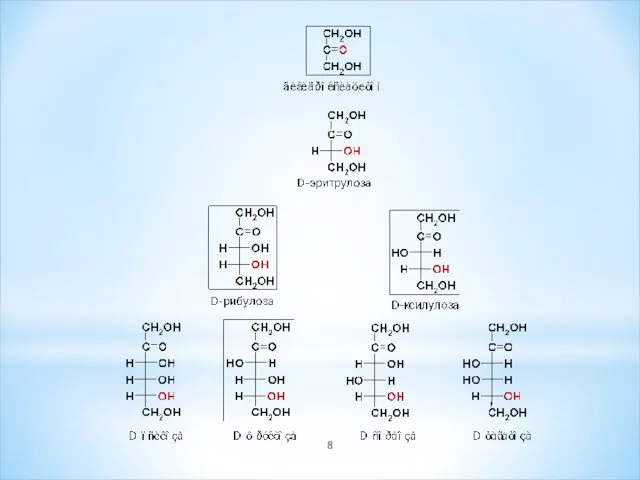
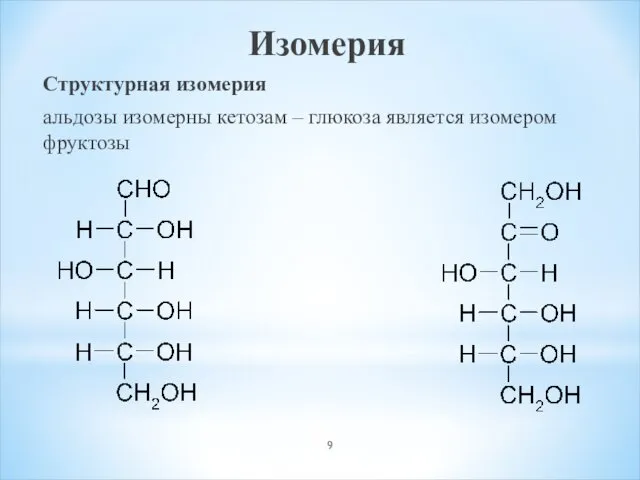
- 9. Изомерия Структурная изомерия альдозы изомерны кетозам – глюкоза является изомером фруктозы
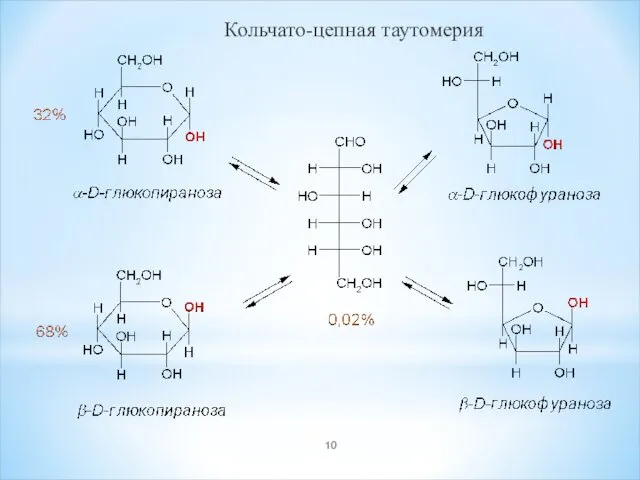
- 10. Кольчато-цепная таутомерия
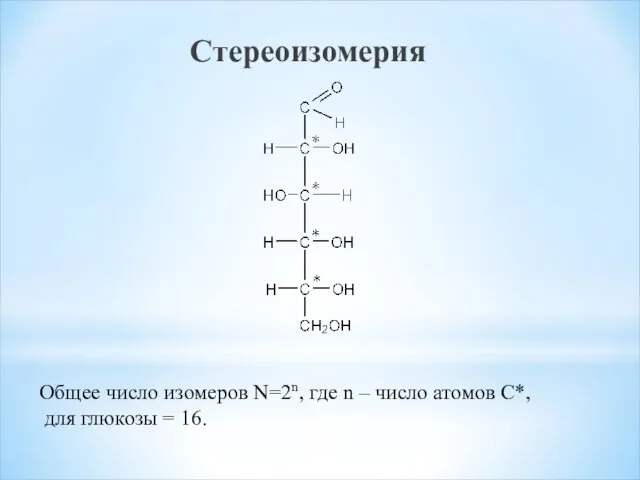
- 11. Стереоизомерия Общее число изомеров N=2n, где n – число атомов С*, для глюкозы = 16.
- 12. Энантиомерия
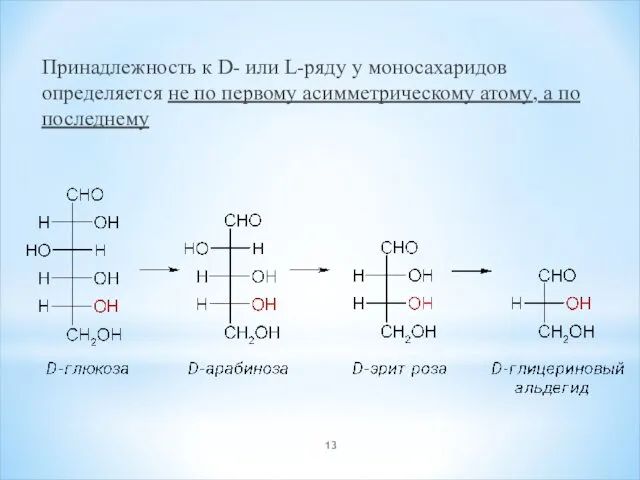
- 13. Принадлежность к D- или L-ряду у моносахаридов определяется не по первому асимметрическому атому, а по последнему
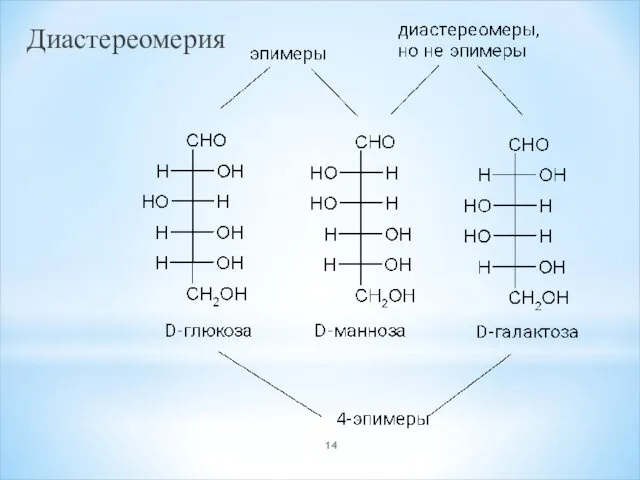
- 14. Диастереомерия
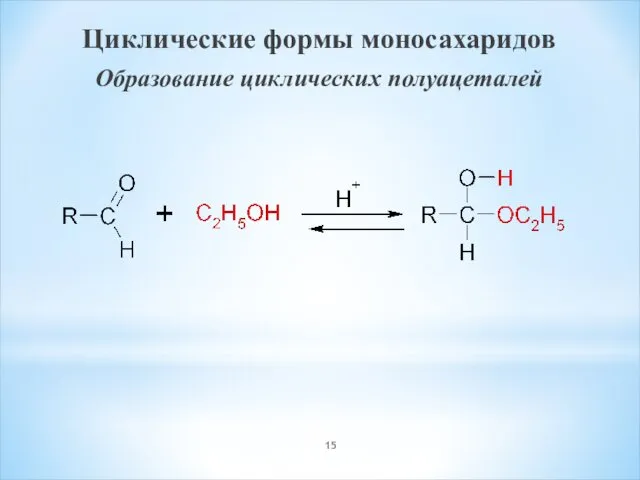
- 15. Циклические формы моносахаридов Образование циклических полуацеталей
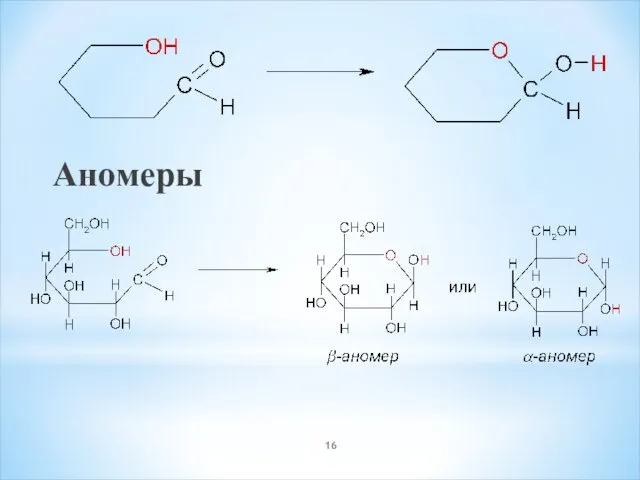
- 16. Аномеры
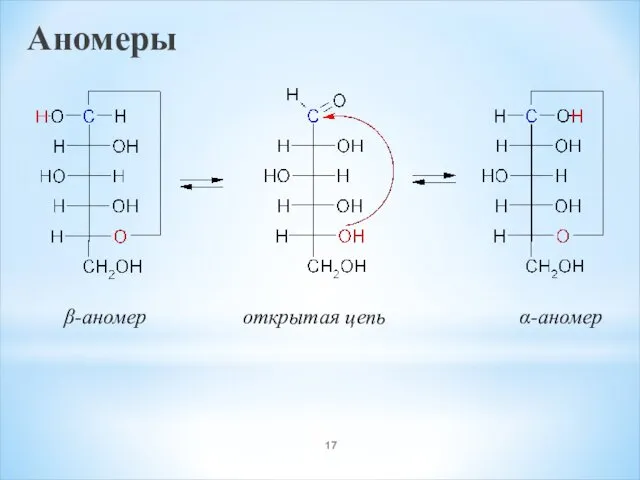
- 17. Аномеры β-аномер открытая цепь α-аномер
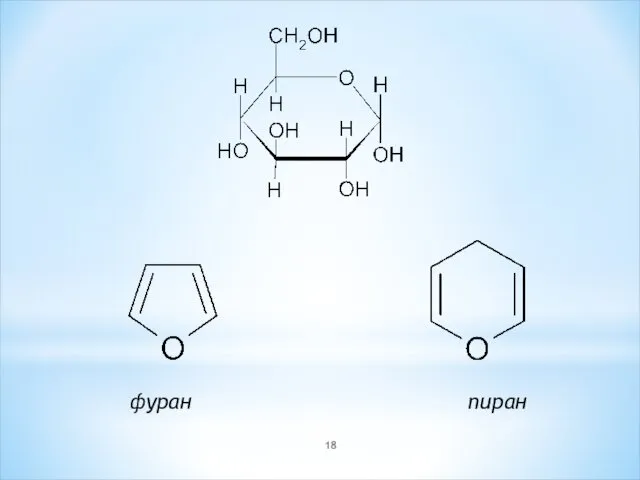
- 18. фуран пиран
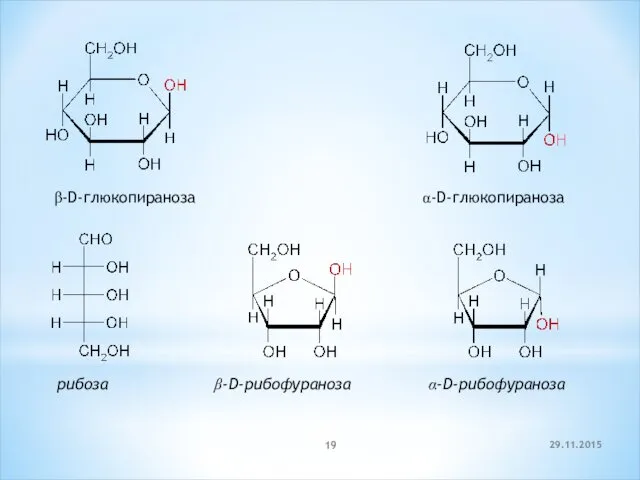
- 19. 29.11.2015 β-D-глюкопираноза α-D-глюкопираноза рибоза β-D-рибофураноза α-D-рибофураноза
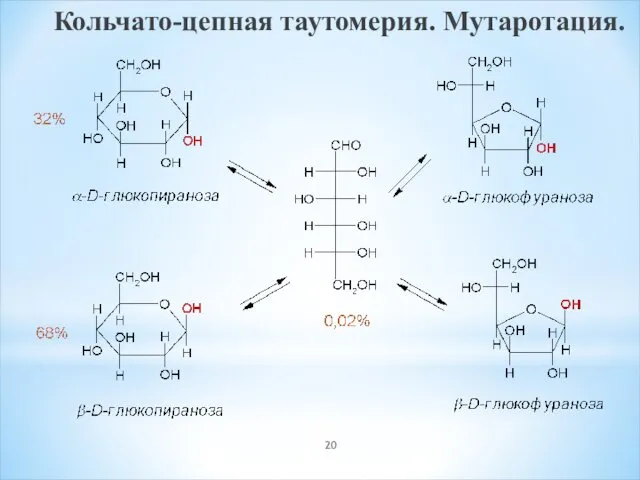
- 20. Кольчато-цепная таутомерия. Мутаротация.
- 21. Кольчато-цепная таутомерия сопровождается закономерным явлением – мутаротацией. Мутаротация (лат. mutare – изменять, rotatio – вращение) в
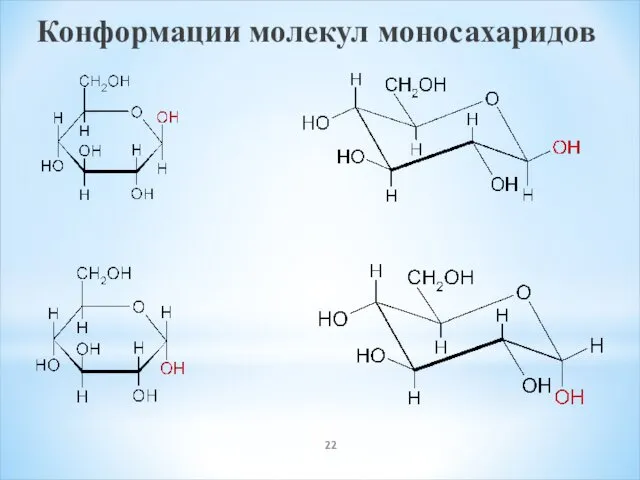
- 22. Конформации молекул моносахаридов
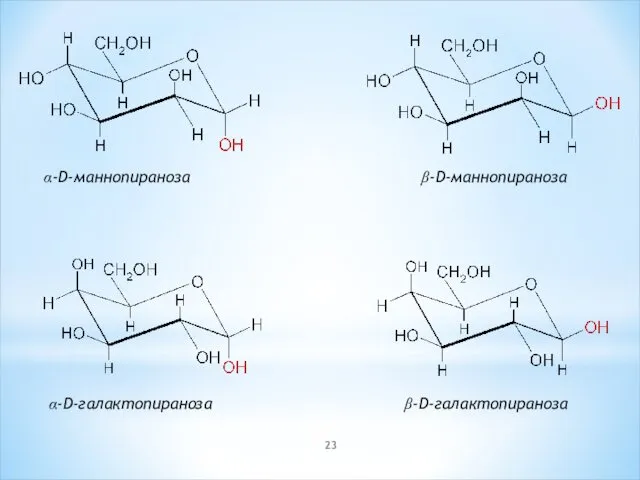
- 23. α-D-маннопираноза β-D-маннопираноза α-D-галактопираноза β-D-галактопираноза
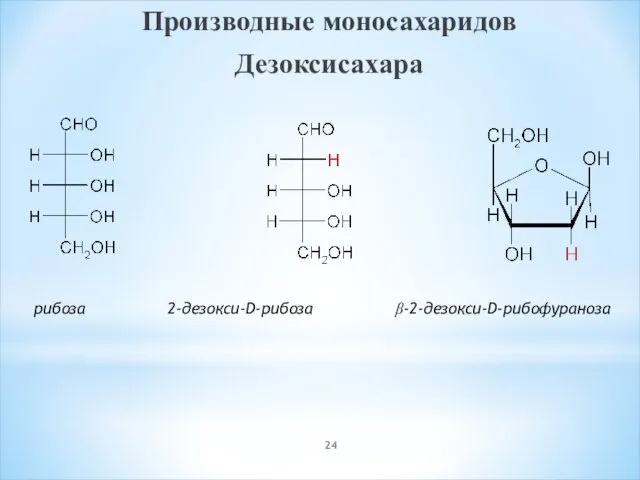
- 24. Производные моносахаридов Дезоксисахара рибоза 2-дезокси-D-рибоза β-2-дезокси-D-рибофураноза
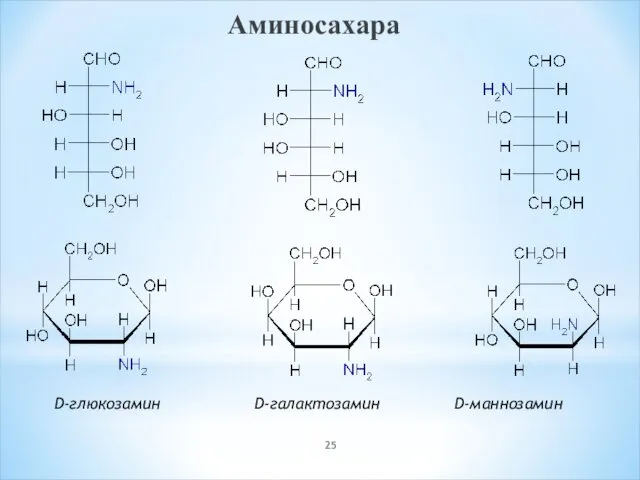
- 25. Аминосахара D-глюкозамин D-галактозамин D-маннозамин
- 26. Физические свойства Моносахариды представляют собой бесцветные кристаллические вещества очень хорошо растворимые в воде. Моносахариды трудно растворяются
- 27. Биологические свойства и значение Метаболическое значение и энергетическая функция Структурная функция Сладкий вкус
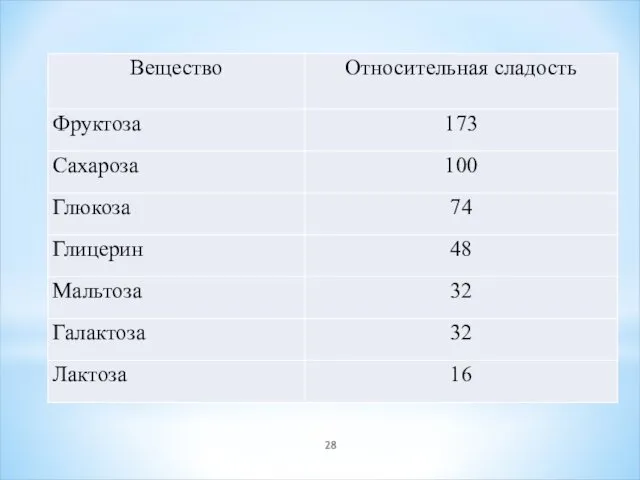
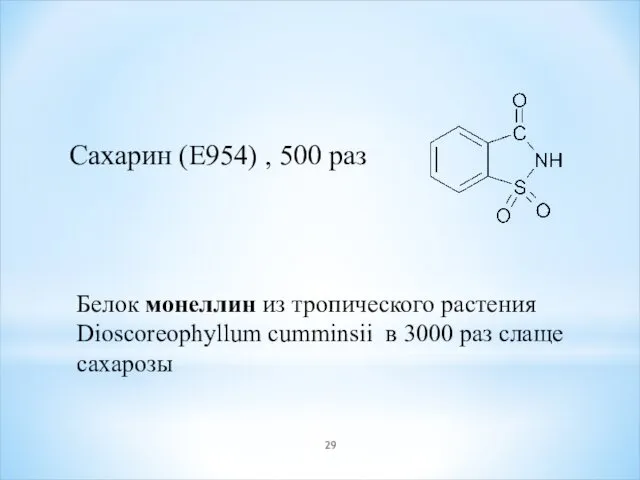
- 29. Сахарин (E954) , 500 раз Белок монеллин из тропического растения Dioscoreophyllum cumminsii в 3000 раз слаще
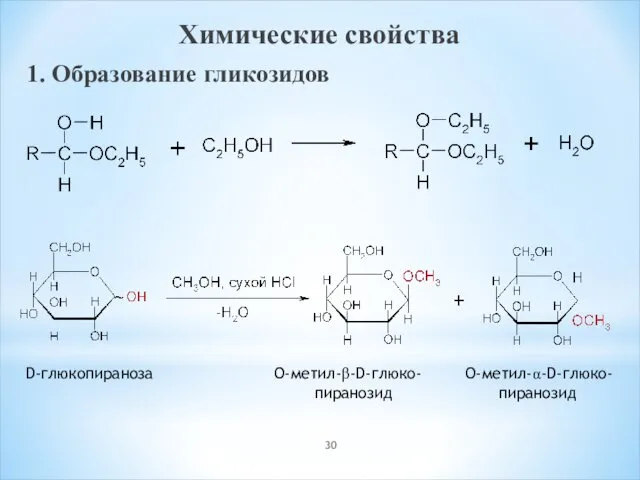
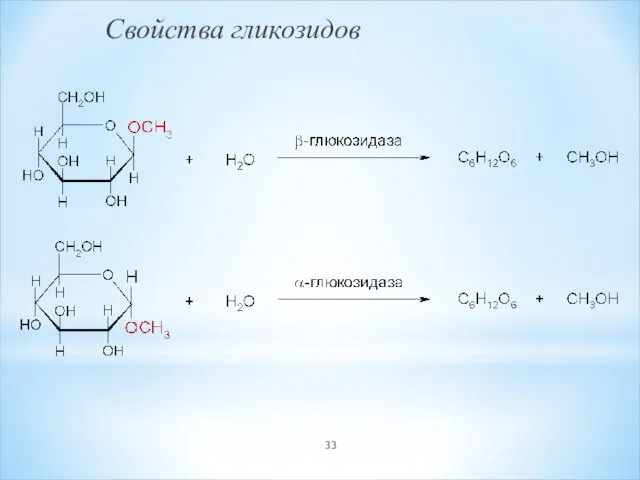
- 30. Химические свойства 1. Образование гликозидов D-глюкопираноза O-метил-β-D-глюко- O-метил-α-D-глюко- пиранозид пиранозид
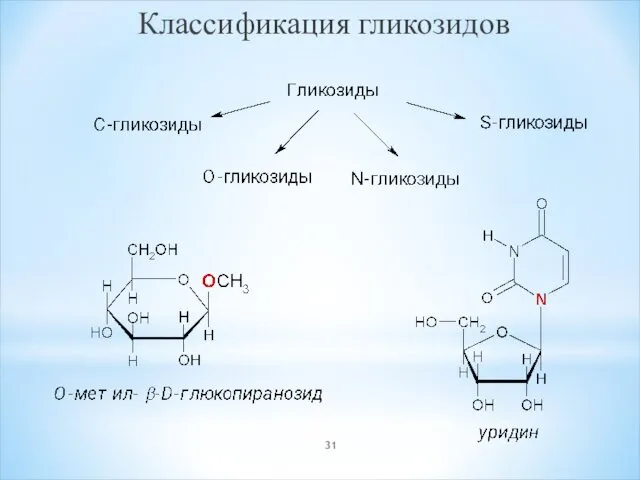
- 31. Классификация гликозидов
- 33. Свойства гликозидов
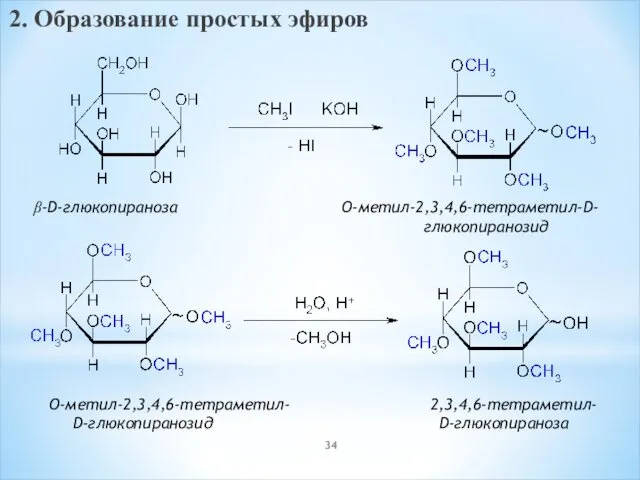
- 34. 2. Образование простых эфиров β-D-глюкопираноза O-метил-2,3,4,6-тетраметил-D- глюкопиранозид O-метил-2,3,4,6-тетраметил- 2,3,4,6-тетраметил- D-глюкопиранозид D-глюкопираноза
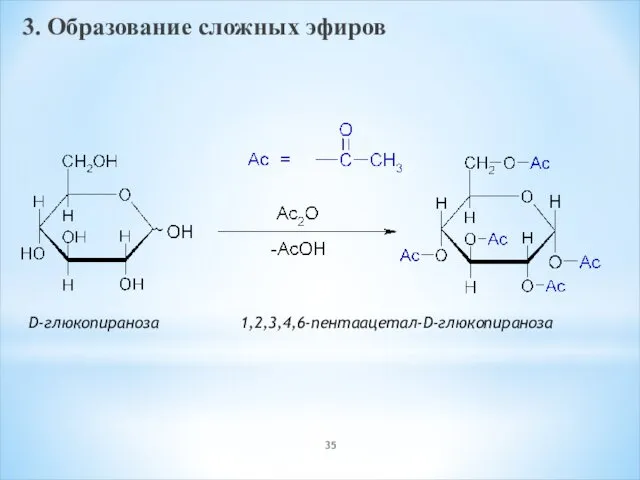
- 35. 3. Образование сложных эфиров D-глюкопираноза 1,2,3,4,6-пентаацетал-D-глюкопираноза
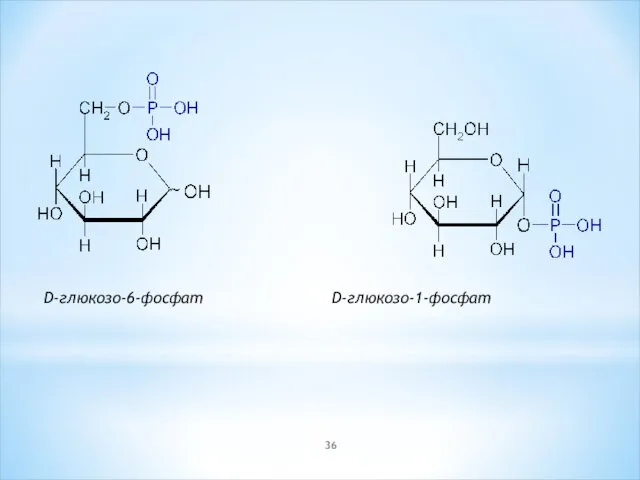
- 36. D-глюкозо-6-фосфат D-глюкозо-1-фосфат
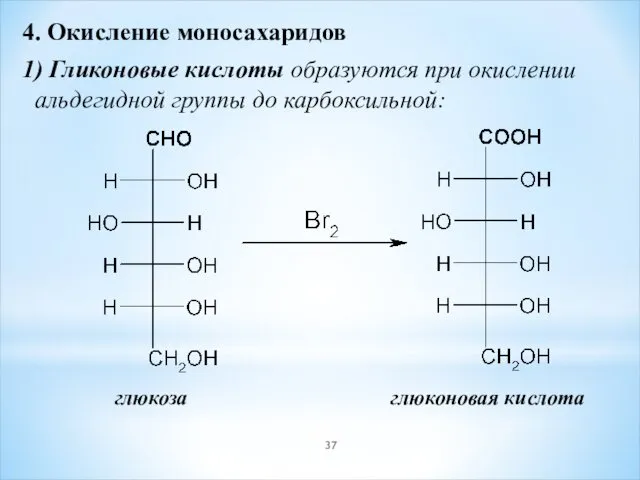
- 37. 4. Окисление моносахаридов 1) Гликоновые кислоты образуются при окислении альдегидной группы до карбоксильной: глюкоза глюконовая кислота
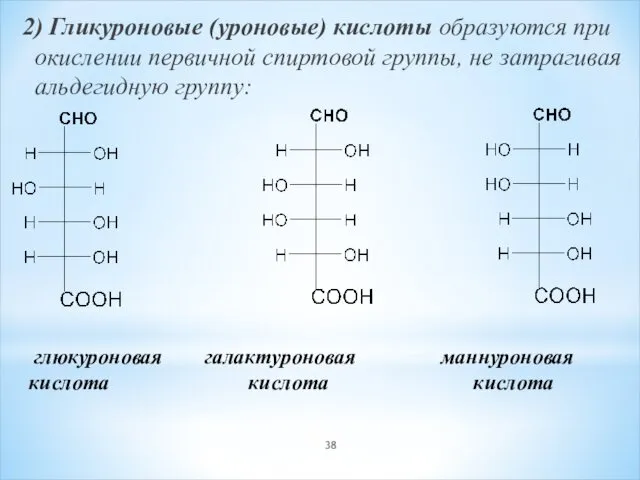
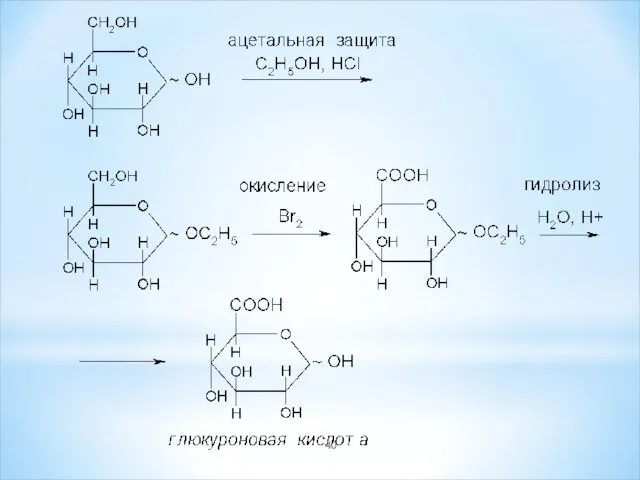
- 38. 2) Гликуроновые (уроновые) кислоты образуются при окислении первичной спиртовой группы, не затрагивая альдегидную группу: глюкуроновая галактуроновая
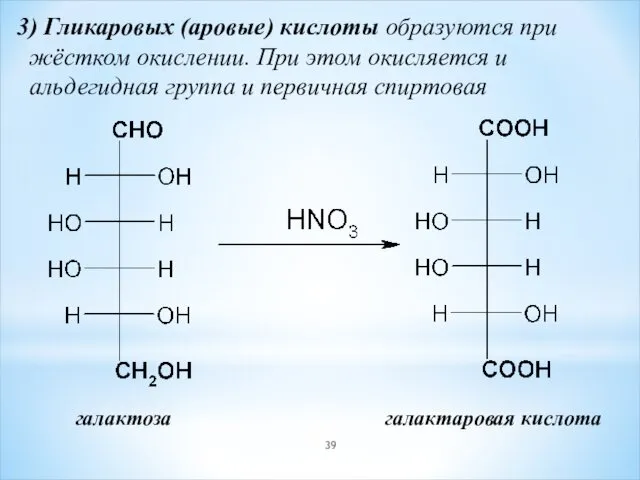
- 39. 3) Гликаровых (аровые) кислоты образуются при жёстком окислении. При этом окисляется и альдегидная группа и первичная
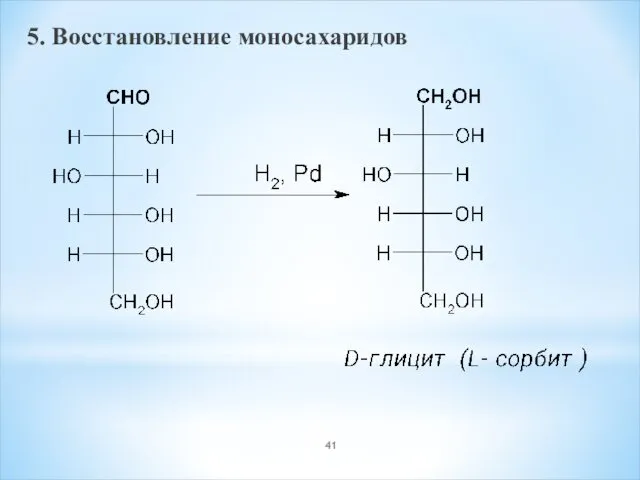
- 41. 5. Восстановление моносахаридов
- 42. Ксилоза → ксилит (E967) Манноза → маннит Глюкоза → глицит(сорбит) E420
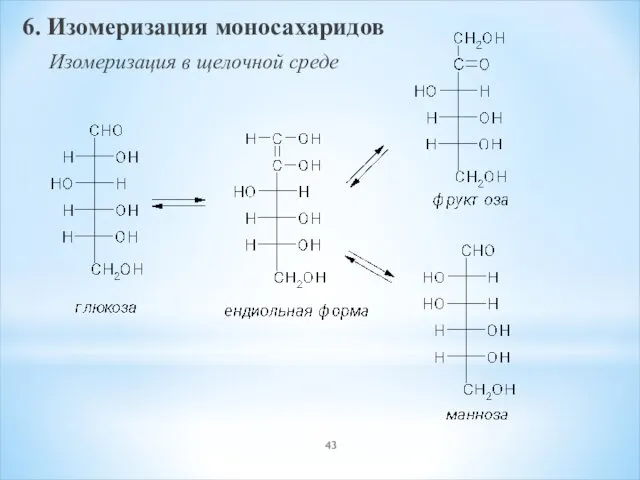
- 43. 6. Изомеризация моносахаридов Изомеризация в щелочной среде
- 44. Получение моносахаридов 1) Природные источники 6 CO2 + 6 H2O → C6H12O6 + 6 O2 http://ru.wikipedia.org/wiki/%D0%A4%D0%B0%D0%B9%D0%BB:Plagiomnium_affine_laminazellen.jpeg
- 45. 2) Гидролиз дисахаридов, олигосахаридов и полисахаридов: Сахароза + H2O → глюкоза + фруктоза Мальтоза + H2O
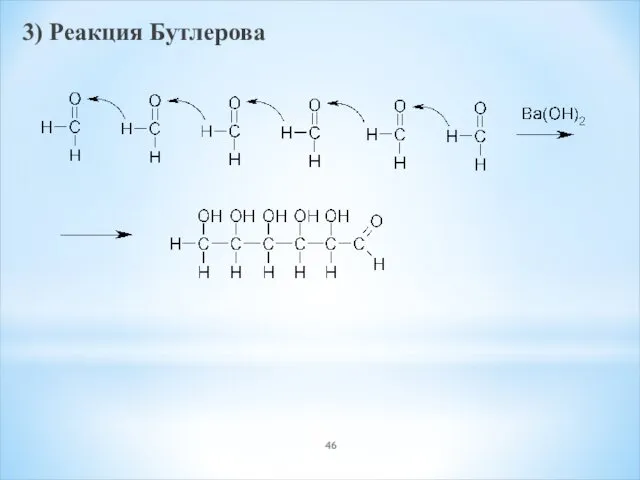
- 46. 3) Реакция Бутлерова
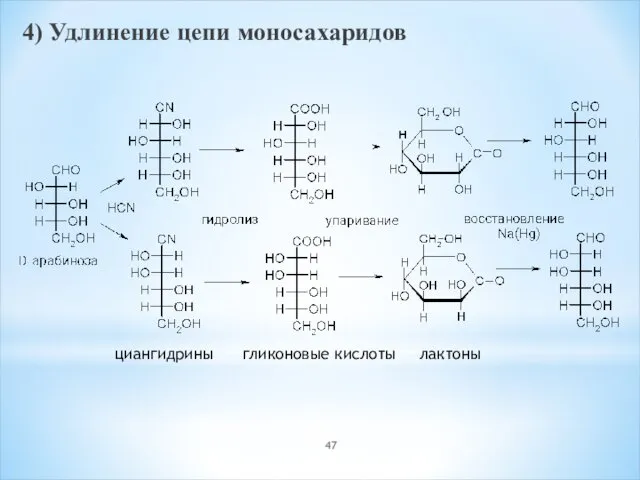
- 47. 4) Удлинение цепи моносахаридов циангидрины гликоновые кислоты лактоны
- 49. Скачать презентацию










 Изменения в порядок проведения обязательных медицинских осмотров,
Изменения в порядок проведения обязательных медицинских осмотров, Конструкция корпуса. Прочность
Конструкция корпуса. Прочность Проблема общественного прогресса
Проблема общественного прогресса prezentatsia
prezentatsia Столярные соединения деталей. Шиповые столярные соединения. Разметка и изготовление шипов и проушин
Столярные соединения деталей. Шиповые столярные соединения. Разметка и изготовление шипов и проушин Жёлтый цвет
Жёлтый цвет Презентация Декупаж разделочной доски
Презентация Декупаж разделочной доски Схема устройства и принцип действия центробежного насоса
Схема устройства и принцип действия центробежного насоса Предраковые заболевания матки
Предраковые заболевания матки Развивающая предметно-пространственная среда во второй младшей группе Диск
Развивающая предметно-пространственная среда во второй младшей группе Диск Региональная научно-техническая конференция молодых специалистов ОАО УДМУРТНЕФТЬ
Региональная научно-техническая конференция молодых специалистов ОАО УДМУРТНЕФТЬ Итоговое родительское собрание в 4Б классе.2012 -2013 уч.год.Презентация.
Итоговое родительское собрание в 4Б классе.2012 -2013 уч.год.Презентация. Arduino. Представители семейства
Arduino. Представители семейства Обустройство и озеленение детской зоны в парке
Обустройство и озеленение детской зоны в парке Виртуальная экскурсия в Эрмитаж. 6А класс
Виртуальная экскурсия в Эрмитаж. 6А класс Презентация к консультации с воспитателями Темперамент
Презентация к консультации с воспитателями Темперамент Economics and Economy
Economics and Economy Круглые черви
Круглые черви Attractions in Scotland
Attractions in Scotland Проект Соуправление в классном коллективе как условие успешной социализации школьников
Проект Соуправление в классном коллективе как условие успешной социализации школьников Разработка Веб - сайта Интернет- провайдера
Разработка Веб - сайта Интернет- провайдера Архитектурные конструкции общественных зданий (часть 2 - структура как архитектура)
Архитектурные конструкции общественных зданий (часть 2 - структура как архитектура) Презентация Нам на улице не страшно
Презентация Нам на улице не страшно Количество вещества. Молярная масса
Количество вещества. Молярная масса DSC-928 switcher
DSC-928 switcher Формирование знаний по пожарной безопасности у детей старшего дршкольного возраста
Формирование знаний по пожарной безопасности у детей старшего дршкольного возраста Семья – источник воспитания ребёнка
Семья – источник воспитания ребёнка Introduction to private equity
Introduction to private equity