Содержание
- 2. профессора Химкина Отвечаем на вопросы
- 3. Анод Положительно (+) заряженный электрод
- 4. Катионы Положительно (+) заряженные частицы
- 5. Катод Отрицательно(-) заряженный электрод
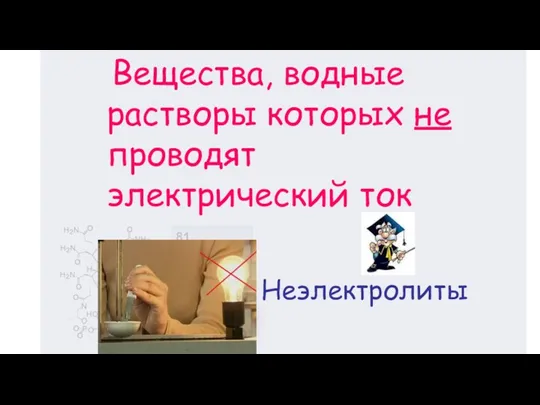
- 6. Неэлектролиты Вещества, водные растворы которых не проводят электрический ток
- 7. Анионы Отрицательно (-) заряженные частицы
- 8. Электролиты Вещества, водные растворы которых проводят электрический ток
- 9. Электролитическая диссоциация Процесс распада электролита на ионы
- 10. Кто автор теории электролитической диссоциации? В каком году была открыта эта теория? С. Аррениус; 1887 год.
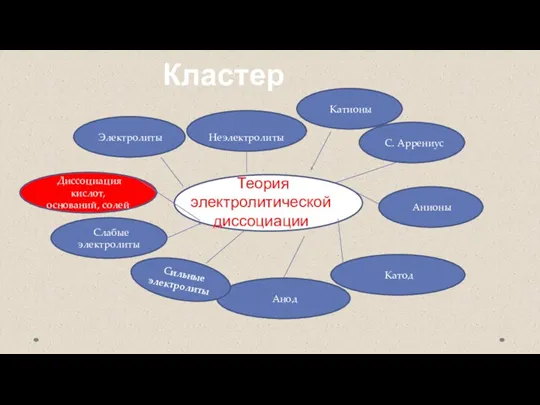
- 11. Кластер ОО Теория электролитической диссоциации Слабые электролиты Катионы
- 12. Наш девиз: Тема урока «Диссоциация кислот, оснований и солей» «Либо я найду путь, либо проложу его»
- 14. Уважаемый руководитель детективного агентства «Истина где- то рядом» и его сотрудники! К вам обращаются ваши коллеги
- 15. Игра Химический поезд
- 16. Выбери: правильно ошибка ошибка ошибка правильно правильно NaОH HCl CaCO3 SO2 H3PO4 H2SO4 правильно ошибка ошибка
- 17. Инструктаж по технике безопасности: Запрещается использовать посуду, имеющую трещины и отбитые края.
- 18. Осторожно: кислоты и щёлочи – едкие вещества. Разрушают ткани, раздражают кожу, слизистые оболочки.
- 19. После завершения работы тщательно помыть руки с мылом под проточной водой.
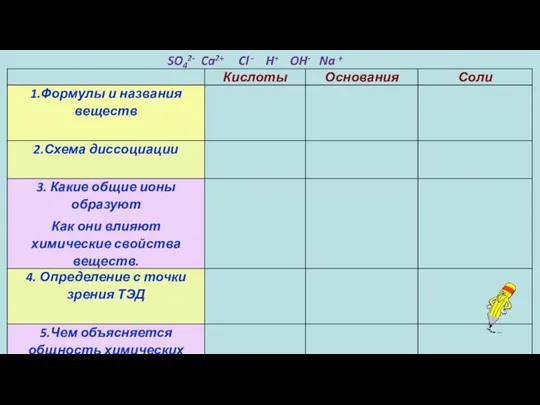
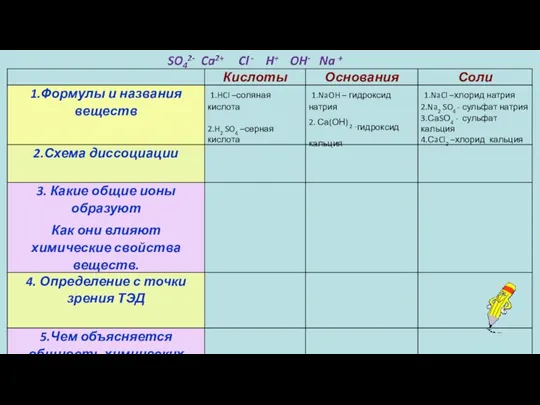
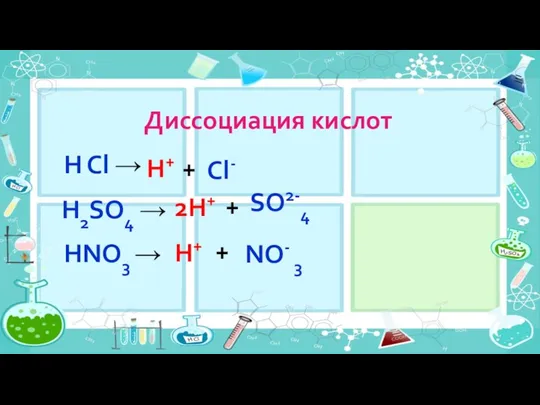
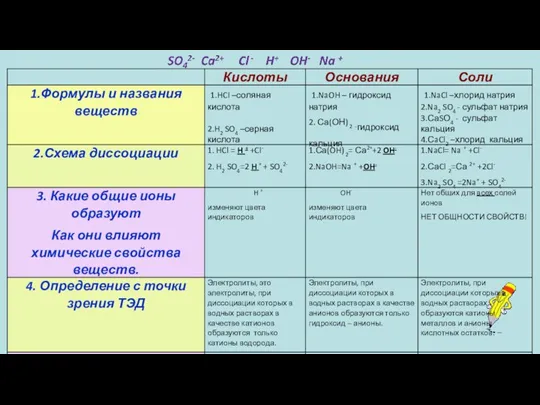
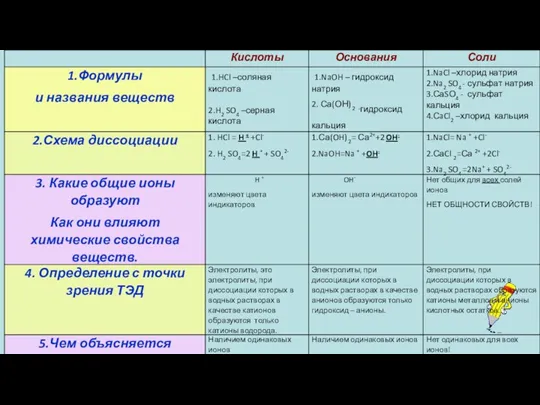
- 22. Диссоциация кислот 2H+ H Cl → H+ + Cl- H2SO4 → + SO2-4 HNO3 → H+
- 23. Многоосновные кислоты диссоциируют ступенчато H2SO4 ( серная кислота) 1) Образование гидросульфат ионов H2SO4 ↔ H+ +
- 24. Лабораторный опыт № 1 «Выявление катионов водорода» В пробирки налейте по 1—2 мл растворов соляной и
- 25. катионы водорода изменяют окраску индикатора Какие общие химические свойства проявляют кислоты? При диссоциации кислот образуются
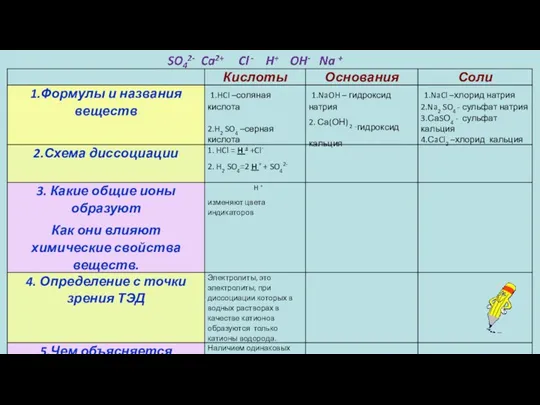
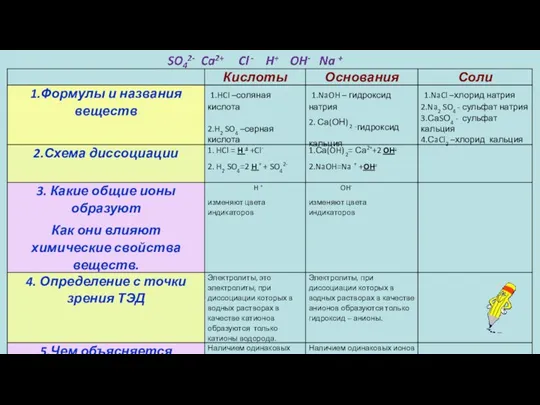
- 26. в качестве катионов образуются только катионы водорода Кислотами называются электролиты, при диссоциации которых…
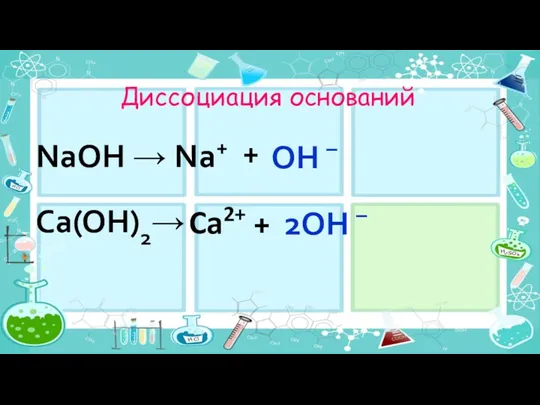
- 28. Диссоциация оснований + NaOH → Na+ OH – 2OH – Ca(OH)2→ Ca2+
- 29. Ступенчатая диссоциация оснований Сa(OH)2 (гидроксид кальция) 1) Образование гидроксо-ионов кальция Сa(OH)2 ↔ OH- + СaOH+ 2)
- 30. Лабораторный опыт № 2 «Выявление гидроксид анионов» В пробирки налейте по 1—2 мл растворов гидроксида натрия
- 31. гидроксид анионы Индикатор, изменяя цвет в щелочной среде, обнаруживает наличие гидроксид аниона изменяют окраску индикатора Какие
- 32. в качестве анионов образуются только гидроксид-анионы Основаниями называются электролиты, при диссоциации которых
- 34. Ca2+ Диссоциация солей NaCl → Na+ 2Na+ + + + Cl- Na2SO4 → SO2- 4 CaCl
- 35. Лабораторный опыт № 3 «Выявление общих свойств у солей» В пробирки налейте по 1—2 мл растворов
- 36. У солей нет общих ионов катионы металла и анионы кислотного остатка Какие общие химические свойства соли
- 37. образуются катионы металлов и анионы кислотных остатков Солями называются электролиты, при диссоциации которых
- 39. Основное положение ТЭД Химические свойства растворов электролитов определяются свойствами тех ионов, которые они образуют при диссоциации.
- 41. Сообщение доставлено
- 42. «Уважаемые коллеги! Обращаемся к вам с огромной благодарностью за оказанную помощь! Ваш вклад в расследовании данного
- 43. Напишите уравнения диссоциации следующих веществ: ZnCl2, Н3PO4, Al(NO3)3, K2SO4, KOН, FeCl3, Al2(SO4)3, Na2S, Сu(OН)2
- 44. Напишите уравнения диссоциации следующих веществ: ZnCl2, Н3PO4, FeCl3, Al2(SO4)3, Na2S, Сu(OН)2
- 45. Синквейн 1 строка – одно существительное, выражающее главную тему cинквейна. 2 строка – два прилагательных, выражающих
- 46. Кислоты Опасные, водородсодержащие Окисляют, разрушают, реагируют Изменяют цвет индикатора Вещества
- 47. Оценка за урок 12 баллов – 5 10-11 баллов – 4 7-9 баллов- 3
- 48. Домашнее задание: пар. 36 закончить таблицу своими примерами. Творческое задание составить синквейн
- 50. Скачать презентацию




































 Презентация с картинками по пдд
Презентация с картинками по пдд Йод р-н 5% . Нітроглицерин
Йод р-н 5% . Нітроглицерин Своя игра. География
Своя игра. География Стратегическое развитие предприятия: выбор и обоснование направлений
Стратегическое развитие предприятия: выбор и обоснование направлений ИППП (хламидиоз)
ИППП (хламидиоз) Назначение и классификация общесудовых систем. Тема 2.1
Назначение и классификация общесудовых систем. Тема 2.1 ЭЛОУ-АТ-6 (блок ЭЛОУ). Электродегидратор
ЭЛОУ-АТ-6 (блок ЭЛОУ). Электродегидратор Оригами. Геометрия бумажного листа
Оригами. Геометрия бумажного листа Деловой этикет в Италии
Деловой этикет в Италии часть
часть НЕПРЕРЫВНОЕ ПРОФИЛЬНОЕХУДОЖЕСТВЕННО-ЭСТЕТИЧЕСКОЕ ОБРАЗОВАНИЕВ ШКОЛЕ ИСКУССТВ С УГЛУБЛЕННЫМ ИЗУЧЕНИЕМПРЕДМЕТОВ ИСКУССТВА
НЕПРЕРЫВНОЕ ПРОФИЛЬНОЕХУДОЖЕСТВЕННО-ЭСТЕТИЧЕСКОЕ ОБРАЗОВАНИЕВ ШКОЛЕ ИСКУССТВ С УГЛУБЛЕННЫМ ИЗУЧЕНИЕМПРЕДМЕТОВ ИСКУССТВА Методологические принципы проектирования организационных структур
Методологические принципы проектирования организационных структур Государственные символы России. Конституция РФ
Государственные символы России. Конституция РФ Лекарственная проблематика лечения метастатических поражений головного мозга
Лекарственная проблематика лечения метастатических поражений головного мозга Подготовка к ЕГЭ по органической химии.
Подготовка к ЕГЭ по органической химии. Обзор книги Брайана Трейси Выйди из зоны комфорта. Измени свою жизнь. 21 метод повышения личной эффективности
Обзор книги Брайана Трейси Выйди из зоны комфорта. Измени свою жизнь. 21 метод повышения личной эффективности Шахтоуправление Добропольское
Шахтоуправление Добропольское Презентация Образовательные программы в системе дополнительного образования детей
Презентация Образовательные программы в системе дополнительного образования детей Синхронный генератор
Синхронный генератор История дизайна. Архитектурно-художественное творчество в Советской России
История дизайна. Архитектурно-художественное творчество в Советской России Народная педагогика конца XIX века
Народная педагогика конца XIX века Стартап - ресторан 100 юаней
Стартап - ресторан 100 юаней презентация к классному часу Курить - здоровью вредить
презентация к классному часу Курить - здоровью вредить Лечение аномалий окклюзии зубных рядов
Лечение аномалий окклюзии зубных рядов Презентация Русские народные костюмы
Презентация Русские народные костюмы Презентация Основы коррекционной работы по ФФН Диск
Презентация Основы коррекционной работы по ФФН Диск Шаблон игры Учись различать звонкие и глухие согласные звуки
Шаблон игры Учись различать звонкие и глухие согласные звуки Акцентуации черт характера
Акцентуации черт характера