Содержание
- 2. Учебная цель: изучить способы получения, химические свойства и применение алкенов на примере непредельного углеводорода - этилена
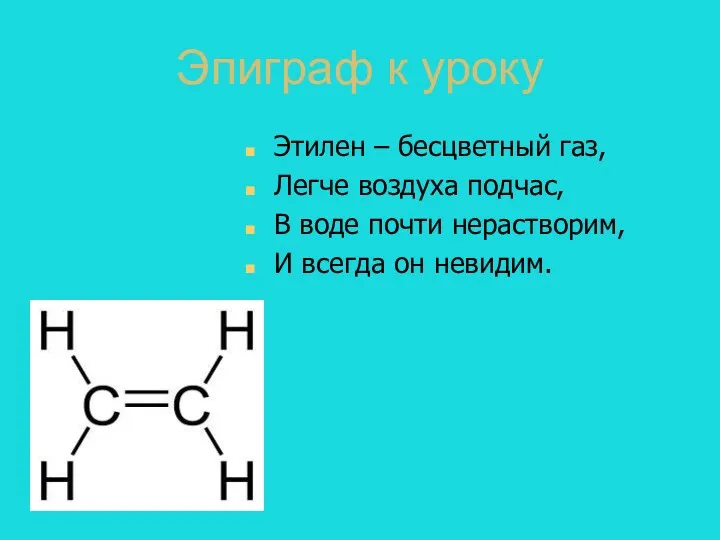
- 3. Эпиграф к уроку Этилен – бесцветный газ, Легче воздуха подчас, В воде почти нерастворим, И всегда
- 4. Ответьте, пожалуйста, на следующие вопросы: Какие углеводороды называются алкенами? Какова общая формула алкенов? Какова структурная формула
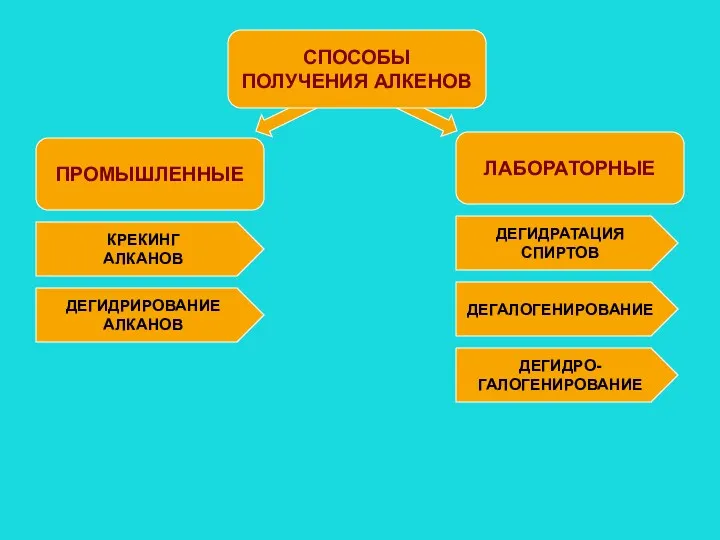
- 5. ПРОМЫШЛЕННЫЕ СПОСОБЫ ПОЛУЧЕНИЯ АЛКЕНОВ ЛАБОРАТОРНЫЕ КРЕКИНГ АЛКАНОВ ДЕГИДРИРОВАНИЕ АЛКАНОВ ДЕГИДРАТАЦИЯ СПИРТОВ ДЕГАЛОГЕНИРОВАНИЕ ДЕГИДРО- ГАЛОГЕНИРОВАНИЕ
- 6. ПРОМЫШЛЕННЫЙ СПОСОБ ПОЛУЧЕНИЯ КРЕКИНГ АЛКАНОВ АЛКАН → АЛКАН + АЛКЕН С БОЛЕЕ ДЛИННОЙ С МЕНЕЕ ДЛИНОЙ
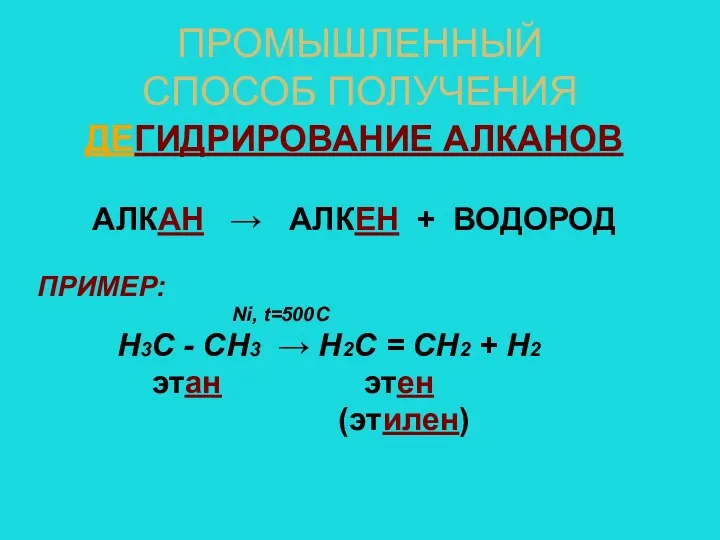
- 7. ПРОМЫШЛЕННЫЙ СПОСОБ ПОЛУЧЕНИЯ ДЕГИДРИРОВАНИЕ АЛКАНОВ АЛКАН → АЛКЕН + ВОДОРОД ПРИМЕР: Ni, t=500C Н3С - СН3
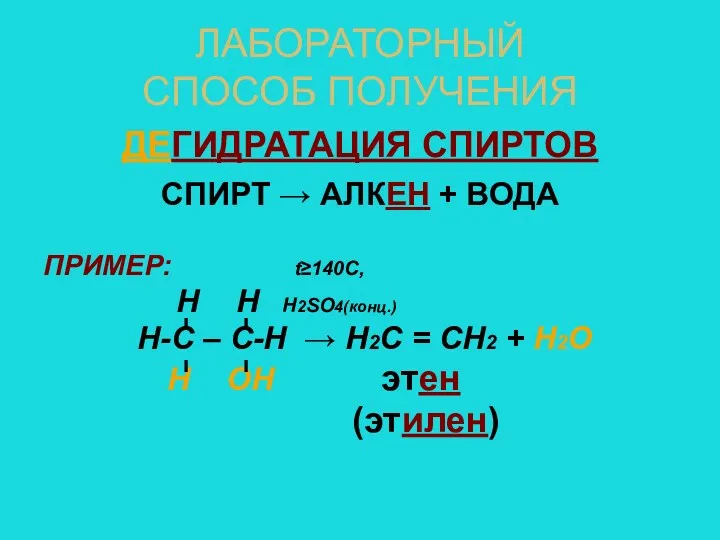
- 8. ЛАБОРАТОРНЫЙ СПОСОБ ПОЛУЧЕНИЯ ДЕГИДРАТАЦИЯ СПИРТОВ СПИРТ → АЛКЕН + ВОДА ПРИМЕР: t≥140C, Н Н Н2SO4(конц.) Н-С
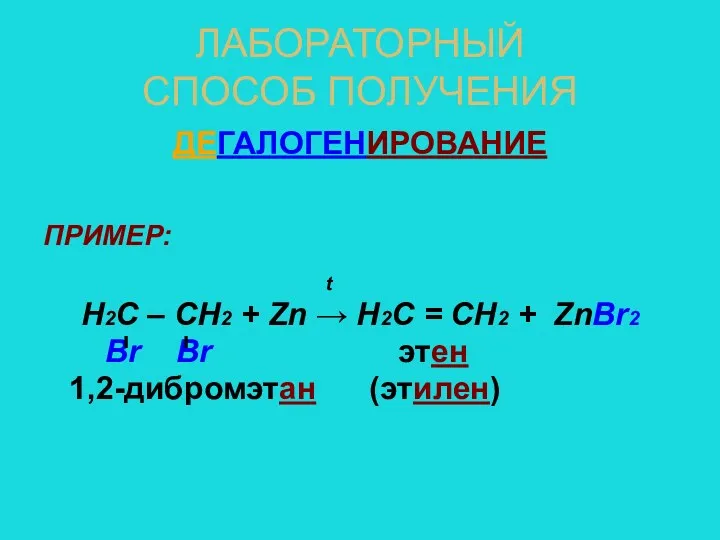
- 9. ЛАБОРАТОРНЫЙ СПОСОБ ПОЛУЧЕНИЯ ДЕГАЛОГЕНИРОВАНИЕ ПРИМЕР: t Н2С – СН2 + Zn → Н2С = СН2 +
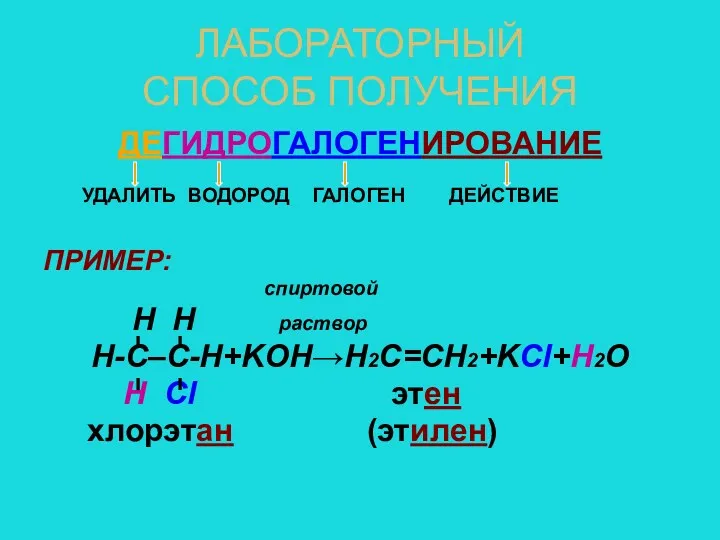
- 10. ЛАБОРАТОРНЫЙ СПОСОБ ПОЛУЧЕНИЯ ДЕГИДРОГАЛОГЕНИРОВАНИЕ УДАЛИТЬ ВОДОРОД ГАЛОГЕН ДЕЙСТВИЕ ПРИМЕР: спиртовой H H раствор Н-С–С-Н+KOH→Н2С=СН2+KCl+H2O Н Cl
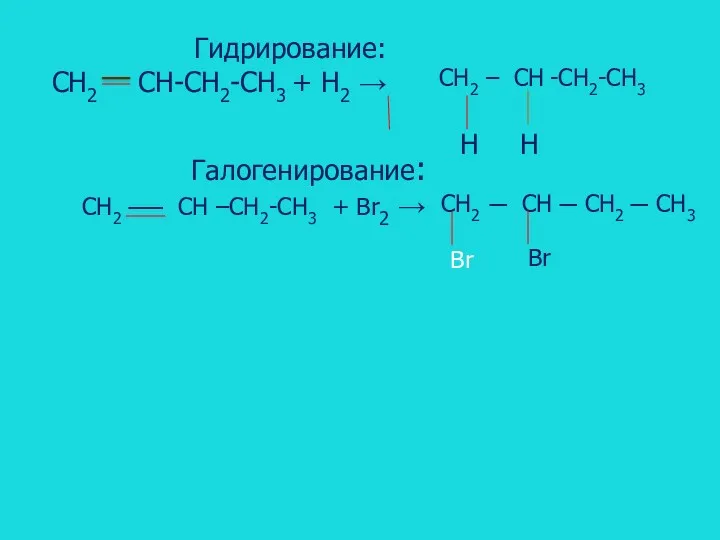
- 11. Гидрирование: CH2 CH-CH2-CH3 + H2 → CH2 – CH -CH2-CH3 Галогенирование: CH2 ── CH –CH2-CH3 +
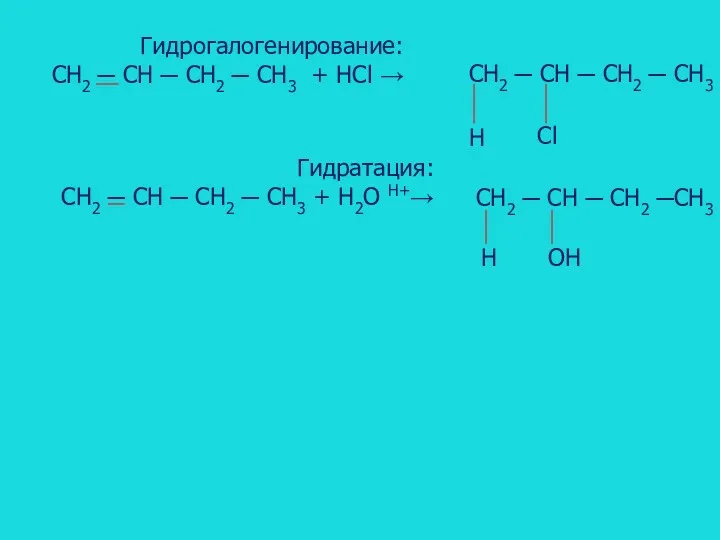
- 12. Гидрогалогенирование: CH2 ─ CH ─ CH2 ─ CH3 + HCl → CH2 ─ CH ─ CH2
- 13. РЕАКЦИИ ОКИСЛЕНИЯ ГОРЕНИЕ АЛКЕНОВ ПРИМЕР: С2Н4 + 3О2 2СО2 + 2Н2О
- 14. РЕАКЦИИ ОКИСЛЕНИЯ МЯГКОЕ ОКИСЛЕНИЕ – ВЗАИМОДЕЙСТВИЕ С РАСТВОРОМ ПЕРМАНАГАНАТА КАЛИЯ (реакция Е.Е.Вагнера) Н2С=СН2 + [O] +
- 15. РЕАКЦИЯ ПОЛИМЕРИЗАЦИИ Это процесс соединения одинаковых молекул в более крупные. ПРИМЕР: n CH2=CH2 (-CH2-CH2-)n этилен полиэтилен
- 16. Применение этилена
- 18. СИНКВЕЙН 1 строка – имя существительное (тема синквейна) 2 строка – два прилагательных (раскрывающие тему синквейна)
- 19. Этилен Ненасыщенный, активный Горит, обесцвечивает, присоединяет Этилен – представитель непредельных углеводородов Алкен
- 20. ДОМАШНЕЕ ЗАДАНИЕ Параграф 4, № 8,9 По желанию: Составить цепочку превращений, используя материал по темам «Алканы»
- 22. Скачать презентацию











 Мастер-класс Структура логопедического занятия
Мастер-класс Структура логопедического занятия Портфоліо учителя математики Кашенець Тетяни Миколаївни
Портфоліо учителя математики Кашенець Тетяни Миколаївни Introduction to information security
Introduction to information security Жития новомучеников и исповедников Церкви Русской Истринской земли
Жития новомучеников и исповедников Церкви Русской Истринской земли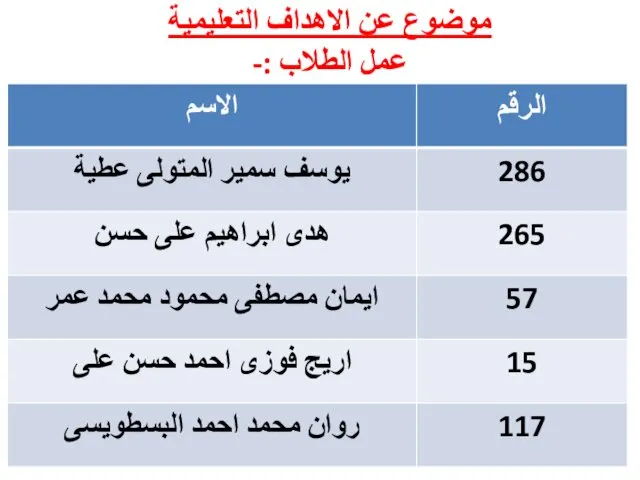 موضوع عن االهداف التعليمية
موضوع عن االهداف التعليمية Академия гражданской защиты МЧС России
Академия гражданской защиты МЧС России презентация Развитие творческих способностей детей раннего возраста в продуктивной (конструктивной) деятельности.
презентация Развитие творческих способностей детей раннего возраста в продуктивной (конструктивной) деятельности. С днем учителя, дорогие и любимые преподаватели
С днем учителя, дорогие и любимые преподаватели Права и свободы человека и гражданина РФ
Права и свободы человека и гражданина РФ Хозяйство Европейского Юга
Хозяйство Европейского Юга Радиоприемные устройства РЛС. Устройства адаптации
Радиоприемные устройства РЛС. Устройства адаптации 2012 год - год истории
2012 год - год истории Состояние мирового уровня энергоменеджмента, международные инструменты стимулирования энергосбережения
Состояние мирового уровня энергоменеджмента, международные инструменты стимулирования энергосбережения Педагогический опыт (презентация)
Педагогический опыт (презентация) 20230923_prilozhenie_2
20230923_prilozhenie_2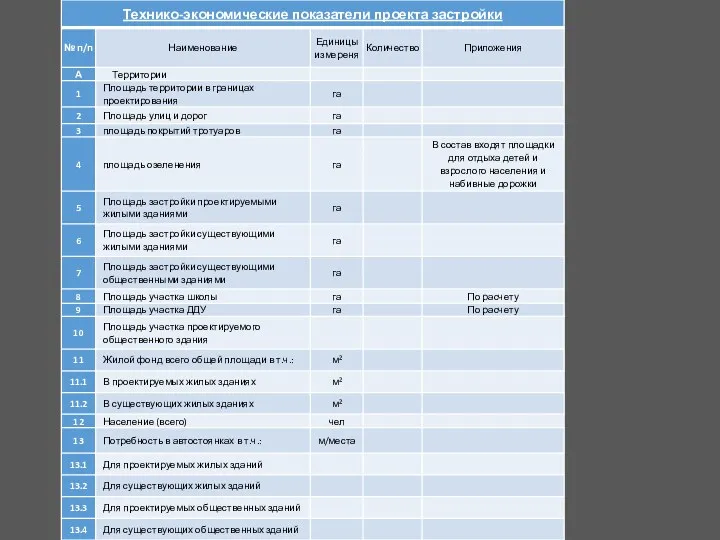 Технико-экономические показатели проекта застройки
Технико-экономические показатели проекта застройки Шизофрения. Основные гипотезы патогенеза. Клинические формы и типы течения. Общие принципы лечения
Шизофрения. Основные гипотезы патогенеза. Клинические формы и типы течения. Общие принципы лечения Загальні поняття про радіоперешкоди. Огляд методів захисту від перешкод. (Тема 6.1)
Загальні поняття про радіоперешкоди. Огляд методів захисту від перешкод. (Тема 6.1) Радіометричні поліпшуючі перетворення. Лабораторна робота №19
Радіометричні поліпшуючі перетворення. Лабораторна робота №19 клас укр яз
клас укр яз Основні засади стандартизації: мета, задачі, принципи
Основні засади стандартизації: мета, задачі, принципи Триггеры в презентации
Триггеры в презентации Концепція об’єктно-орієнтованого програмування: базові поняття та основні принципи
Концепція об’єктно-орієнтованого програмування: базові поняття та основні принципи Жанры изобразительного искусства
Жанры изобразительного искусства Церковь Христова
Церковь Христова Линейные электрические цепи постоянного тока
Линейные электрические цепи постоянного тока Презентация Времена года
Презентация Времена года Факторы и условия, повышающие эффективность тренировочной и соревновательной деятельности
Факторы и условия, повышающие эффективность тренировочной и соревновательной деятельности