Содержание
- 2. Какие сведения о воде вам были известны до сегодняшнего урока? Вода-это……..
- 3. Французский писатель Антуан де Сент – Экзюпери так писал о воде: «…У тебя нет ни вкуса,
- 4. Физические свойства воды
- 5. обладает большой теплоемкостью не проводит электрический ток Бесцветная жидкость Существует в трех агрегатных состояниях tкип.=1000C Без
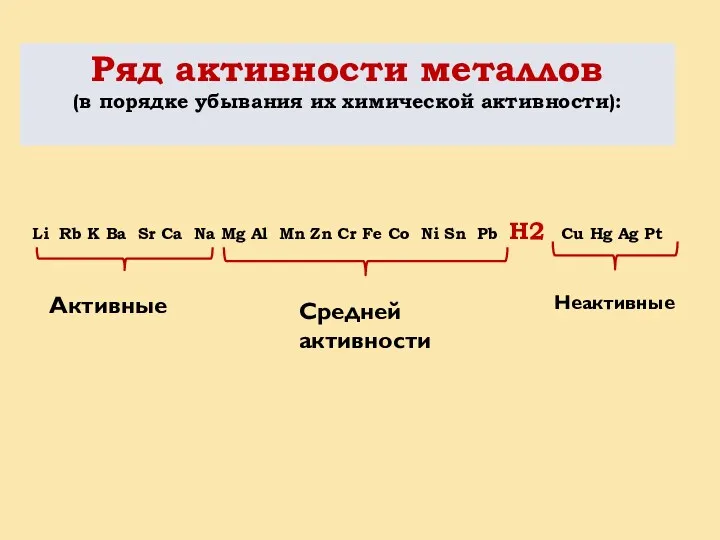
- 8. Ряд активности металлов (в порядке убывания их химической активности): Li Rb K Ba Sr Ca Na
- 9. 1.ВЗАИМОДЕЙСТВИЕ ВОДЫ С МЕТАЛЛАМИ С МЕТАЛЛАМИ С активными металлами образует основания (щелочи) и водород: 2Na +
- 10. 2. ВЗАИМОДЕЙСТВИЕ ВОДЫ С ОКСИДАМИ МЕТАЛЛОВ. С оксидами активных металлов образует основания (щелочи): СаО+Н2О=Са(ОН)2 гидроксид кальция
- 11. 3. ВЗАИМОДЕЙСТВИЕ ВОДЫ С ОКСИДАМИ НЕМЕТАЛЛОВ. С оксидами неметаллов образует кислоты (кроме SiO2) SO2+ H2O →
- 12. 4. Вода реагирует с некоторыми неметаллами (продукты реакции разнообразны) С+ H2O=СО+Н2 (при нагревании)
- 13. 5. Разложение воды под действием постоянного электрического тока: 2 H2O =2 H2 + O2
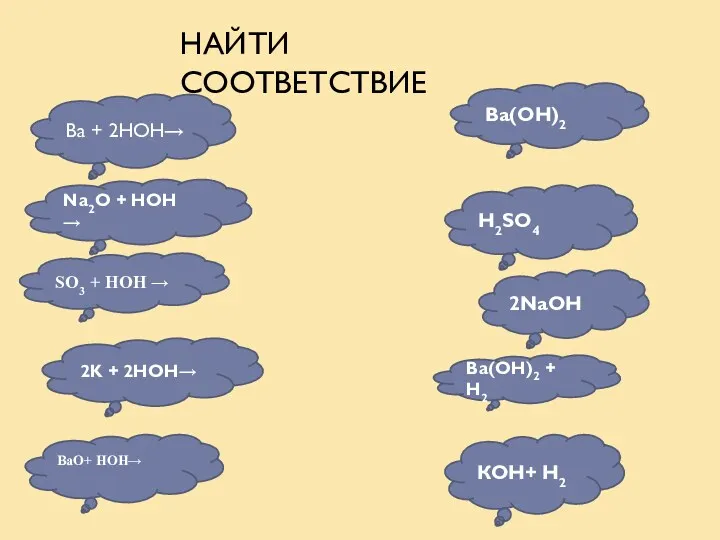
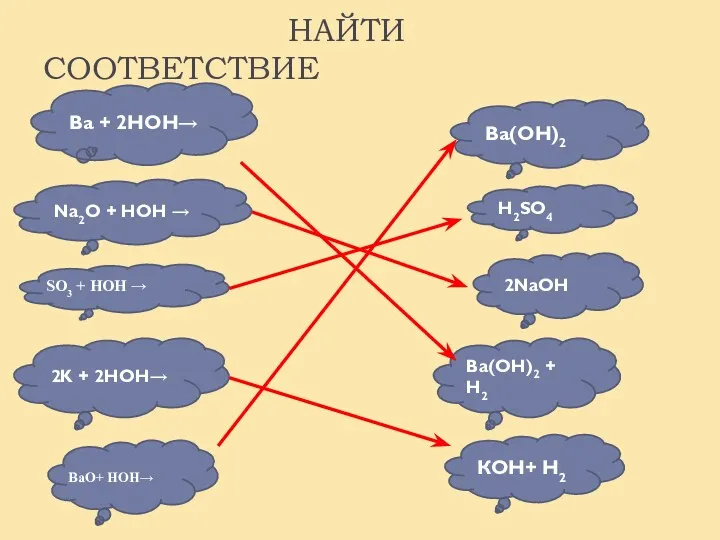
- 14. Ва + 2НОН→ Na2O + HOH → SO3 + HOH → 2K + 2HOH→ Ва(ОН)2 H2SO4
- 15. НАЙТИ СООТВЕТСТВИЕ Na2O + HOH → 2K + 2HOH→ Ва(ОН)2 КОН+ Н2 Ва(ОН)2 + Н2 2NaOH
- 16. ВЫВОДЫ: + Me (активный) = Me(OH)n + Н2 + Ме (средней активности) = МеО + Н2
- 18. Домашнее задание & 29. Упр.5 Стр.76. Презентация «Вода в нашей жизни»
- 20. Скачать презентацию












 Мирный Дагестан
Мирный Дагестан Диагностика математических способностей у детей 5-6 лет
Диагностика математических способностей у детей 5-6 лет Презентация к классному часу.
Презентация к классному часу. Возникновение ислама
Возникновение ислама Подъёмно-транспортные устройства
Подъёмно-транспортные устройства Организация питания детей в школьных столовых по безналичной форме оплаты
Организация питания детей в школьных столовых по безналичной форме оплаты презентация. Своя игра.
презентация. Своя игра. Использование информационных компьютерных технологий на уроках географии и изобразительного искусства
Использование информационных компьютерных технологий на уроках географии и изобразительного искусства Ақпараттық кеңістіктегі киберқауіпсіздік негіздері
Ақпараттық кеңістіктегі киберқауіпсіздік негіздері Итоги исполнения местных бюджетов Калининградской области
Итоги исполнения местных бюджетов Калининградской области Тушение пожаров на железнодорожном транспорте
Тушение пожаров на железнодорожном транспорте Электрические машины постоянного тока
Электрические машины постоянного тока Презентация к уроку Химическая связь.
Презентация к уроку Химическая связь. Создание графических изображений. Обработка графической информации. (7 класс)
Создание графических изображений. Обработка графической информации. (7 класс) Электроизмерительные приборы
Электроизмерительные приборы Экскурсоведение. Экскурсия и ее основные признаки
Экскурсоведение. Экскурсия и ее основные признаки Endangered species
Endangered species Организация и планирование образовательного процесса
Организация и планирование образовательного процесса ПАО Газпром
ПАО Газпром Вред и утилизация батареек
Вред и утилизация батареек Hydroelectric Power Plants
Hydroelectric Power Plants Презентація_8
Презентація_8 Здоровый образ жизни для зрелых людей
Здоровый образ жизни для зрелых людей Современное искусство – манга
Современное искусство – манга Математика
Математика Проектная работа
Проектная работа HTML программирование
HTML программирование Немецкая классическая философия
Немецкая классическая философия