Содержание
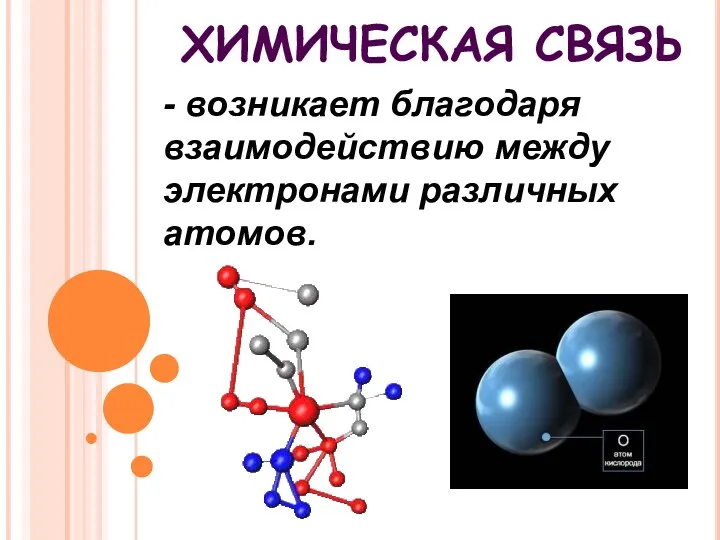
- 2. - возникает благодаря взаимодействию между электронами различных атомов. ХИМИЧЕСКАЯ СВЯЗЬ
- 3. Электроотрицательность. Виды химической связи. Э.О. – свойство атомов данного элемента оттягивать на себя электроны от атомов
- 4. ИЗМЕНЕНИЕ ЭО АТОМОВ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ ПО ПЕРИОДУ ПО ГРУППЕ По периоду слева направо ЭО возрастает. Т.к.
- 5. ВИДЫ ХИМИЧЕСКИХ СВЯЗЕЙ Ионная (И.С.) Металлическая (Ме.С.) Образуется между Ме и неМе Образована атомами Ме Ковалентная
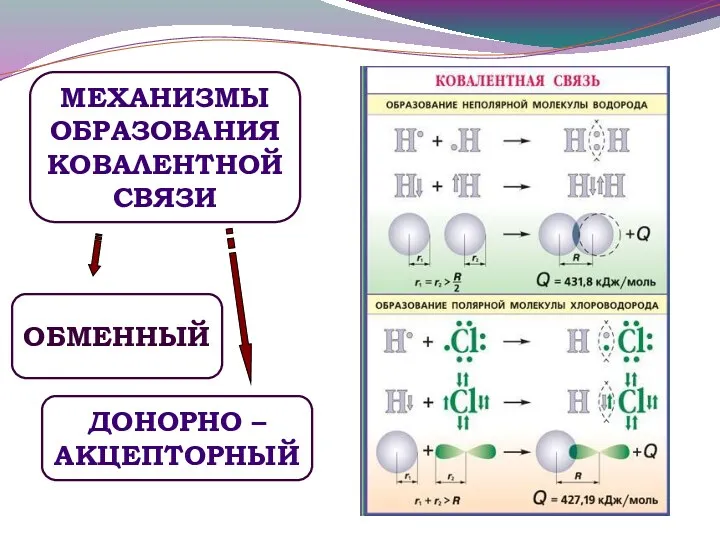
- 6. МЕХАНИЗМЫ ОБРАЗОВАНИЯ КОВАЛЕНТНОЙ СВЯЗИ ОБМЕННЫЙ ДОНОРНО – АКЦЕПТОРНЫЙ
- 7. Образование КНС
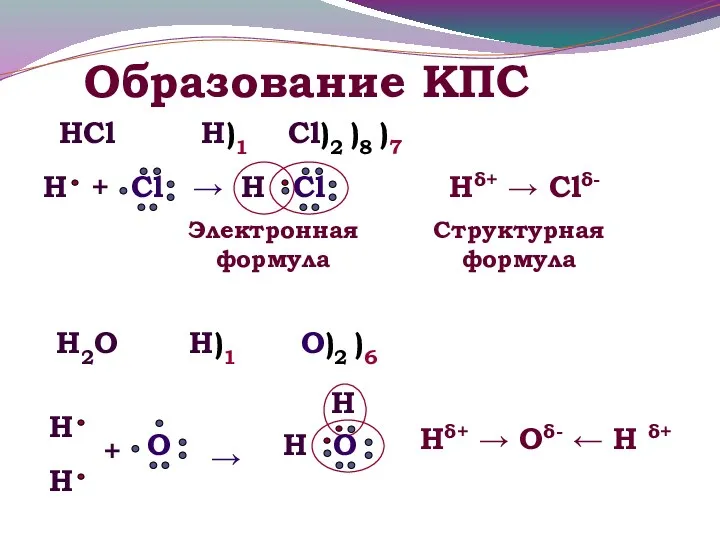
- 8. Образование КПС HCl Н)1 Hδ+ → Clδ- Электронная формула Структурная формула Cl)2 )8 )7 H2O Н)1
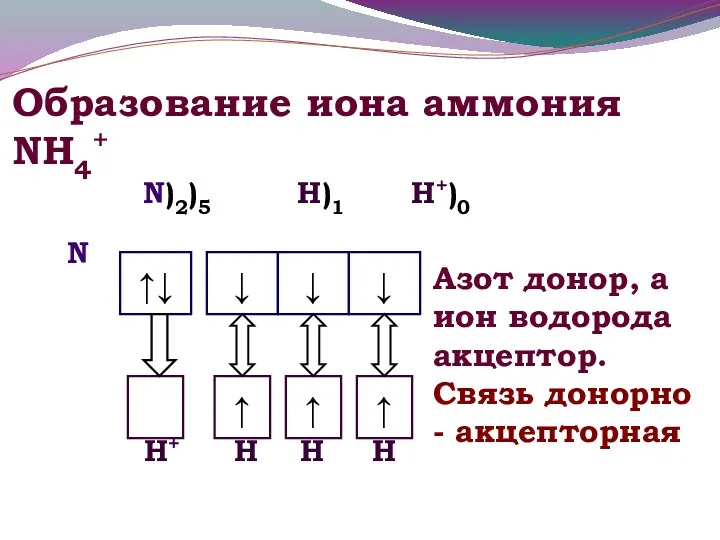
- 9. Образование иона аммония NH4+ Н+ N Н Н Н N)2)5 Н)1 Н+)0 Азот донор, а ион
- 10. Образование ИС NaCl Na )2 )8 )1 Электронная формула Cl)2 )8 )7 Na2O O)2 )6 Na
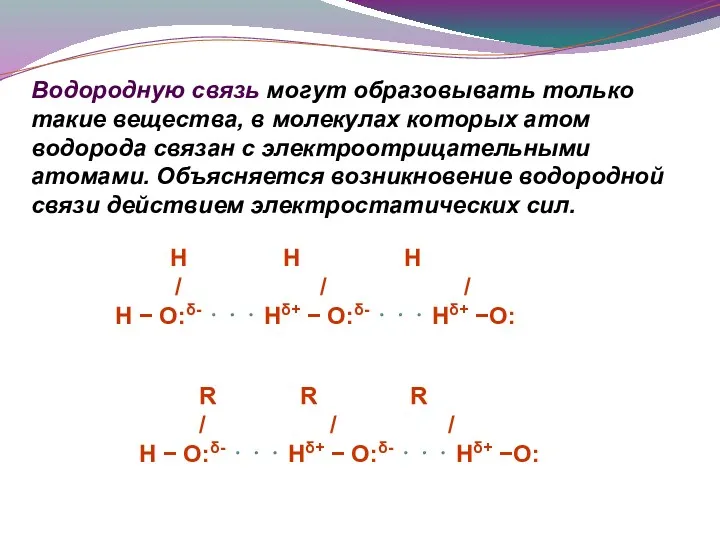
- 11. Водородную связь могут образовывать только такие вещества, в молекулах которых атом водорода связан с электроотрицательными атомами.
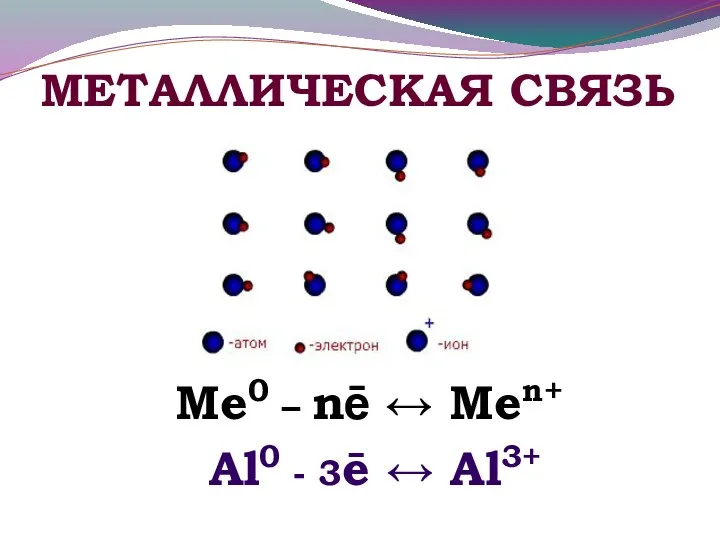
- 12. МЕТАЛЛИЧЕСКАЯ СВЯЗЬ Ме0 – nē ↔ Меn+ Al0 - 3ē ↔ Al3+
- 13. ХАРАКТЕРИСТИКИ ХИМИЧЕСКОЙ СВЯЗИ.
- 14. Важной характеристикой химической связи является ее энергия. Это мера прочности связи. Ее величина определяется выделенной или
- 15. Также важна длина связи - расстояние между центрами ядер атома в молекуле или кристалле. Например: Длина
- 16. Число ковалентных связей, которое способен образовывать некоторый атом в каждом конкретном случае ограничено числом тех валентных
- 17. НАПРАВЛЕННОСТЬ ХИМИЧЕСКИХ СВЯЗЕЙ
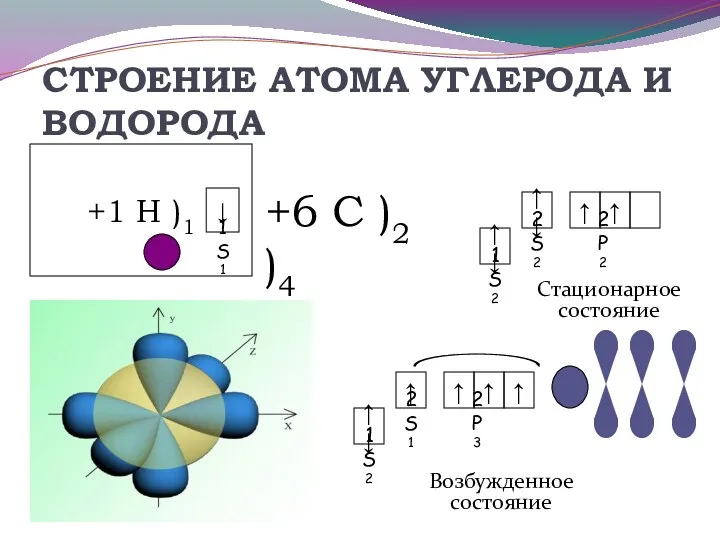
- 18. СТРОЕНИЕ АТОМА УГЛЕРОДА И ВОДОРОДА Возбужденное состояние +6 С )2 )4 Стационарное состояние
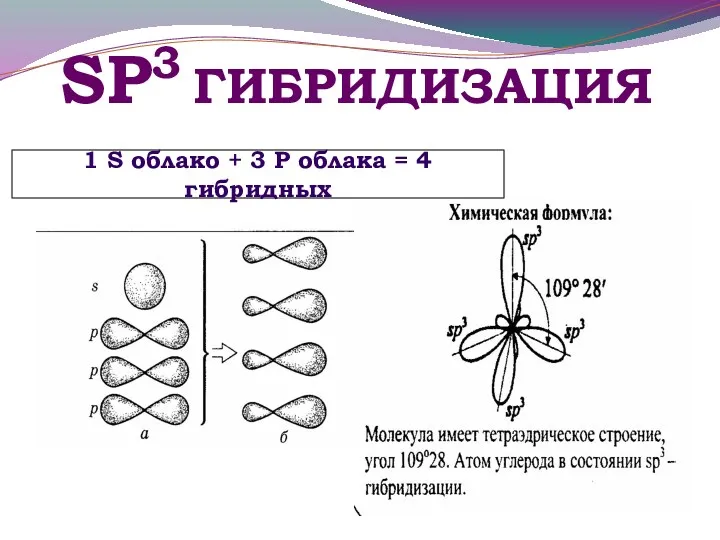
- 19. SР3 ГИБРИДИЗАЦИЯ 1 S облако + 3 Р облака = 4 гибридных
- 20. SP2 ГИБРИДИЗАЦИЯ Виды связей ? Молекула имеет тригональное строение, угол между гибридными облаками 1200, длина связи
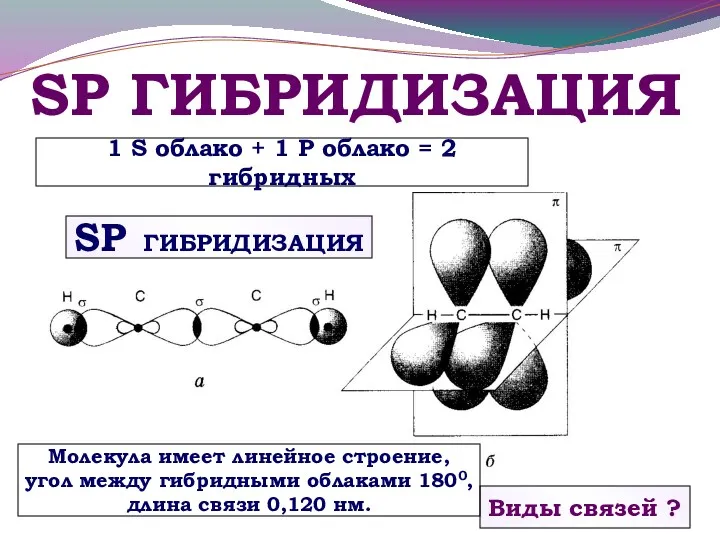
- 21. SP ГИБРИДИЗАЦИЯ Виды связей ? Молекула имеет линейное строение, угол между гибридными облаками 1800, длина связи
- 23. Скачать презентацию










 Гробница фараона Тутанхамона
Гробница фараона Тутанхамона Оксиды и кислородсодержащие кислоты неметаллов. 11 класс
Оксиды и кислородсодержащие кислоты неметаллов. 11 класс Отдел Папоротниковидные
Отдел Папоротниковидные Системная красная волчанка. Коллагенозы
Системная красная волчанка. Коллагенозы Механизмы невынашивания беременности. Причины бесплодия
Механизмы невынашивания беременности. Причины бесплодия Памятник Солдату и Матросу
Памятник Солдату и Матросу Functional analysis of the space
Functional analysis of the space Системный подход к управлению персоналом
Системный подход к управлению персоналом Консервы овощные и плодово-ягодные. Быстрозамороженная плодово-овощная продукция
Консервы овощные и плодово-ягодные. Быстрозамороженная плодово-овощная продукция Презентация С чего начинается Родина
Презентация С чего начинается Родина Развлечение для детей В гостях у сказки Диск
Развлечение для детей В гостях у сказки Диск Посвящение первоклассников в пешеходы
Посвящение первоклассников в пешеходы Тематический контроль опытно-экспериментальной деятельности
Тематический контроль опытно-экспериментальной деятельности Остеоартроз (остеоартрит)
Остеоартроз (остеоартрит) Теория соотношения факторов производства
Теория соотношения факторов производства Человеческие расы
Человеческие расы Творчество Дионисия и Ушакова
Творчество Дионисия и Ушакова Математика. Демонстрационный материал (учебно-наглядное пособие)
Математика. Демонстрационный материал (учебно-наглядное пособие) Яблочный массаж
Яблочный массаж Музыкально-театральная студия Светлячок
Музыкально-театральная студия Светлячок Образовательная программа высшего образования. Искусствоведение (история искусств)
Образовательная программа высшего образования. Искусствоведение (история искусств) Символы и образы в православной культуре
Символы и образы в православной культуре Ссудный процент
Ссудный процент Коса - украшение девушки
Коса - украшение девушки Наркозға арналған заттар және оның жіктелуі
Наркозға арналған заттар және оның жіктелуі Высшие споровые растения
Высшие споровые растения Экологические проблемы России
Экологические проблемы России Государственная политика в области занятости
Государственная политика в области занятости