Содержание
- 2. Цель урока: Рассмотреть нахождение воды в природе Ознакомиться со способами получения чистой воды и проблемой сохранения
- 3. Оборудование: Модель молекулы воды Пробирки Na, H20, P2O5, CaO Индикаторы
- 4. Повторение пройденного материала: 1.Рассчитайте относительную плотность оксида углерода (IV) по хлору. 2.Какой объем займут: 1)0,4 моль
- 5. Решения: 1. D=M(CO2)/M(Cl2)=44/71=0,619 2.
- 6. Решения: 3.
- 7. Объяснение нового материала Вода… Ты не просто необходима для жизни, ты и есть жизнь. А. де
- 8. Генри Кавендиш(1731-1810) Английский естествоиспытатель, физик и химик. Научные исследования проводил в собственной лаборатории и много занимался
- 9. Генри Кавендиш(1731-1810) Кавендиш производил на современников очень странное впечатление: голос его был похож на писк, а
- 10. Генри Кавендиш(1731-1810) Несмотря на все свои чудачества, Кавендиш вошел в историю химии как блестящий ученый- экспериментатор.
- 11. Однако мысль о том, что вода – сложное вещество первым высказал не Кавендиш, а знаменитый изобретатель
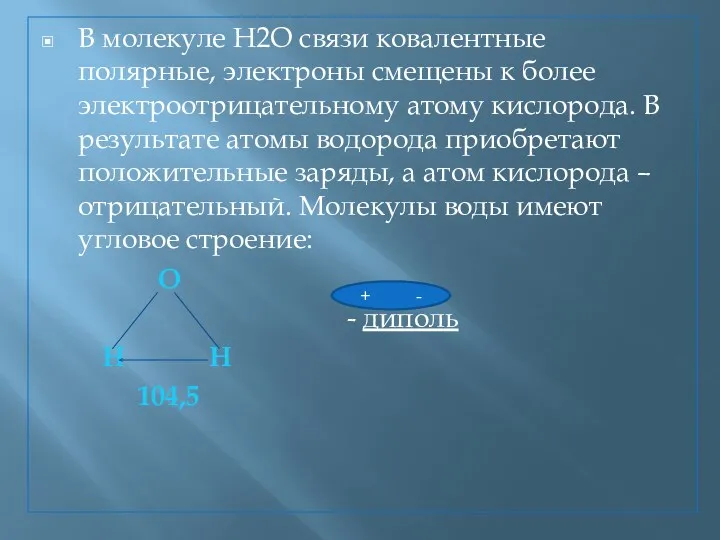
- 12. В молекуле H2O связи ковалентные полярные, электроны смещены к более электроотрицательному атому кислорода. В результате атомы
- 13. Вследствие того, что молекула полярна, в жидкой воде её молекулы притягиваются друг к другу разноименными полюсами
- 14. Образованием ассоциатов объясняется высокая теплоемкость воды и большой расход теплоты на её испарение. Водяной пар состоит
- 15. Казалось бы, что может быть проще, чем вода? Оказывается воду можно назвать чудом природы!
- 16. Почему глубокие озера, моря и океаны даже в самые лютые морозы не промерзают до дна? Лед
- 17. Причина необычных свойств кристаллических свойств воды- особое строение льда. Здесь образуется «ажурная» структура, в которой, как
- 18. При плавлении льда молекулы H2O немного сближаются и плотность жидкой H2O при температуре плавления становится чуть-чуть
- 19. При 0°С кристаллизируется чистая вода так, что замораживая раствор солей(морскую воду) получают пресный магний(Mg)
- 20. Вода в природе Это самое распространенное вещество на нашей планете. Она единственное вещество, которое существует во
- 21. Очистка воды 1) Пропускают через решетки, которые задерживают крупные предметы 2) направляют в отстойник(происходит оседание неотфильтрованных
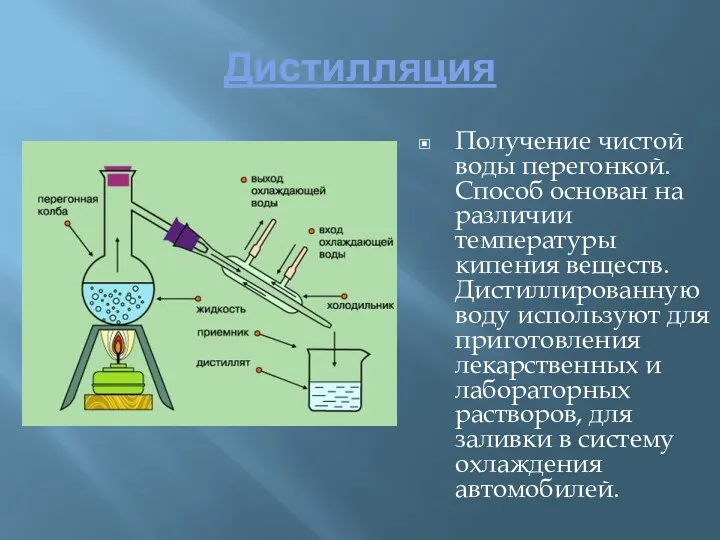
- 22. Дистилляция Получение чистой воды перегонкой. Способ основан на различии температуры кипения веществ. Дистиллированную воду используют для
- 23. Физические свойства Прозрачная жидкость, без вкуса и запаха. В тонких слоях бесцветна, в толстых имеет голубоватый
- 24. Физические свойства Метеорологи подсчитали, что солнце испаряет на Земле за 1 мин. Миллиард тонн воды. И
- 25. Химические свойства 1) Как окислитель: а) с щелочными и щёлочно-земельными металлами. 2Na+2H20= 2NaOH+H2 +Q б) с
- 26. 2) Как восстановитель: 2F2+2H2O=4HF+O2 Вода горит во фторе голубым пламенем
- 27. 3) t° 2H2O = 2H2 + O2 - Q 4) C оксидами активных металлов Li2O+H20=2LiOH +
- 28. 6) С некоторыми солями, образуя кристаллогидраты: FeSO4+7H20=FeSO4*7H2O+Q (железный купорос) СuSO4+5H2O=CuSO4*5H20 (медный купорос)
- 30. Скачать презентацию

























 Использование фольклора в режимных моментах в группах младшего возраста
Использование фольклора в режимных моментах в группах младшего возраста T-link Web-based translation service
T-link Web-based translation service Ет және сүйек пастасын өндіру жабдығын орнату,іске қосу және пайдалану
Ет және сүйек пастасын өндіру жабдығын орнату,іске қосу және пайдалану Критериальная оценка учебных достижений учащихся по предмету технология
Критериальная оценка учебных достижений учащихся по предмету технология Ребенок в многонациональном мегаполисе
Ребенок в многонациональном мегаполисе Гармония любви
Гармония любви Физическая культура в системе воспитания детей школьного возраста
Физическая культура в системе воспитания детей школьного возраста Куст № 5 скважина № 2080 Соровского месторождения • Буровой подрядчик: ООО ИДС
Куст № 5 скважина № 2080 Соровского месторождения • Буровой подрядчик: ООО ИДС Кроссворд Редкие птицы Курской области
Кроссворд Редкие птицы Курской области Основы градостроительства и проектирования гражданских зданий
Основы градостроительства и проектирования гражданских зданий Класный час Поговорим о дружбе...
Класный час Поговорим о дружбе... Алгоритм управления исполнителем Чертёжник
Алгоритм управления исполнителем Чертёжник Повірка електричних засобів вимірювальної техніки безпосередньої оцінки
Повірка електричних засобів вимірювальної техніки безпосередньої оцінки Визитная карточка
Визитная карточка Разработка методов и средств защиты техники от коррозии
Разработка методов и средств защиты техники от коррозии Mystery Caller. ООО ММС Рус
Mystery Caller. ООО ММС Рус Бюджетная система Российской Федерации
Бюджетная система Российской Федерации Духовно-нравственное воспитание младших школьников в условиях реализации ФГОС
Духовно-нравственное воспитание младших школьников в условиях реализации ФГОС Творческий проект Логарифмическая линейка
Творческий проект Логарифмическая линейка У Лукоморья дуб зеленый
У Лукоморья дуб зеленый Презентация Великий русский писатель Гоголь Н.В.
Презентация Великий русский писатель Гоголь Н.В. Организационный семинар по подготовке к учебной и производственной, в т.ч. преддипломной практике студентов
Организационный семинар по подготовке к учебной и производственной, в т.ч. преддипломной практике студентов презентация по географическому краеведению Население Нижегородской области
презентация по географическому краеведению Население Нижегородской области Аккредитивы и торговое финансирование. Райффайзен Банк
Аккредитивы и торговое финансирование. Райффайзен Банк Производство листового стекла лодочным и безлодочным способом
Производство листового стекла лодочным и безлодочным способом Февральская революция в России 1917 года
Февральская революция в России 1917 года Экологическая оценка Медведевского леса. Г. Орел
Экологическая оценка Медведевского леса. Г. Орел Модуль действительного числа
Модуль действительного числа