Содержание
- 2. Fe Это элемент № 26 Это элемент 4- ого периода Четвертый по распространенности элемент в земной
- 3. Электронное строение железа
- 4. Нахождение в природе В земной коре железо распространено достаточно широко — на его долю приходится около
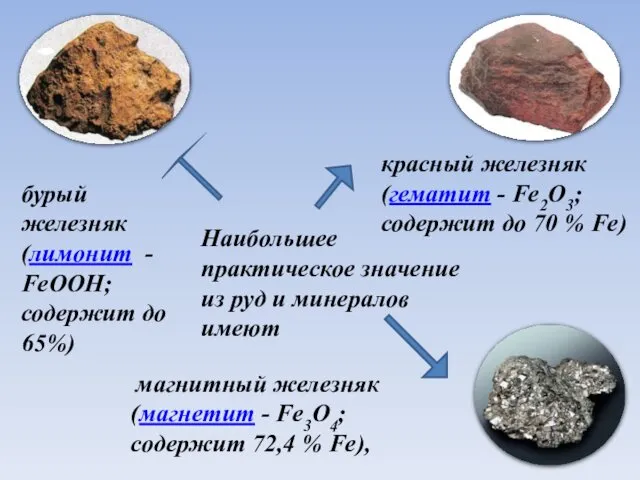
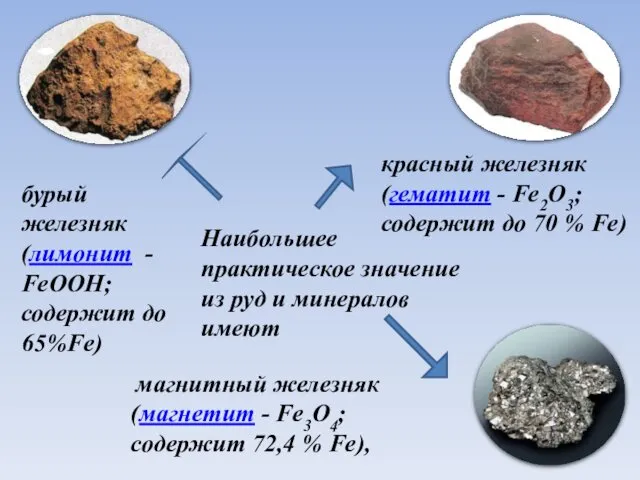
- 5. Наибольшее практическое значение из руд и минералов имеют магнитный железняк (магнетит - Fe3O4; содержит 72,4 %
- 6. Наибольшее практическое значение из руд и минералов имеют магнитный железняк (магнетит - Fe3O4; содержит 72,4 %
- 7. Физические свойства железа Железо- сравнительно мягкий , ковкий серебристо-серый металл Температура плавления 15350C Температура кипения 28000C
- 8. Химические свойства 1. Реакции с простыми веществами Железо сгорает в чистом кислороде при нагревании:4Fe +3O2=2Fe2O3 Реагирует
- 9. Химические свойства 2. Реакции со сложными веществами С кислотами: А) с соляной кислотой 2HCL + Fe
- 10. Железо в организме Железо присутствует в организмах всех растений и животных, но в малых количествах (в
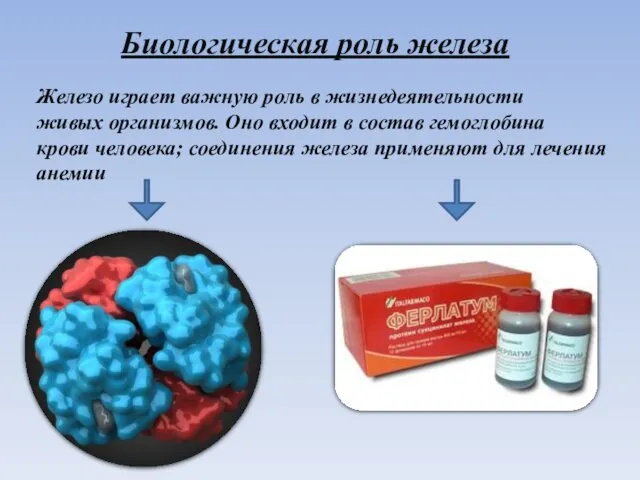
- 11. Биологическая роль железа Железо играет важную роль в жизнедеятельности живых организмов. Оно входит в состав гемоглобина
- 12. Первое металлическое железо, попавшее в руки человека, имело, вероятно, метеоритное происхождение. Руды железа широко распространены и
- 13. Люди впервые овладели железом в четвертом-третьем тысячелетиях до н. э., подбирая упавшие с неба камни —
- 14. Применение железа, его сплавов и соединений Чистое железо имеет довольно ограниченное применение. Его используют при изготовлении
- 15. «Чистое железо способно быстро намагничиваться и размагничиваться, поэтому его применяют для изготовления сердечников, трансфо-, мембраноматоров, электромагнитов
- 17. Скачать презентацию










 Карбоновые кислоты
Карбоновые кислоты Грид-технологии и большие данные. (Лекция 5)
Грид-технологии и большие данные. (Лекция 5) Отношение христианина к природе
Отношение христианина к природе Помощник. Сказка
Помощник. Сказка Оборонительная система фортов Кёнигсберга
Оборонительная система фортов Кёнигсберга АҚ Өскемен құс фабрикасы
АҚ Өскемен құс фабрикасы Приготовление бетонной смеси
Приготовление бетонной смеси 20200119_oksidy
20200119_oksidy Универсальные учебные действия. Презентация для воспитателей.
Универсальные учебные действия. Презентация для воспитателей. Детская лига ЛФЛ
Детская лига ЛФЛ Офисные/учебные компьютеры
Офисные/учебные компьютеры Переживания горя. Посттравматическое стрессовое расстройство. Дебрифинг
Переживания горя. Посттравматическое стрессовое расстройство. Дебрифинг Презентации
Презентации презентация к уроку Животный мир Австралии
презентация к уроку Животный мир Австралии Евротоннель, тоннель под Ла-Маншем
Евротоннель, тоннель под Ла-Маншем Уравнения математической физики. Краевые задачи для уравнений параболического типа
Уравнения математической физики. Краевые задачи для уравнений параболического типа Сравнение тактико-технических характеристик стрелкового оружия ВОВ
Сравнение тактико-технических характеристик стрелкового оружия ВОВ Обязательное Страхование Автогражданской Ответственности
Обязательное Страхование Автогражданской Ответственности Задержка мочеиспускания
Задержка мочеиспускания Анализ эффективности применения деэмульгаторов СНПХ-4810А и Реапон-ИК для борьбы с образованием водонефтяных эмульсий
Анализ эффективности применения деэмульгаторов СНПХ-4810А и Реапон-ИК для борьбы с образованием водонефтяных эмульсий презентация Раздел патриотического воспитания в музее
презентация Раздел патриотического воспитания в музее Фестиваль кошек в Санкт-Петербурге
Фестиваль кошек в Санкт-Петербурге lesson 29
lesson 29 Электродвижущая сила. Закон Ома для полной цепи
Электродвижущая сила. Закон Ома для полной цепи Технология очистки скважин от асфальто-смолопарафиновых отложений
Технология очистки скважин от асфальто-смолопарафиновых отложений Анализ тенденций развития валютного рынка
Анализ тенденций развития валютного рынка Орталық жүйке жүйесі. Жұлын. Жұлынның сегментарлық және өткізгіштік аппараты
Орталық жүйке жүйесі. Жұлын. Жұлынның сегментарлық және өткізгіштік аппараты Презентация Выпускной в начальной школе 4 класс
Презентация Выпускной в начальной школе 4 класс