Содержание
- 2. Цель урока: Рассмотреть 1. Электронное строение атома железа, дать общую характеристику его. 2. Физические и химические
- 3. Нахождение в природе Метеоритное железо
- 4. Природные соединения железа Fe FeS Пирит (железный или серный колчедан) FeCO3 Сидерит Fe2O3.3H2O Лимонит (бурый железняк)
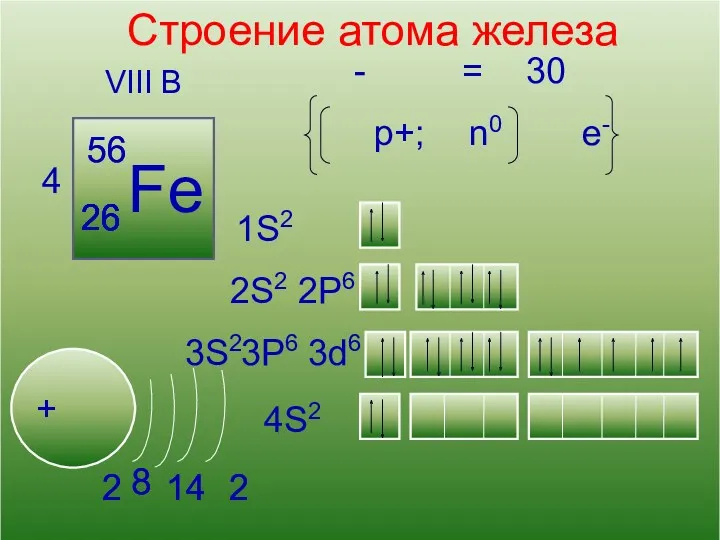
- 6. 13 Кислород Строение атома железа VIII B 4 Fe + 56 26 2S2 1S2 2P6 3S2
- 7. Физические свойства железа Серебристо-серый, мягкий металл, обладает хорошей пластичностью, ковкостью и способностью к намагничиванию. Плотность 7,864г/см3,
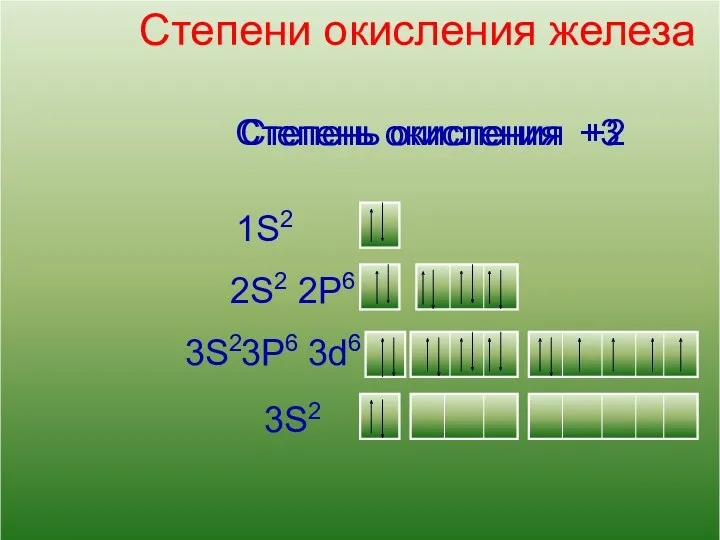
- 8. 13 Кислород Степени окисления железа 2S2 1S2 2P6 3S2 3d6 3P6 3S2 Степень окисления +2 Степень
- 9. Степени окисления Fe0 +2 +2; +3; +3 S HCl(раз) O2 H2O Cl2 HNO3 H2SO4(раз)
- 10. Получение железа FeO + C = Fe + CO t˚ Fe3O4 + 4CO = 3Fe +
- 11. Химические свойства железа Взаимодействие железа с кислородом: Fe + O2 = Fe3O4 (FeO.Fe2O3) 3 2
- 12. Химические свойства железа Взаимодействие железа с хлором: Fe + Cl2 = FeCl3 2 3 2
- 13. Химические свойства При нагревании Fe +S =FeS При очень высокой температуре 4Fe + 3C =Fe4C3 4Fe
- 14. Химические свойства Fe + CuSO4 = Cu + FeSO4 Fe + 2HClр = FeCl2 + H2
- 15. При нагревании 2Fe+6H2SO4=Fe2(SO4)3+3SO2+6H2O конц Fe+6HNO3=Fe(NO3)3+ 3NO2+ 3H2O конц
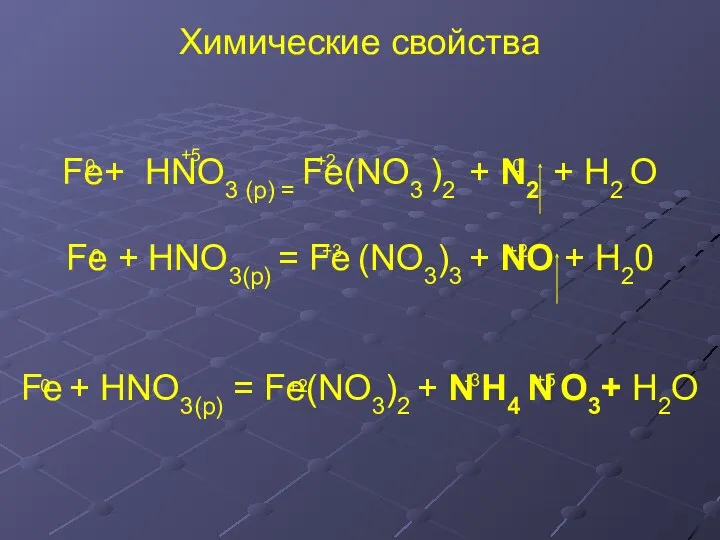
- 16. Химические свойства Fe+ HNO3 (p) = Fe(NO3 )2 + N2 + H2 O Fe + HNO3(р)
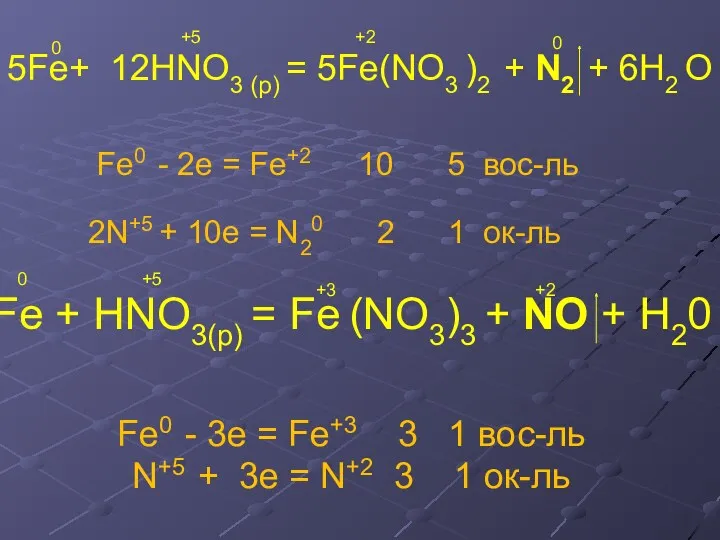
- 17. 5Fe+ 12HNO3 (p) = 5Fe(NO3 )2 + N2 + 6H2 O Fe0 - 2e = Fe+2
- 18. Fe0 - 2e = Fe+2 8 4 N+5 + 8e = N-3 2 1 ок-ль Fe
- 19. Качественные реакции на катионы железа K3[Fe(CN)6]—красная кровяная соль K4[Fe(CN)6]– желтая кровяная соль FeCl2+K3[Fe(CN)6]= KFe[Fe(CN)6] +KCl синий
- 20. Применение Магнитный, красный, бурый железняки –для производства черной металлургии (чугуна и стали) Железный колчедан – для
- 21. Железо необходимо для нашего организма Соединение железа издавна применяют для лечения малокровия, при истощении, упадке сил.
- 22. 1. Сколько d электронов содержит атом железа? 1) 26 2) 8 3) 6 4) 56 2.
- 23. 1. Сколько электронов содержит атом железа? 26 2) 8 3) 4 4) 56 2. При взаимод.
- 24. Домашнее задание Параграф 14 Упр 4
- 26. Скачать презентацию













![Качественные реакции на катионы железа K3[Fe(CN)6]—красная кровяная соль K4[Fe(CN)6]– желтая](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/467493/slide-18.jpg)





 Инновационные технологии
Инновационные технологии Презентация классного руководителя, часть 2
Презентация классного руководителя, часть 2 Боги и люди в Синтоизме
Боги и люди в Синтоизме Потенциальная помехоустойчивость. Лекции №3
Потенциальная помехоустойчивость. Лекции №3 Слет МС и МР на Б/о Кичигино ООО Газпром трансгаз Екатеринбург. Мероприятия на 2018 год
Слет МС и МР на Б/о Кичигино ООО Газпром трансгаз Екатеринбург. Мероприятия на 2018 год Выступление на педсовете. Презентация. Повышение качества знаний
Выступление на педсовете. Презентация. Повышение качества знаний Презентация: Дополнительная образовательная программа - аэробика.
Презентация: Дополнительная образовательная программа - аэробика. Петли быстрых планет. Марс, Венера
Петли быстрых планет. Марс, Венера Презентация Теоретический семинар Подготовка обучающихся к участию в олимпиадах
Презентация Теоретический семинар Подготовка обучающихся к участию в олимпиадах Атлас профессий Братского политехнического колледжа
Атлас профессий Братского политехнического колледжа Презентация Культовые сооружения Саратова
Презентация Культовые сооружения Саратова Презентация исследовательской работы Подвиг подольских курсантов
Презентация исследовательской работы Подвиг подольских курсантов Философия. Введение в курс
Философия. Введение в курс Виды компьютерных модемов
Виды компьютерных модемов Лазерные системы сигнализации на железнодорожных переездах
Лазерные системы сигнализации на железнодорожных переездах Микропроцессорные устройства для систем автоматического управления
Микропроцессорные устройства для систем автоматического управления Смольный институт благородных девиц
Смольный институт благородных девиц Домашние птицы. Для дошкольников
Домашние птицы. Для дошкольников Энергетический обмен
Энергетический обмен Российское движение школьников: опыт и перспективы
Российское движение школьников: опыт и перспективы История пилотки (презентация PowerPoint)
История пилотки (презентация PowerPoint) Презентация Реализация системно-деятельностного подхода в работе с детьми дошкольного возраста
Презентация Реализация системно-деятельностного подхода в работе с детьми дошкольного возраста Основные сведения о грунтоведении
Основные сведения о грунтоведении Методы проектирования образовательных программ и индивидуальных образовательных маршрутов обучающихся общеобразовательных школ
Методы проектирования образовательных программ и индивидуальных образовательных маршрутов обучающихся общеобразовательных школ The Beatles - британская рок-группа из Ливерпуля
The Beatles - британская рок-группа из Ливерпуля Датчики. Реле
Датчики. Реле Платежный баланс Статистическая система мирохозяйственных связей
Платежный баланс Статистическая система мирохозяйственных связей Развитие лексико - грамматического строя речи для детей (4 - 7 лет) презентация. Тема: Дикие животные наших лесов
Развитие лексико - грамматического строя речи для детей (4 - 7 лет) презентация. Тема: Дикие животные наших лесов