Влияние обновления EU GMP. Приложение 1 на стерильное производство в фармацевтической отрасли России презентация
Содержание
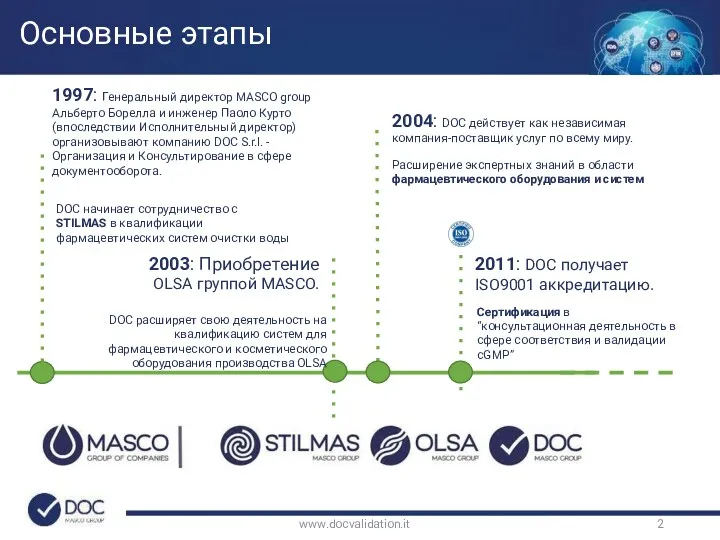
- 2. Основные этапы www.docvalidation.it 1997: Генеральный директор MASCO group Альберто Борелла и инженер Паоло Курто (впоследствии Исполнительный
- 3. Основные этапы www.docvalidation.it Биография Паоло Курто: Кандидат химических наук 30-летний опыт в таких сферах как: Директор
- 4. Основные этапы www.docvalidation.it Квалифицированный инструктор для регуляторов в: Румыния (ANM) Бразилия (ANVISA) Италия (AIFA) Греция (EOF)
- 5. Основные этапы www.docvalidation.it QMS в соответствии с ISO 9001
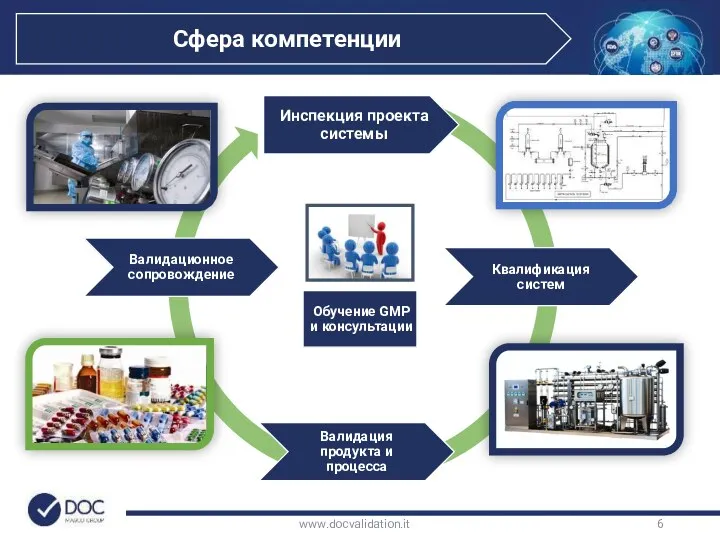
- 6. www.docvalidation.it Обучение GMP и консультации
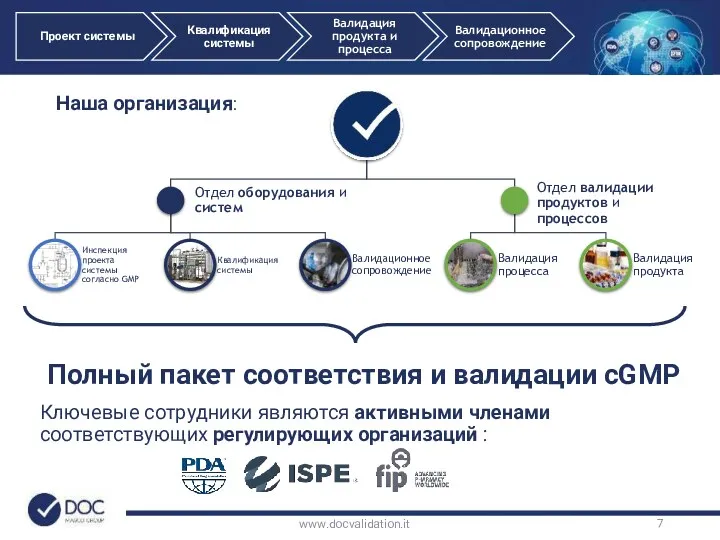
- 7. Ключевые сотрудники являются активными членами соответствующих регулирующих организаций : www.docvalidation.it Полный пакет соответствия и валидации cGMP
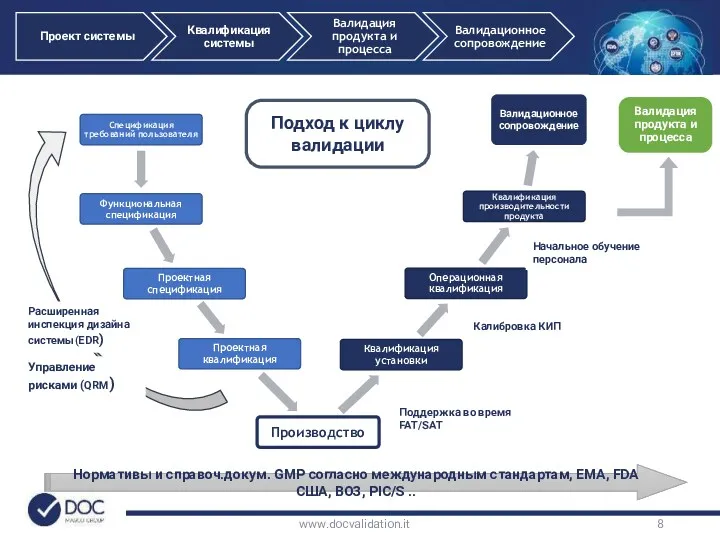
- 8. Нормативы и справоч.докум. GMP согласно международным стандартам, EMA, FDA США, ВОЗ, PIC/S .. Подход к циклу
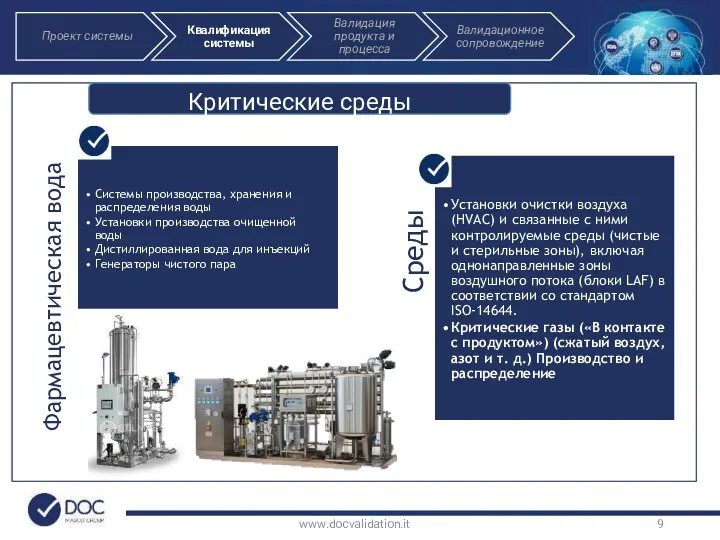
- 9. Критические среды www.docvalidation.it
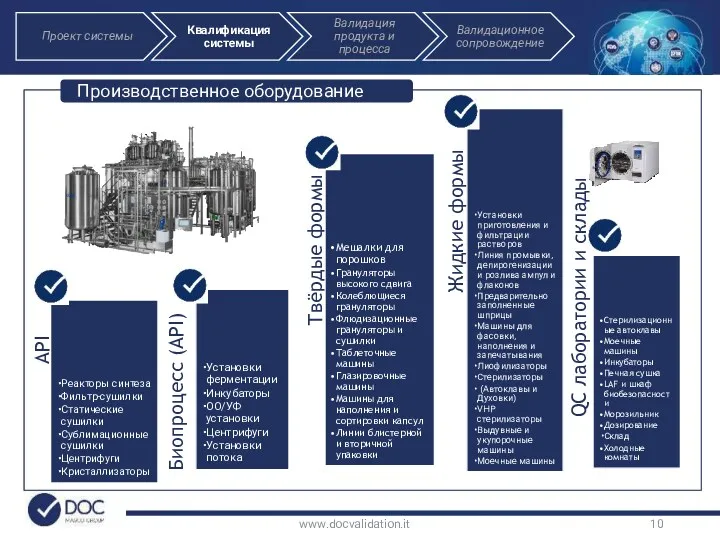
- 10. www.docvalidation.it Производственное оборудование
- 11. Валидация компьютерной системы: Оборудование и система www.docvalidation.it
- 12. Валидация компьютерной системы : Лабораторное ПО www.docvalidation.it
- 13. Целостность данных www.docvalidation.it
- 14. www.docvalidation.it Контактирующие материалы (Трубы, соединения, материалы для технологического оборудования, мешки и фильтры и одноразовые системы) Первичные
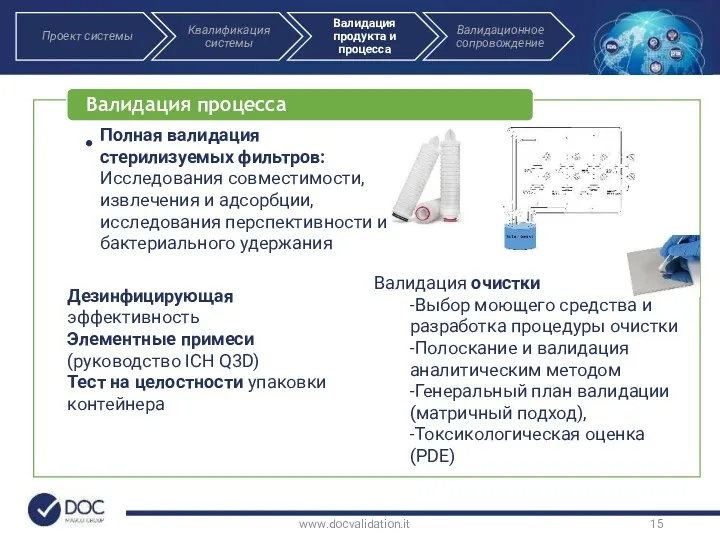
- 15. www.docvalidation.it Полная валидация стерилизуемых фильтров: Исследования совместимости, извлечения и адсорбции, исследования перспективности и бактериального удержания Валидация
- 16. www.docvalidation.it Микробное заражение и выявление штаммов (методы ПЦР и MALDI-TOF) Исследование неизвестных частиц и соединений (различные
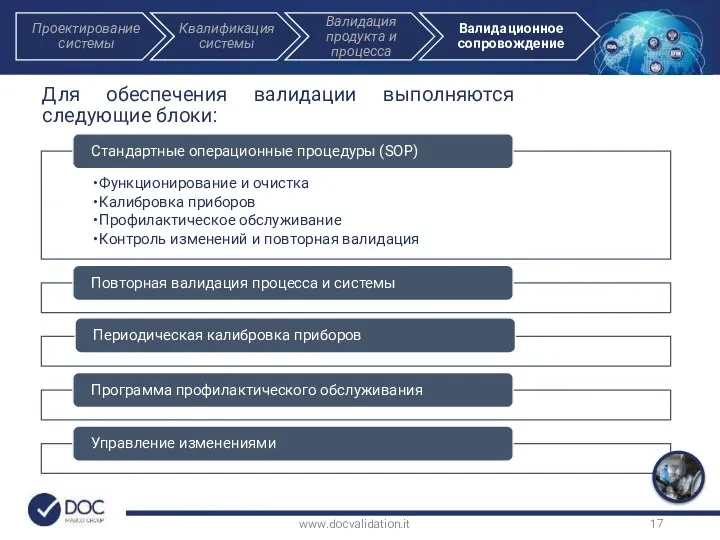
- 17. Для обеспечения валидации выполняются следующие блоки: www.docvalidation.it
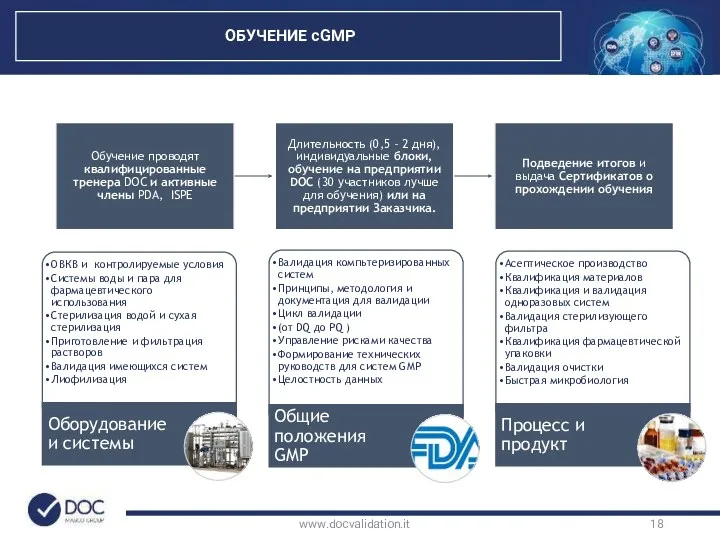
- 18. www.docvalidation.it ОБУЧЕНИЕ cGMP
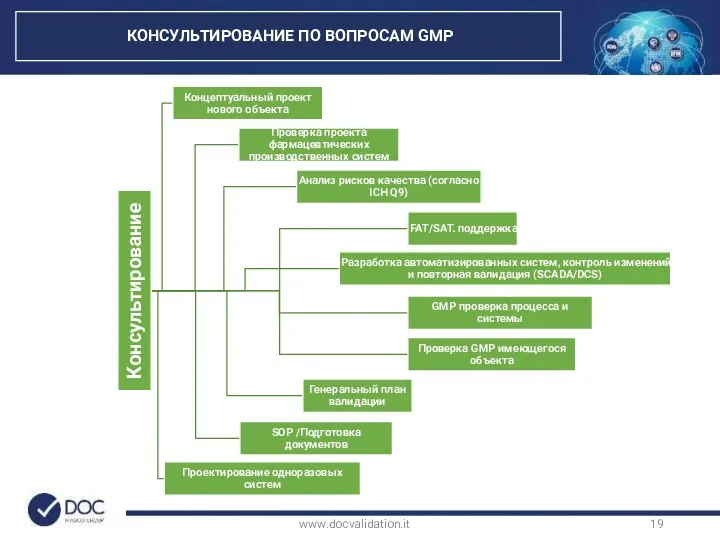
- 19. www.docvalidation.it КОНСУЛЬТИРОВАНИЕ ПО ВОПРОСАМ GMP
- 20. www.docvalidation.it Опыт работы DOC на территории РФ С 2012 года Квалификация: Чистые среды (ВО; ВДИ, Чистого
- 21. www.docvalidation.it С 2012 года DOC сотрубничает с компаниями
- 22. www.docvalidation.it Регионы подлежащие регулированию Европа: 28 членов США Япония Конвенция о сотрудничестве фармацевтических инспекций (PIC/S) :
- 23. www.docvalidation.it Регионы подлежащие регулированию Европа: EU GMP Vol.4 США: 21 CFR Часть 210-211 Япония GMP Конвенция
- 24. www.docvalidation.it EU GMP Приложение 1: Производство стерильных лекарственных препаратов PIC/S GMP Приложение 1= EU GMP WHO
- 25. www.docvalidation.it ПРИЛОЖЕНИЕ1-EU
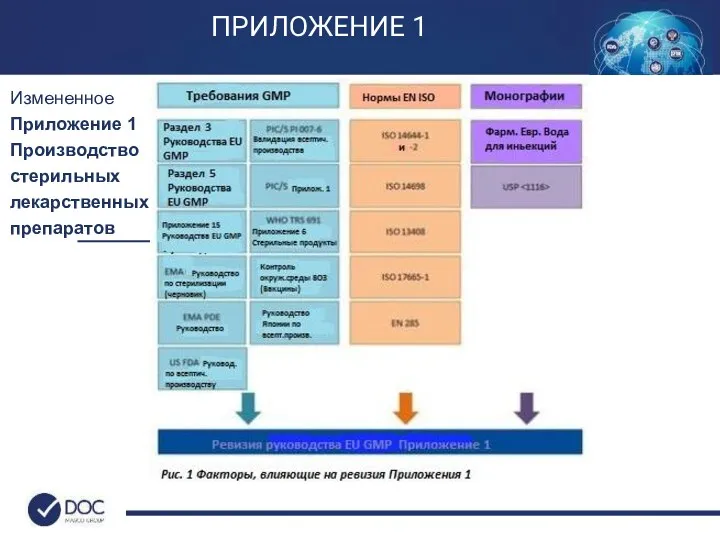
- 26. Измененное Приложение 1 (Ревизия в 2012 г.) Производство стерильных лекарственных препаратов (Предвар. версия декабрь 2017) Основные
- 27. Измененное Приложение 1 Производство стерильных лекарственных препаратов ПРИЛОЖЕНИЕ 1
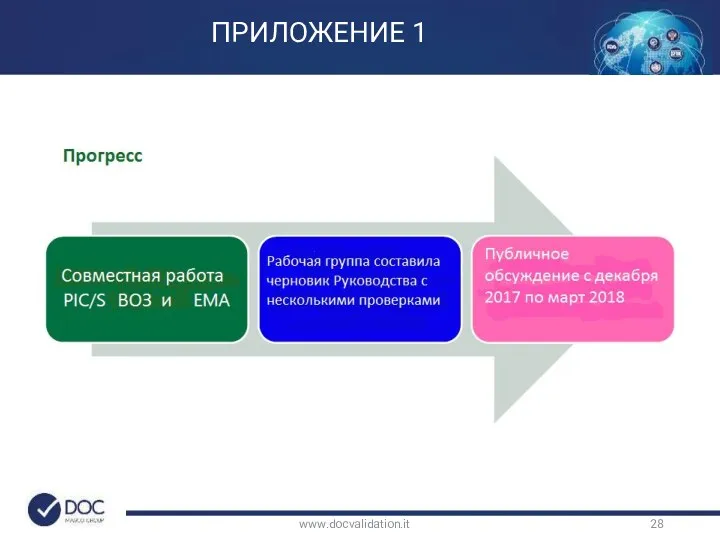
- 28. www.docvalidation.it ПРИЛОЖЕНИЕ 1
- 29. www.docvalidation.it ПРИЛОЖЕНИЕ 1 Текущий статус проекта документа Комментарии, более 6200 комментариев, в том числе от DOC
- 30. www.docvalidation.it ПРИЛОЖЕНИЕ 1
- 31. www.docvalidation.it ПРИЛОЖЕНИЕ 1
- 32. Обновление Приложения 1 (проект) Производство Стерильной Медицинской Продукции Содержание ПРИЛОЖЕНИЕ 1
- 33. www.docvalidation.it ПРИЛОЖЕНИЕ 1
- 34. www.docvalidation.it ПРИЛОЖЕНИЕ 1
- 35. www.docvalidation.it ПРИЛОЖЕНИЕ 1
- 36. www.docvalidation.it ПРИЛОЖЕНИЕ 1
- 37. www.docvalidation.it ПРИЛОЖЕНИЕ 1
- 38. www.docvalidation.it Приложение 1-PDA Дублинского конгресса от 3 мая , 2019-Заключения TheКомментарии к проекту Приложения 1 были
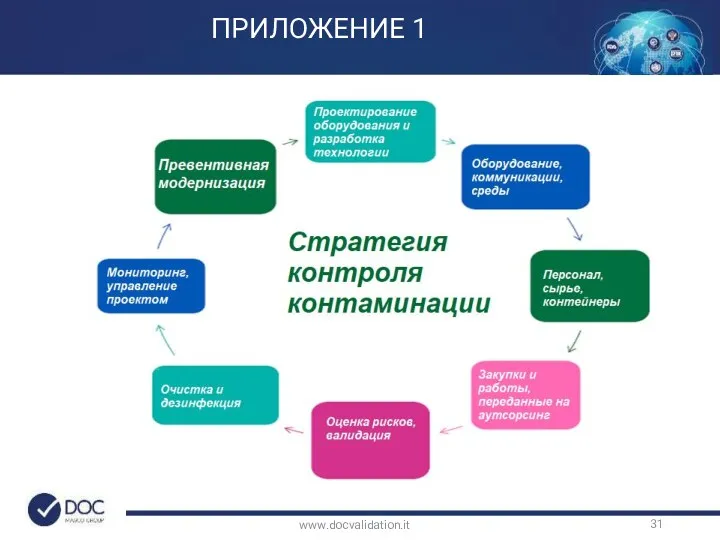
- 39. www.docvalidation.it 5. Стратегия контроля загрязнения направлена на то, чтобы определить концепцию подхода производства к контролю контаминации.
- 40. www.docvalidation.it 6. Самая большая проблема для реализации Приложения 1 - это управление рисками и внедрение риск
- 41. www.docvalidation.it ВЛИЯНИЕ ПРИЛОЖЕНИЯ 1 НА ПРОИЗВОДСТВО в РФ SID & GP представила обзор инспекции зарубежных фармацевтических
- 42. www.docvalidation.it ВЛИЯНИЕ ПРИЛОЖЕНИЯ 1 НА ПРОИЗВОДСТВО в РФ (продолжение.) Ежегодное Собрание ISPE 2018 в Риме по
- 43. www.docvalidation.it ВЛИЯНИЕ ПРИЛОЖЕНИЯ 1 НА ПРОИЗВОДСТВО в РФ (продолжение.) ЗАКЛЮЧЕНИЕ Пересмотренное Приложение 1 станет всемирно признанным
- 44. www.docvalidation.it ВЛИЯНИЕ ПРИЛОЖЕНИЯ 1 НА ПРОИЗВОДСТВО в РФ (продолжение.) ЗАКЛЮЧЕНИЕ Компания DOC может оказать поддержку российским
- 45. Вопросы / Ответы
- 47. Скачать презентацию






























 Административное право
Административное право Огнестрельные повреждения
Огнестрельные повреждения Государство. Теории происхождения государства. Признаки и функции государства
Государство. Теории происхождения государства. Признаки и функции государства Идентифицирование личности и составление психологического портрета
Идентифицирование личности и составление психологического портрета Договор: основание возникновения обязательств
Договор: основание возникновения обязательств Правосудие и его демократические принципы
Правосудие и его демократические принципы Общая информация о правительстве Республики Корея
Общая информация о правительстве Республики Корея Правоотношения и субъекты права
Правоотношения и субъекты права Памятка. ЕГЭ по обществознанию
Памятка. ЕГЭ по обществознанию Родительское собрание на тему: Родительство
Родительское собрание на тему: Родительство Қазақстан Республикасы Әділет Министрлігі
Қазақстан Республикасы Әділет Министрлігі Законодательно-правовое и нормативное обеспечение безопасности и качества. Защита прав потребителей
Законодательно-правовое и нормативное обеспечение безопасности и качества. Защита прав потребителей Формирование архивного Фонда Российской Федерации Муниципальное казенное учреждение Архив Уярского района
Формирование архивного Фонда Российской Федерации Муниципальное казенное учреждение Архив Уярского района Правовая охрана программ и данных
Правовая охрана программ и данных Защита интеллектуальной собственности. Авторское право и СМИ
Защита интеллектуальной собственности. Авторское право и СМИ Семейное право
Семейное право Гражданин России
Гражданин России Конституция РФ - основной закон страны
Конституция РФ - основной закон страны Виды обеспечений обязательств. Неустойки, штрафы, пени. Санкции за нарушение условий контракта по 44-ФЗ
Виды обеспечений обязательств. Неустойки, штрафы, пени. Санкции за нарушение условий контракта по 44-ФЗ Особенности правового статуса руководителя организации
Особенности правового статуса руководителя организации Осуществление правосудия в судебной системе Германии
Осуществление правосудия в судебной системе Германии Скрипты по работе с запросами (возражениями) пассажиров в пути следования
Скрипты по работе с запросами (возражениями) пассажиров в пути следования Понятие, задачи и принципы уголовного права. Тема 1
Понятие, задачи и принципы уголовного права. Тема 1 Территориальная целостность России, уважение прав её населения и соседних народов
Территориальная целостность России, уважение прав её населения и соседних народов Форма правления в зарубежных странах
Форма правления в зарубежных странах Антимонопольное регулирование создания и деятельности корпораций
Антимонопольное регулирование создания и деятельности корпораций Международные стандарты государственного управления в области противодействия коррупции
Международные стандарты государственного управления в области противодействия коррупции Права детей
Права детей