Содержание
- 2. Отличия ферментов от небиологических катализаторов Удивительная эффективность ферментов Число оборотов некоторых ферментов
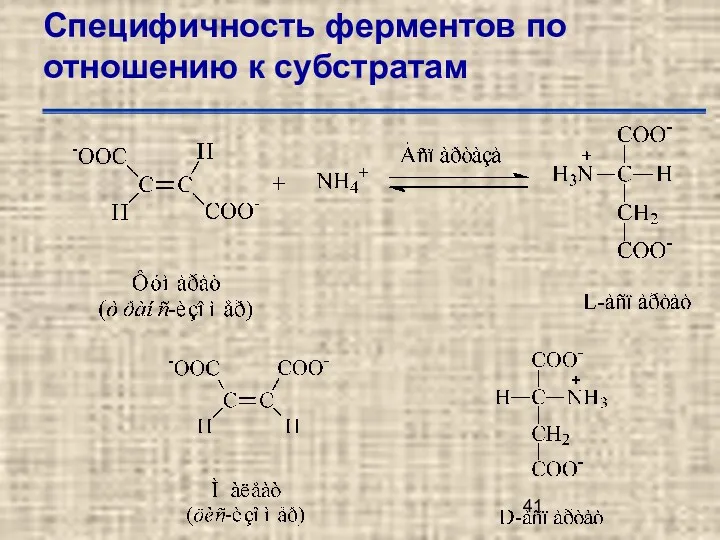
- 3. Отличия ферментов от небиологических катализаторов Ферменты обладают высокой субстратной специфичностью Ферменты обладают высокой специфичностью к типу
- 4. Отличия ферментов от небиологических катализаторов Составные ферменты: белковая часть обеспечивает связывание субстрата, а катализ осуществляют небелковые
- 5. Коферменты и витамины Витаминами можно назвать некую группу низкомолекулярных органических соединений различной химической природы, необходимых для
- 6. Коферменты и витамины Если несколько соединений близкой химической природы выполняют одну и ту же витаминную функцию
- 7. Коферменты и витамины Собственно витамины — это соединения, выполняющие свою витаминную роль самостоятельно. Витамины-коферменты — соединения,
- 8. Коферменты и витамины Следует выделить отдельно группу коферментов, т.е. тех соединений, которые образованы из соответствующих витаминов
- 9. Коферменты и витамины
- 10. Коферменты и витамины
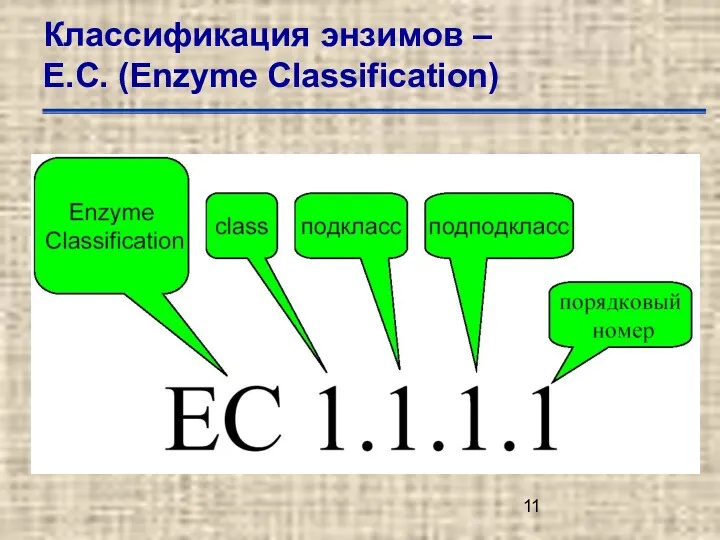
- 11. Классификация энзимов – Е.С. (Enzyme Classification)
- 12. Классификация энзимов – Е.С. (Enzyme Classification) Е.С.1. – оксидоредуктазы (oxidoreductases). Е.С.2. – трансферазы (transferases). Е.С.3. –
- 13. Оксиредуктазы Дегидрогеназы (редуктазы) Оксидазы Пероксидазы Гидроксилазы Оксигеназы Гидрогеназы
- 14. Оксиредуктазы Е.С.1.1. – действует на СН-ОН функцию Е.С.1.2. – действует на альдегидную группу Е.С.1.3. – действует
- 15. Оксиредуктазы Е.С.1.1.1. – NAD+ или NADP+ Е.С.1.1.2. – цитохромом Е.С.1.1.3. – кислородом Е.С.1.1.4. – дисульфидом Е.С.1.1.5.
- 16. Оксиредуктазы Е.С.1.1.1.1. – алкоголь дегидрогеназа NAD+ Е.С.1.1.1.2. – алкоголь дегидрогеназа NADP+ …………………………………………………. Е.С.1.1.1.27 – L-лактат дегидрогеназа
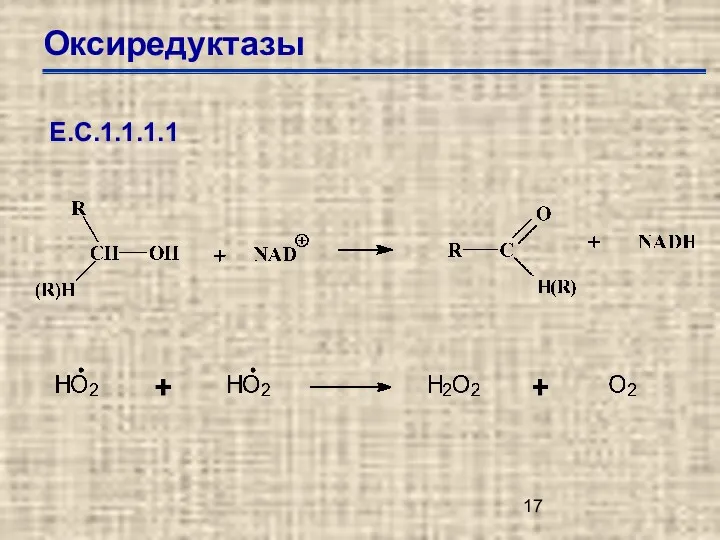
- 17. Оксиредуктазы Е.С.1.1.1.1
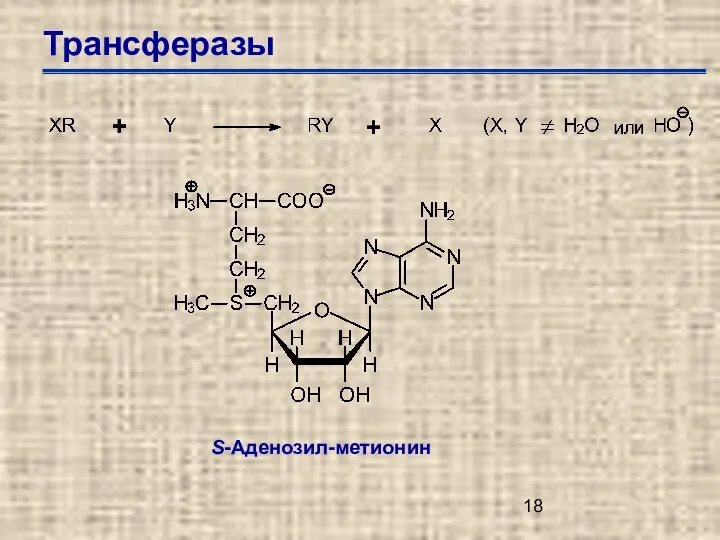
- 18. Трансферазы S-Аденозил-метионин
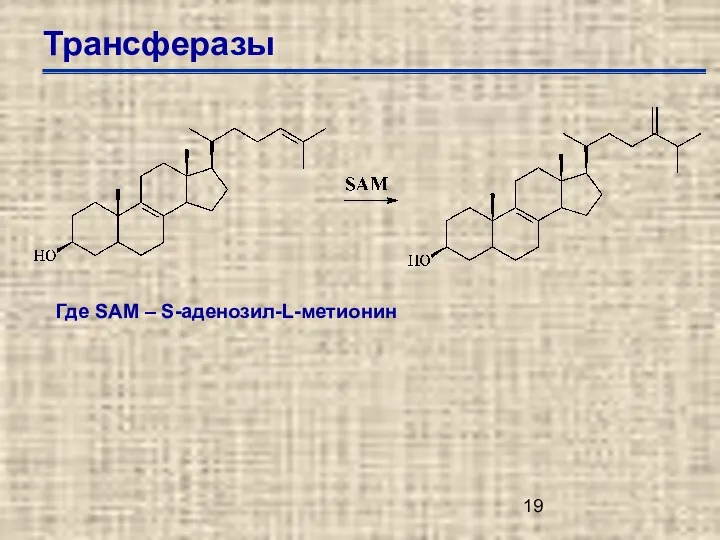
- 19. Трансферазы Где SAM – S-аденозил-L-метионин
- 20. Трансферазы Е.С.2.1. – переносчики одно-углеродной группы Е.С.2.2. – переносчики карбонильных функций Е.С.2.3. – ацетилтрансферазы Е.С.2.4. –
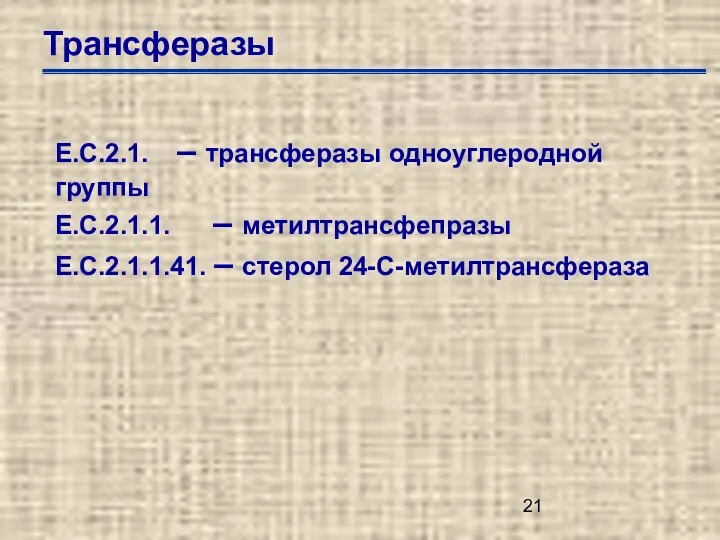
- 21. Трансферазы Е.С.2.1. – трансферазы одноуглеродной группы Е.С.2.1.1. – метилтрансфепразы Е.С.2.1.1.41. – стерол 24-С-метилтрансфераза
- 22. Гидролазы Протеазы – гидролизуют белки Нуклеазы – гидролизуют нуклеиновые кислоты Специфические эндонуклеазы (так называемые рестриктазы) –
- 23. Гидролазы Е.С.3.1. – действуют на сложноэфирные связи, эстеразы Е.С.3.2. – гликозилазы Е.С.3.3. – действуют на простоэфирные
- 24. Гидролазы Е.С.3.1 гидролазы действующие на сложноэфирную связь Е.С.3.1.1. гидролазы эфиров карбоновых кислот Е.С.3.1.1.1 карбоксилэстеразы RCOOR1 +
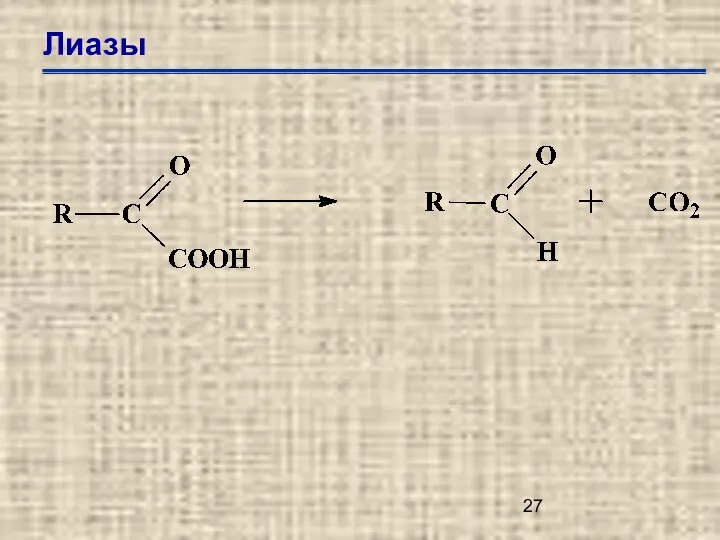
- 25. Лиазы Е.С.4.1. – углерод-углеродные лиазы Е.С.4.2. – углерод-кислородные лиазы Е.С.4.3. – углерод-азотные лиазы Е.С.4.4. – углерод-серы
- 26. Лиазы Е.С.4.1.1. – карбокси лиазы Е.С.4.1.2. – альдегид лиазы Е.С.4.1.3. – оксо-кислотные лиазы Е.С.4.1.99. – другие
- 27. Лиазы
- 28. Изомеразы Е.С.5.1. – рацемазы и эпимеразы Е.С.5.2. – цис-трас-изомеразы Е.С.5.3. – внутримолекулярные оксидоредуктазы Е.С.5.4. – внутримолекулярные
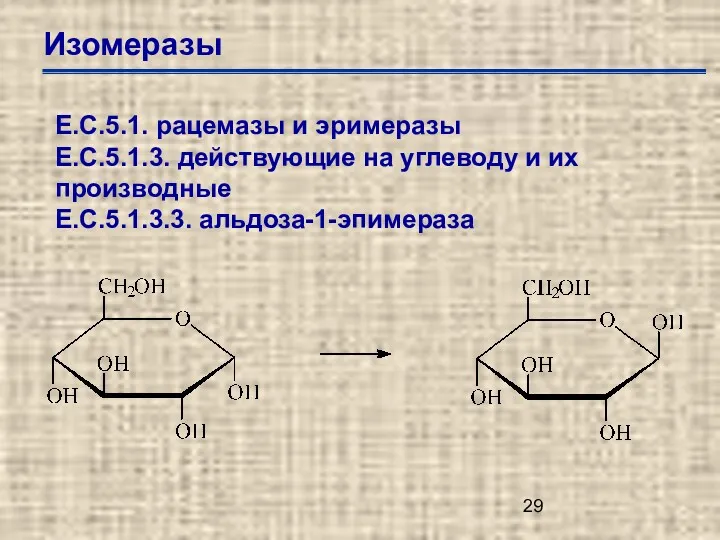
- 29. Изомеразы Е.С.5.1. рацемазы и эримеразы Е.С.5.1.3. действующие на углеводу и их производные Е.С.5.1.3.3. альдоза-1-эпимераза
- 30. Лигазы (синтетазы) Е.С.6.1. – образуют углерод-кислородные связи Е.С.6.2. – образуют углерод-сера связи Е.С.6.3. – образуют углерод-азотные
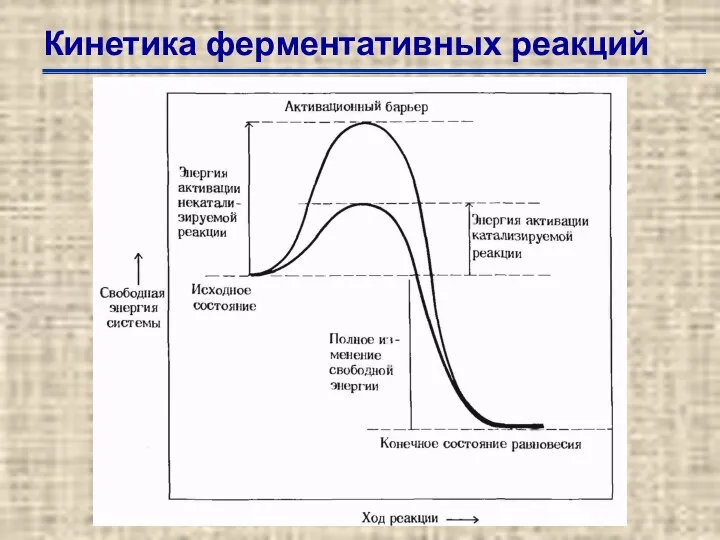
- 31. Кинетика ферментативных реакций
- 32. Кинетика ферментативных реакций Влияние концентрации субстрата на начальную скорость катализируемой ферментом реакции. Из такого графика можно
- 33. Кинетика ферментативных реакций Виктор Генри (1903 г.) Леонор Михаэлис, Мод Ментен (1913 г.)
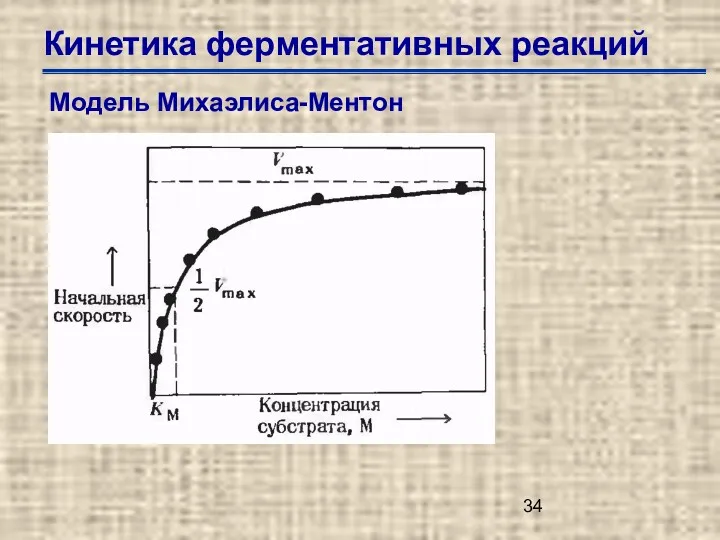
- 34. Кинетика ферментативных реакций Модель Михаэлиса-Ментон
- 35. Кинетика ферментативных реакций Модель Михаэлиса-Ментон Км (константа Михаэлиса-Ментен) –концентрация специфического субстрата, при которой данный фермент обеспечивает
- 36. Кинетика ферментативных реакций Модель Михаэлиса-Ментон Уравнение Михаэлиса-Ментен где v0 начальная скорость при концентрации субстрата [S], Vmax
- 37. Кинетика ферментативных реакций Модель Михаэлиса-Ментон
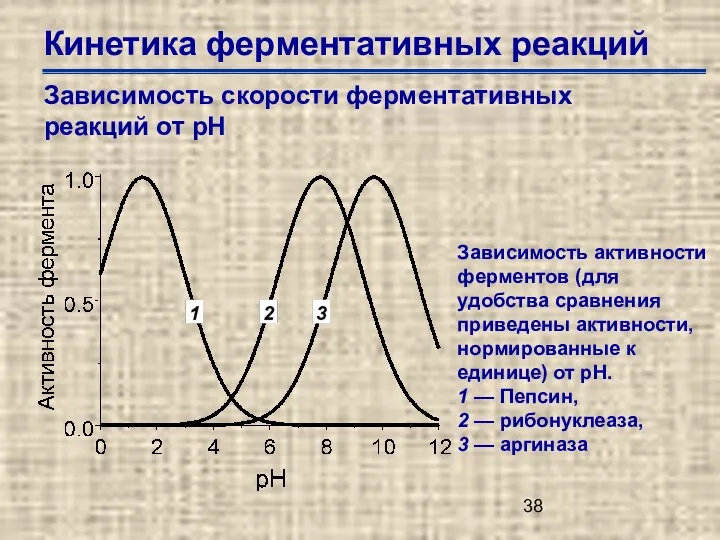
- 38. Кинетика ферментативных реакций Зависимость скорости ферментативных реакций от рН Зависимость активности ферментов (для удобства сравнения приведены
- 39. Кинетика ферментативных реакций Зависимость скорости ферментативных реакций от рН Оптимальные значения рН для некоторых ферментов
- 40. Кинетика ферментативных реакций Количество фермента можно определить по его активности За единицу активности фермента принимается такое
- 41. Специфичность ферментов по отношению к субстратам
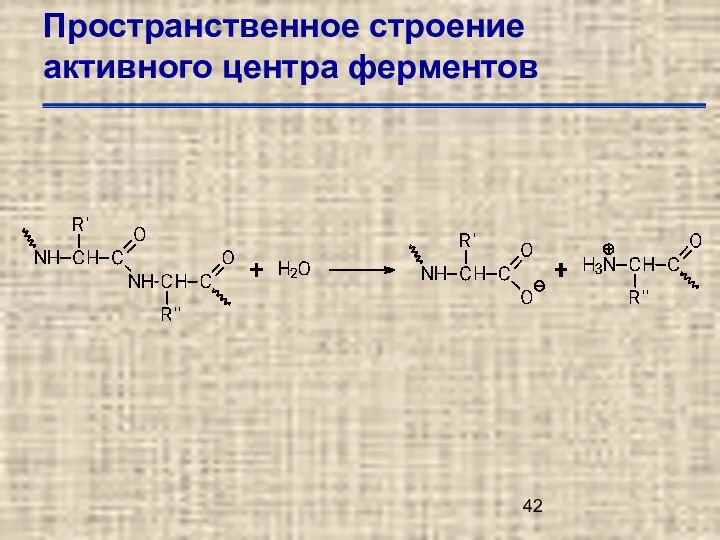
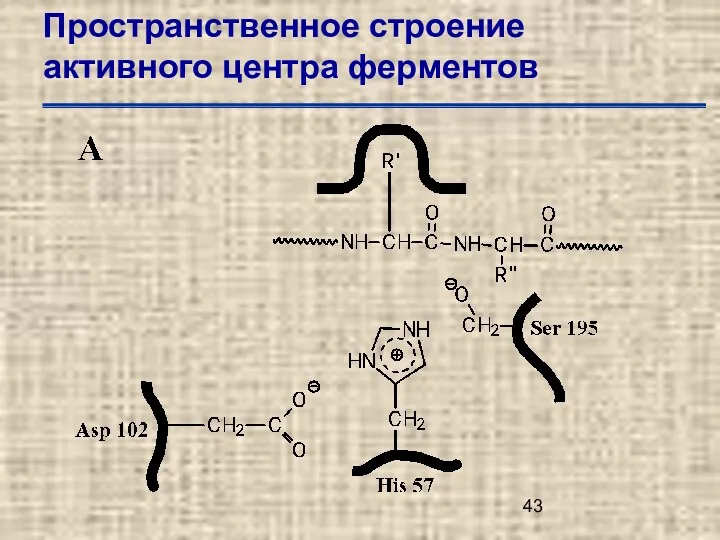
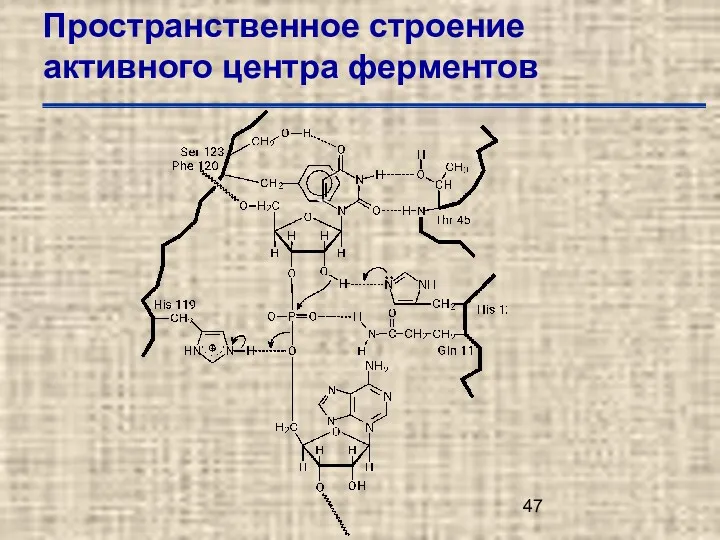
- 42. Пространственное строение активного центра ферментов
- 43. Пространственное строение активного центра ферментов
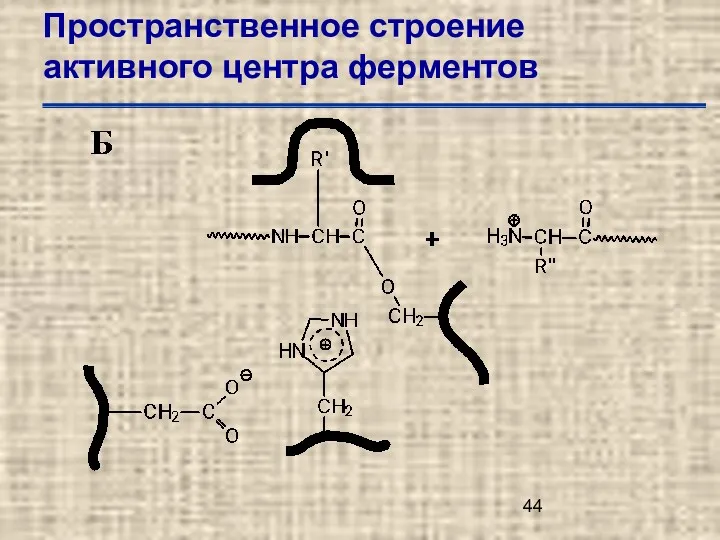
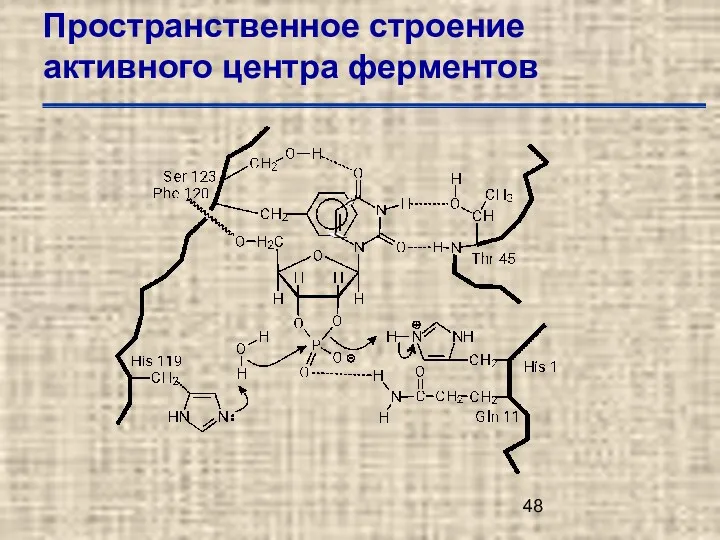
- 44. Пространственное строение активного центра ферментов
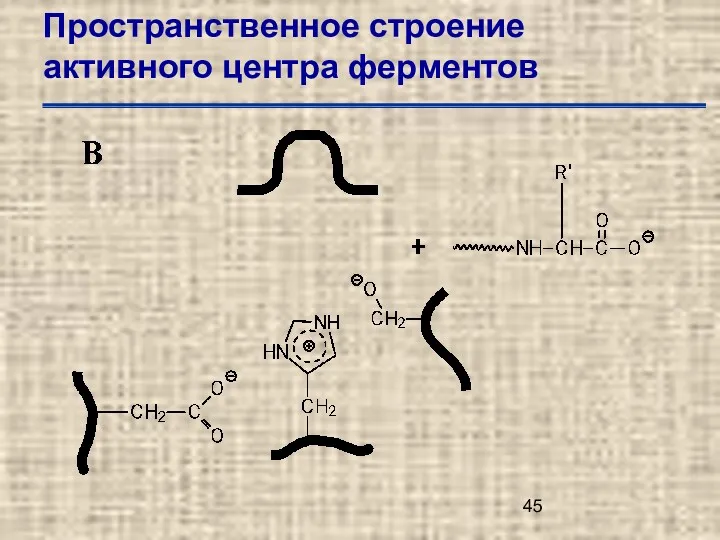
- 45. Пространственное строение активного центра ферментов
- 46. Пространственное строение активного центра ферментов
- 47. Пространственное строение активного центра ферментов
- 48. Пространственное строение активного центра ферментов
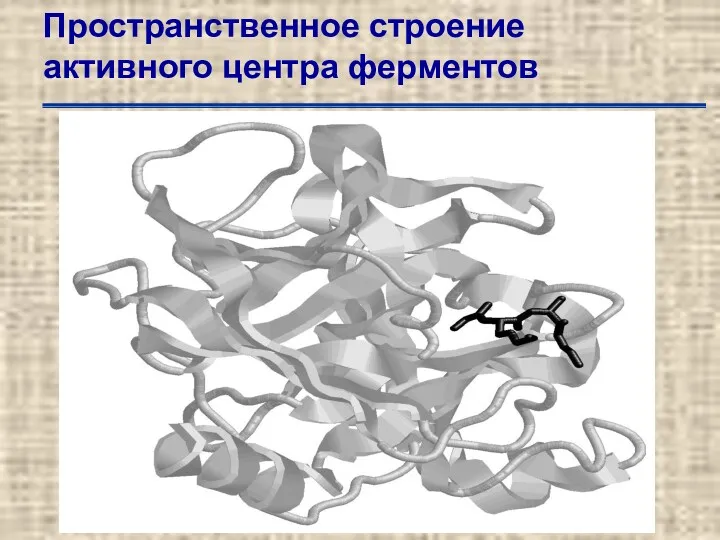
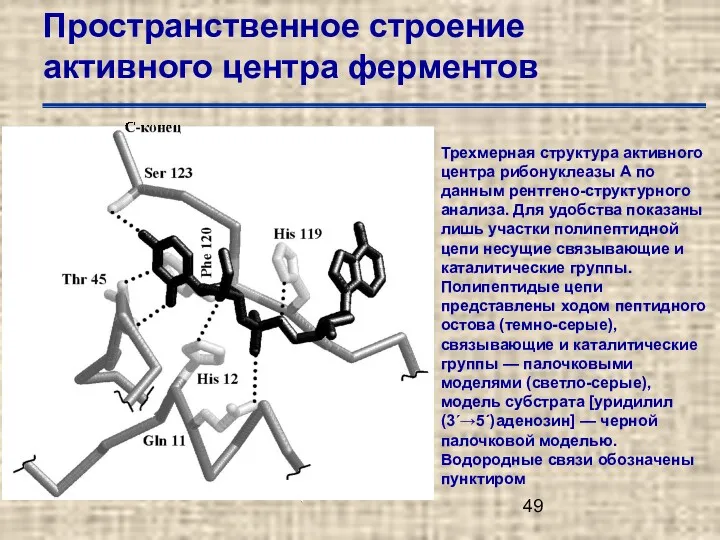
- 49. Пространственное строение активного центра ферментов Трехмерная структура активного центра рибонуклеазы А по данным рентгено-структурного анализа. Для
- 50. Пространственное строение активного центра ферментов Укладка субстрата [аденилил(3´→5´)уридилил (3´→ 5´)аденилил(3´→5´) аденозина] в третичной структуре фермента
- 52. Скачать презентацию





























![Пространственное строение активного центра ферментов Укладка субстрата [аденилил(3´→5´)уридилил (3´→ 5´)аденилил(3´→5´) аденозина] в третичной структуре фермента](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/184450/slide-49.jpg)
 Разнообразие организмов и их классификация
Разнообразие организмов и их классификация Минеральное питание
Минеральное питание Класс Насекомые. Внешнее строение майского жука
Класс Насекомые. Внешнее строение майского жука Vitamins. Classes of Vitamins
Vitamins. Classes of Vitamins Дыхание растений
Дыхание растений Химический состав клетки. Тема: Углеводы, липиды
Химический состав клетки. Тема: Углеводы, липиды Голосеменные растения
Голосеменные растения Лабораторная диагностика стафилококковой инфекции
Лабораторная диагностика стафилококковой инфекции Морские животные. Тип мягкотелые
Морские животные. Тип мягкотелые Борьба за существование и ее формы
Борьба за существование и ее формы Слюнные железы
Слюнные железы Московский зоопарк
Московский зоопарк Презентация к урокубиологии 9 класс Естественные сообщества живых организмов. Биогеоноценозы
Презентация к урокубиологии 9 класс Естественные сообщества живых организмов. Биогеоноценозы 20231213_8_klass_chlenistonogie
20231213_8_klass_chlenistonogie Мышцы туловища
Мышцы туловища Бактерії. Корисні та шкідливі
Бактерії. Корисні та шкідливі Мир живых организмов. Уровни организации живого
Мир живых организмов. Уровни организации живого Класс паукообразные
Класс паукообразные Хищные растения
Хищные растения Природа. Живая и неживая природа
Природа. Живая и неживая природа Аминокислоты. Определение молекулярной формулы органического вещества
Аминокислоты. Определение молекулярной формулы органического вещества Клетки растений
Клетки растений Открытый урок по экологии с презентацией
Открытый урок по экологии с презентацией Мир животных. Викторина
Мир животных. Викторина Структура ОГЭ по биологии
Структура ОГЭ по биологии Феноменальные возможности животных
Феноменальные возможности животных Основы аграрных технологий. 7 класс
Основы аграрных технологий. 7 класс Явление хемосинтеза
Явление хемосинтеза