Содержание
- 2. Значение постоянства рН в организме Изменение активной реакции среды крови приводит к серьезным нарушениям жизнедеятельности организма
- 3. Буферные системы Растворы, обладающие свойством достаточно стойко сохранять постоянное значение активной реакции среды как при добавлении
- 4. Классификация буферных систем Буферные системы кислотного типа (слабая кислота и соль этой кислоты и слабого основания)
- 5. Анионы многоосновных кислот (анионы кислой и средней или двух кислых солей) HPO42-/H2PO4- – фосфатный буфер Ионы
- 6. Вывод формулы рН буферных систем В растворе имеет место равновесие CH3COOH ⮀ H+ + CH3COO- [H+][CH3COO-]
- 7. Cкислоты [H+] = КД ---------------- моль/л Cсоли Cкислоты рН = -lg[H+] = - lgКД – lg
- 8. Анализ уравнения Гендерсона-Гассельбаха рН буферной системы зависит от: Константы диссоциации слабой кислоты рКа или основания рКв
- 9. Механизм действия буферных систем CH3COOH + CH3COONa CH3COONa + HCI = CH3COOH + NaCI Кислота нейтрализуется
- 10. Эффективность буферных систем При добавлении больших количеств кислот и щелочей меняется соотношение кислота/соль и меняется рН
- 11. Буферная емкость (В) Количество молей эквивалентов сильной кислоты или основания, которое необходимо добавить к 1 литру
- 12. Буферная емкость зависит от: Абсолютной концентрации компонентов буферной системы От соотношения между этими концентрациями Наибольшей буферной
- 13. Пример Имеем два ацетатных буфера, концентрация компонентов в одном составляет 10 мг-экв, а в другом 100
- 14. Рабочий участок буферной системы Значение рН, при котором сохраняются свойства буферной системы (рН = рК ±
- 15. Буферные системы организма Гидрокарбонатная Белковая Гемоглобиновая-оксигемоглобиновая Фосфатная Аминокислотная
- 16. Буферные системы плазмы крови Гидрокарбонатная буферная система H2CO3 + NaHCO3 Является первой по значимости; составляет в
- 17. Ее особенности в организме Действие тесно связано с функцией дыхания организма Один из компонентов буферной системы
- 18. Уравнение Гендерсона-Гассельбаха для гидрокарбонатного буфера: [HCO3-] pH = рК(H2CO3) + lg-------------; [H2CO3] [HCO3-] рН = рК(H2CO3)
- 19. Механизм действия HCO3-/H2CO3 В случае накопления кислот в крови расходуется NaHCO3: HCO3- + H+ → H2CO3
- 20. Механизмы регуляции дыхания стабилизируют буферное соотношение в гидрокарбонатном буфере. Чувствительность дыхательного центра к изменению рН очень
- 21. Белковая буферная система Составляет в плазме 7% буферной емкости крови. R – CH – COOH |
- 22. Белок-основание R – CH – COO- + H+ → R – CH – COO- | |
- 23. Фосфатная буферная система Na2HPO4 + NaH2PO4 Концентрация ее компонентов в плазме невелика (фосфаты выводятся с мочой).
- 24. Буферные системы эритроцитов Гемоглобиновый-оксигемоглобиновый буфер Составляет 35% буферной емкости крови HHb ⮀ H+ + Hb- (рК
- 25. Связь с дыханием HHb + O2 → HHbO2 В легких CO2: Кровь → легкие HHbO2 →
- 26. Кооперативность действия буферных систем крови Фосфатная буферная система проявляет кооперативность действия с гидрокарбонатной буферной системой. Если
- 27. Кислотно-основное равновесие Соотношение кислотных и основных свойств крови
- 28. Показатели кислотно-основного состояния крови рН крови (7,4 ± 0,05) Парциальное давление CO2 p CO2 = 40
- 29. Резервная щелочность крови Способность крови связывать CO2 Она определяется количеством CO2, связанной в виде гидрокарбонатов. Определяют
- 30. Нарушения К-О равновесия Уменьшение емкости буферных систем крови по кислоте (ацидоз) или по щелочи (алкалоз) Причины:
- 31. Виды нарушений К-О равновесия Компенсированный ацидоз Некомпенсированный ацидоз Компенсированный алкалоз Некомпенсированный алкалоз
- 33. Скачать презентацию
 Экологические аспекты производства биопрепаратов
Экологические аспекты производства биопрепаратов Биомеханика как наука
Биомеханика как наука Транспортные системы организма
Транспортные системы организма Происхождение жизни: ПНК как предшественники РНК
Происхождение жизни: ПНК как предшественники РНК Тип Хордовые
Тип Хордовые белки-строение и функции
белки-строение и функции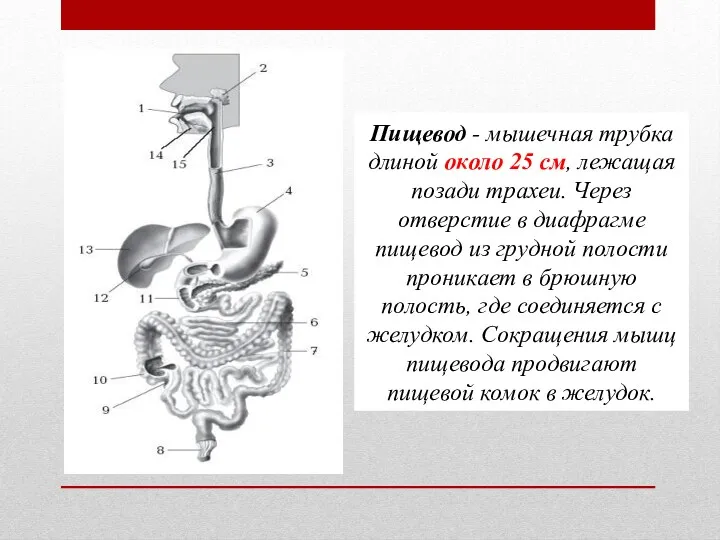 Устройство пищевода
Устройство пищевода Паукообразные. Разновидности паукообразных
Паукообразные. Разновидности паукообразных Cellular Respiration
Cellular Respiration Тип Кольчатые черви
Тип Кольчатые черви Голонасінні рослини
Голонасінні рослини Презентация по биологии Становление наук о человеке для 8 класса.
Презентация по биологии Становление наук о человеке для 8 класса. Насекомые. Основные признаки насекомого
Насекомые. Основные признаки насекомого Иммуноферментный анализ (ИФА)
Иммуноферментный анализ (ИФА) Анатомия центральной нервной системы. Головной мозг
Анатомия центральной нервной системы. Головной мозг Эволюционная теория Чарльза Дарвина
Эволюционная теория Чарльза Дарвина Лишайники. Признаки лишайников
Лишайники. Признаки лишайников Білки, жири і вуглеводи в їжі
Білки, жири і вуглеводи в їжі Экстерьер головы
Экстерьер головы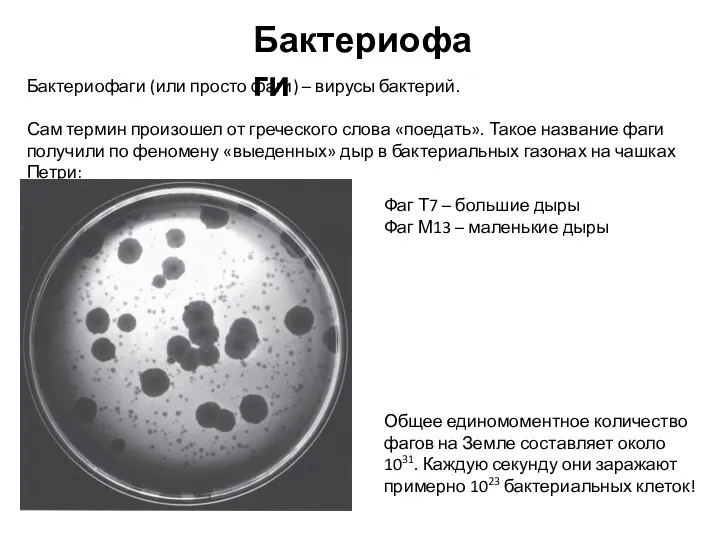 Бактериофаги (или просто фаги) – вирусы бактерий
Бактериофаги (или просто фаги) – вирусы бактерий Красная книга Республики Крым
Красная книга Республики Крым Микробиология - наука о микроорганизмах
Микробиология - наука о микроорганизмах Презентация Вид. Критерии вида
Презентация Вид. Критерии вида Мәдени өсімдіктер мен үй жануарларының шығу орталықтары
Мәдени өсімдіктер мен үй жануарларының шығу орталықтары Инструктивные карточки по биологии для 5 класса.
Инструктивные карточки по биологии для 5 класса. Типы питания растений
Типы питания растений Царство грибы
Царство грибы Бактериальные болезни растений. (Лекция 7)
Бактериальные болезни растений. (Лекция 7)