Содержание
- 2. Основные этапы решения генно-инженерной задачи: 1. Получение изолированного гена. 2. Введение гена в вектор для переноса
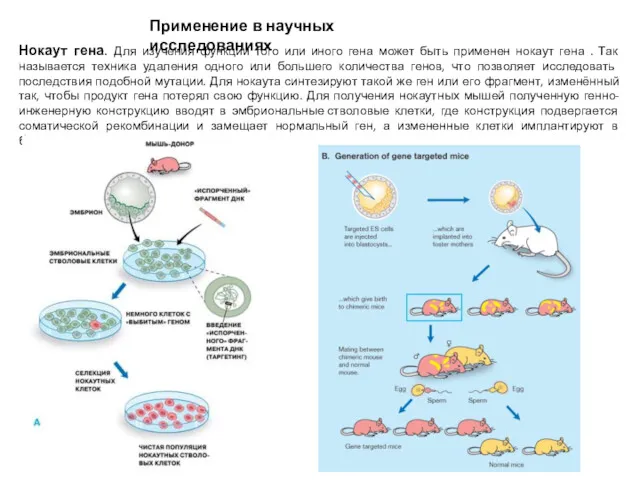
- 3. Применение в научных исследованиях Нокаут гена. Для изучения функции того или иного гена может быть применен
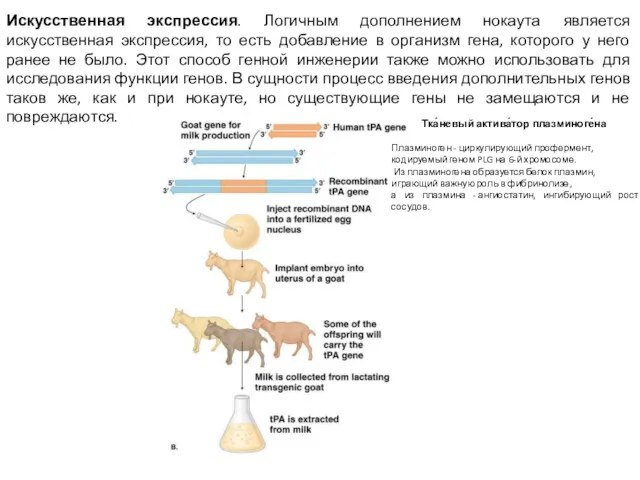
- 4. Искусственная экспрессия. Логичным дополнением нокаута является искусственная экспрессия, то есть добавление в организм гена, которого у
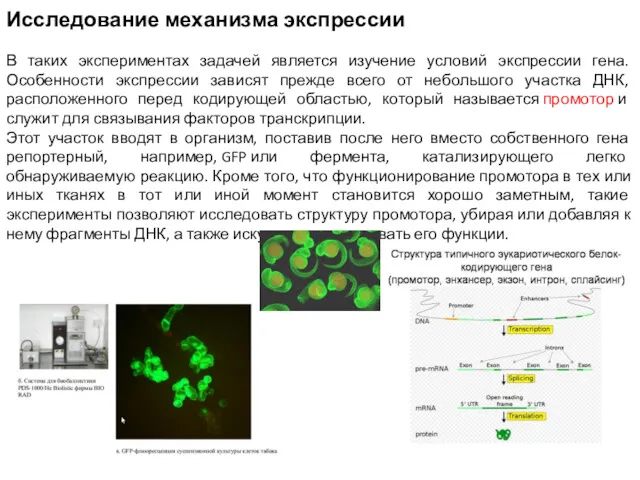
- 5. Исследование механизма экспрессии В таких экспериментах задачей является изучение условий экспрессии гена. Особенности экспрессии зависят прежде
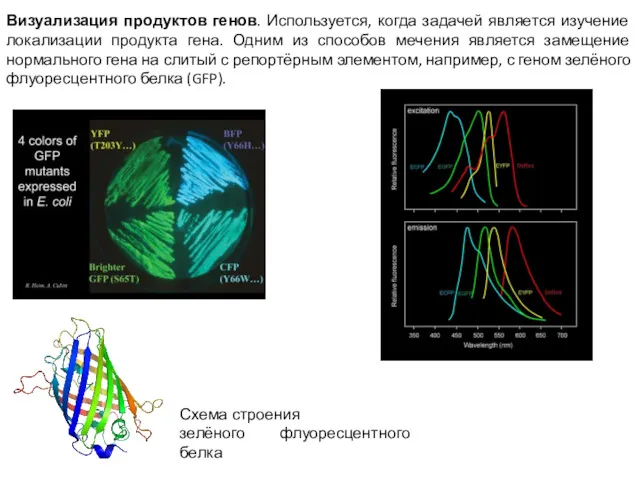
- 6. Визуализация продуктов генов. Используется, когда задачей является изучение локализации продукта гена. Одним из способов мечения является
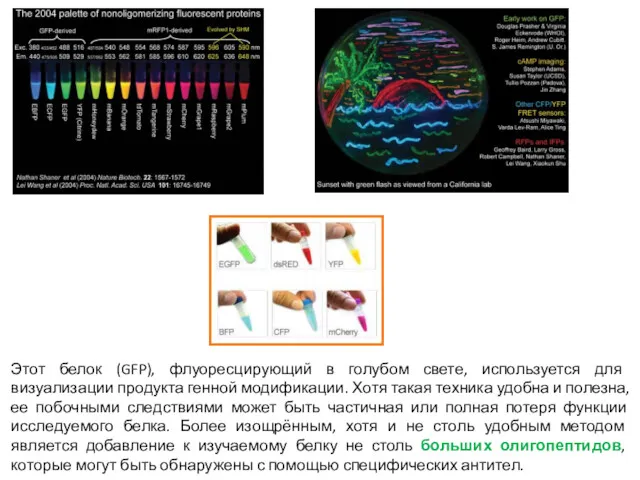
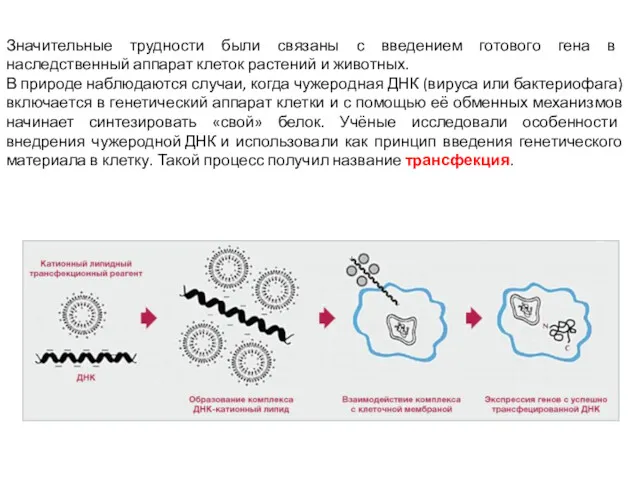
- 7. Этот белок (GFP), флуоресцирующий в голубом свете, используется для визуализации продукта генной модификации. Хотя такая техника
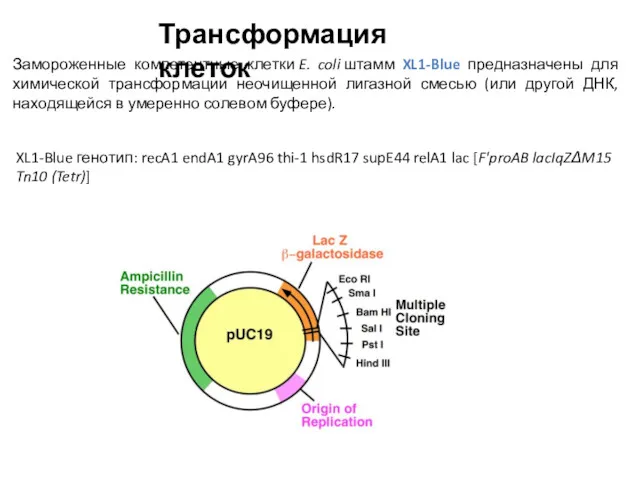
- 8. Техника введения генов в бактерии была разработана после того, как Фредерик Гриффит открыл явление бактериальной трансформации.
- 9. Значительные трудности были связаны с введением готового гена в наследственный аппарат клеток растений и животных. В
- 10. Способы прямого введения генов в клетку Трансфекция Микроинъекция Электропорация Метод «мини-клеток» Упаковка в липосомы Электронная пушка
- 11. Трансформация клеток В 1970 году Мандель и Хига показали, что совместная инкубация E. coli и фага
- 12. Доля компетентных клеток составляет 0,01-10% от общего числа жизнеспособных клеток Частота трансформации = количество колониеобразующих единиц
- 13. Замороженные компетентные клетки E. coli штамм XL1-Blue предназначены для химической трансформации неочищенной лигазной смесью (или другой
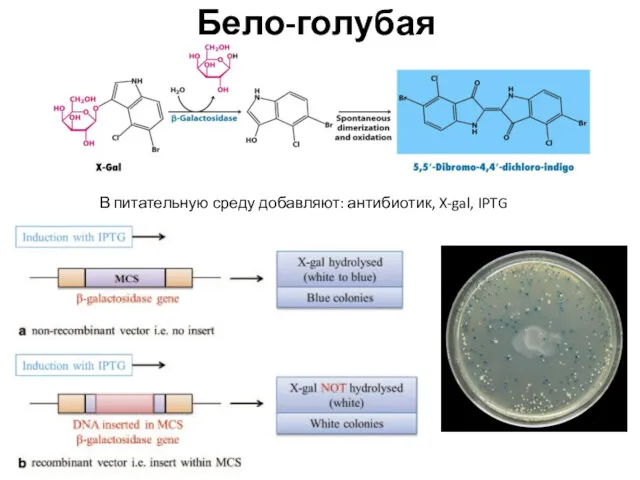
- 14. В питательную среду добавляют: антибиотик, X-gal, IPTG Бело-голубая селекция
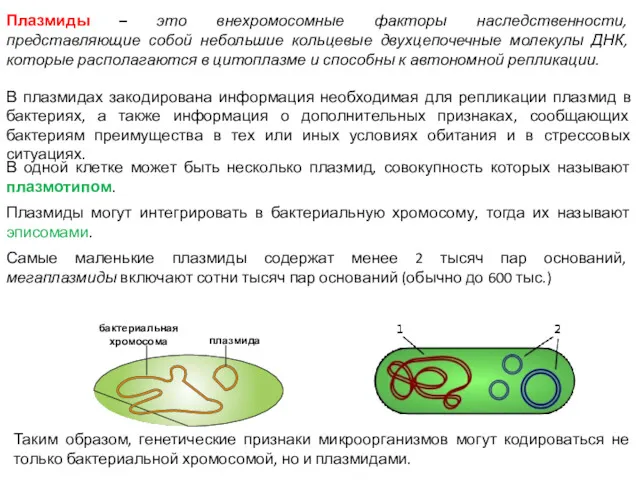
- 15. Плазмиды – это внехромосомные факторы наследственности, представляющие собой небольшие кольцевые двухцепочечные молекулы ДНК, которые располагаются в
- 16. Плазмиды — это двуцепочечные ДНК-молекулы, которые существуют в клетках независимо от генома. В одной клетке может
- 17. Классификация плазмид По способности инициировать процесс конъюгации Конъюгативные (половые, трансмиссивные) Имеют более крупные размеры; содержат область
- 18. По функции: Половые F-плазмиды (от англ. Fertility — способность к размножению). Содержат tra-гены, способны инициировать половой
- 19. Многие плазмиды используются в качестве векторов молекулярного клонирования в E.coli. Для того, чтобы плазмиду можно было
- 20. Ori – участок начала репликации. Чаще это модуль из плазмиды под ослабленным контролем т.е. высококопийной), но
- 21. Регулируемые промоторы (в экспрессирующих векторах) –trp, lac ,tac. LacUV5, trc и другие. RBS–сайт- синтетическая последовательность, соответствующая
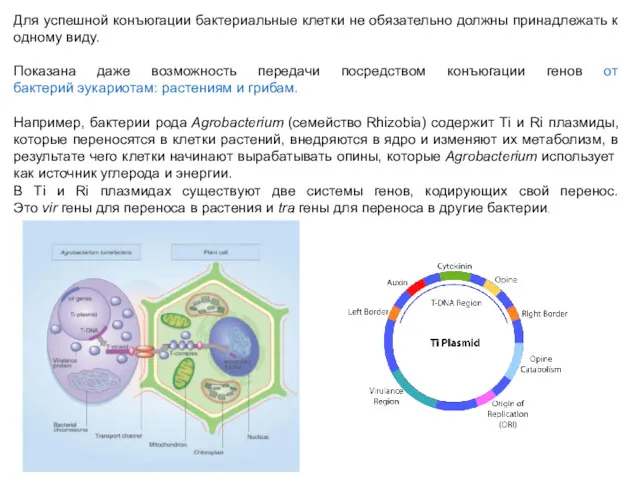
- 22. Для успешной конъюгации бактериальные клетки не обязательно должны принадлежать к одному виду. Показана даже возможность передачи
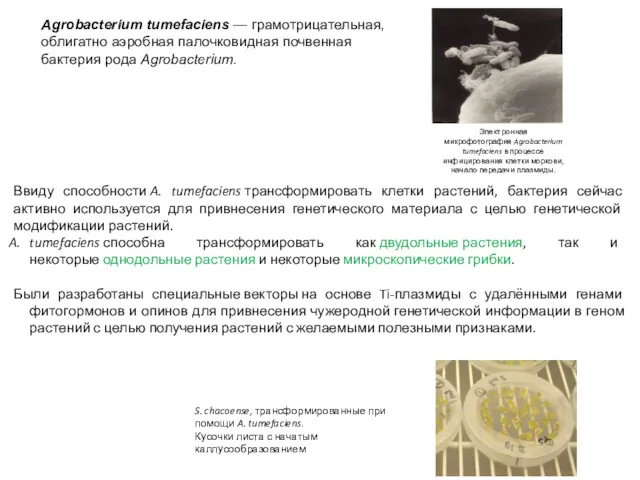
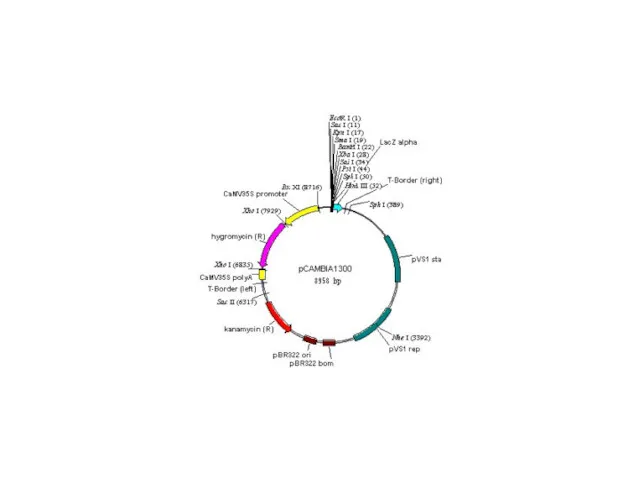
- 23. Agrobacterium tumefaciens — грамотрицательная, облигатно аэробная палочковидная почвенная бактерия рода Agrobacterium. Электронная микрофотография Agrobacterium tumefaciens в
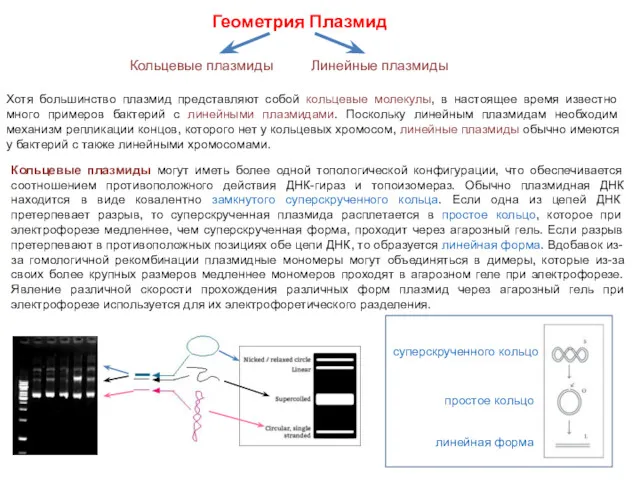
- 25. Геометрия Плазмид Хотя большинство плазмид представляют собой кольцевые молекулы, в настоящее время известно много примеров бактерий
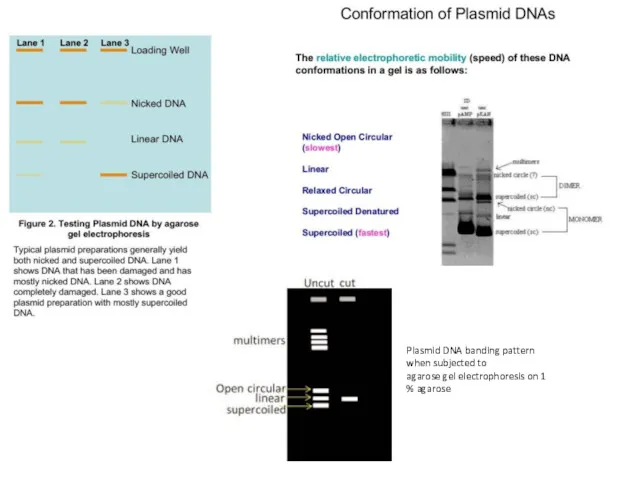
- 26. Plasmid DNA banding pattern when subjected to agarose gel electrophoresis on 1 % agarose
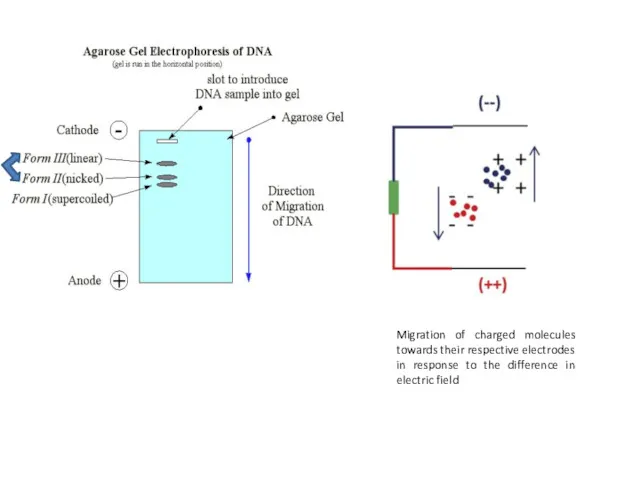
- 27. Migration of charged molecules towards their respective electrodes in response to the difference in electric field
- 28. Ферметы – инструменты генной инженерии Рестриктазы или рестриктирующие эндонуклеазы, - это ферменты, “узнающие” определенные последовательности (сайты
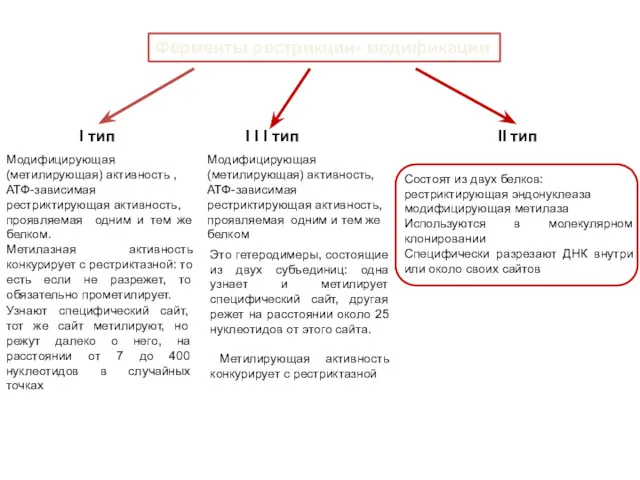
- 29. Ферменты рестрикции- модификации I тип I I I тип II тип Модифицирующая (метилирующая) активность , АТФ-зависимая
- 30. Сейчас известно уже около 500 рестриктаз, выделенных из самых разных микроорганизмов Названия рестриктазам часто даются по
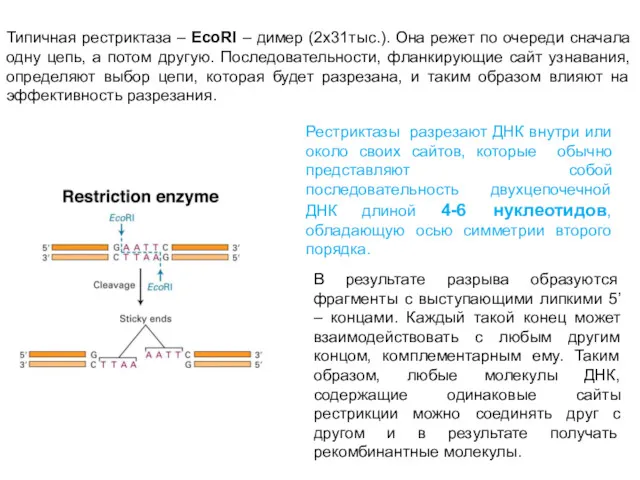
- 31. Типичная рестриктаза – EcoRI – димер (2х31тыс.). Она режет по очереди сначала одну цепь, а потом
- 32. Многие ферменты рестрикции катализируют разрывы, в результате которых образуются фрагменты ДНК с выступающими 5’ – концами,
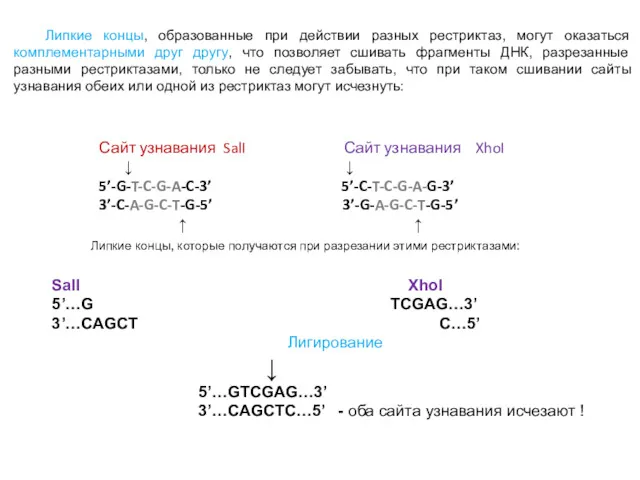
- 33. Сайт узнавания SalI Сайт узнавания XhoI ↓ ↓ 5’-G-T-C-G-A-C-3’ 5’-C-T-C-G-A-G-3’ 3’-C-A-G-C-T-G-5’ 3’-G-A-G-C-T-G-5’ ↑ ↑ Липкие концы,
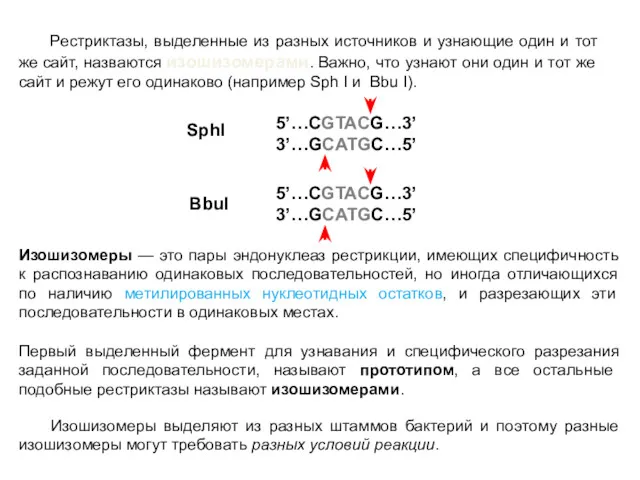
- 34. Рестриктазы, выделенные из разных источников и узнающие один и тот же сайт, назваются изошизомерами. Важно, что
- 35. Гетерошизомеры (неошизомеры) Фермент, узнающий такую же последовательность, но разрезающий её по-другому, называют гетерошизомером (неошизомером). Изошизомеры, таким
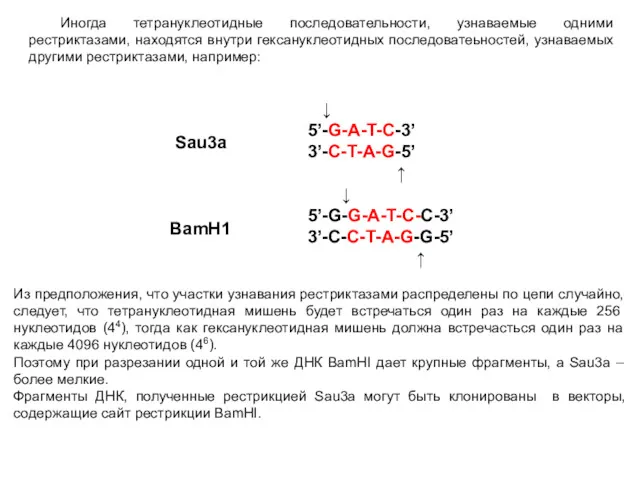
- 36. Иногда тетрануклеотидные последовательности, узнаваемые одними рестриктазами, находятся внутри гексануклеотидных последоватеьностей, узнаваемых другими рестриктазами, например: ↓ 5’-G-A-T-C-3’
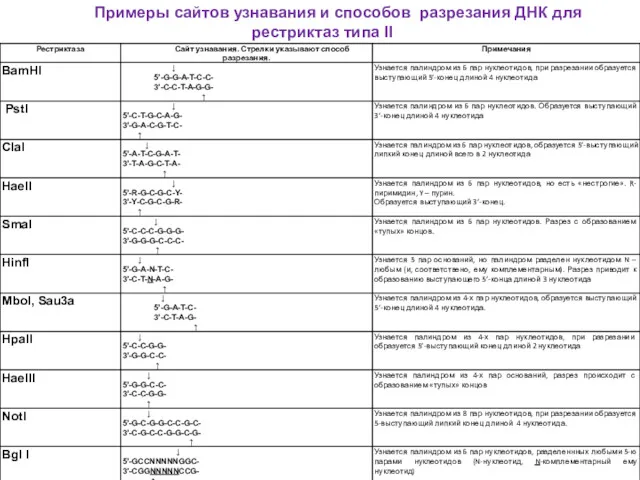
- 37. Примеры сайтов узнавания и способов разрезания ДНК для рестриктаз типа II
- 38. Некоторые выводы, которые можно сделать, изучая сайты разрезания для рестриктаз Одинаковы липкие концы могут образоваться при
- 39. Помимо сайта узнавания, рестриктазам нужны соседние любые нуклеотиды для нормальной посадки. Это важно, когда разрезание идет
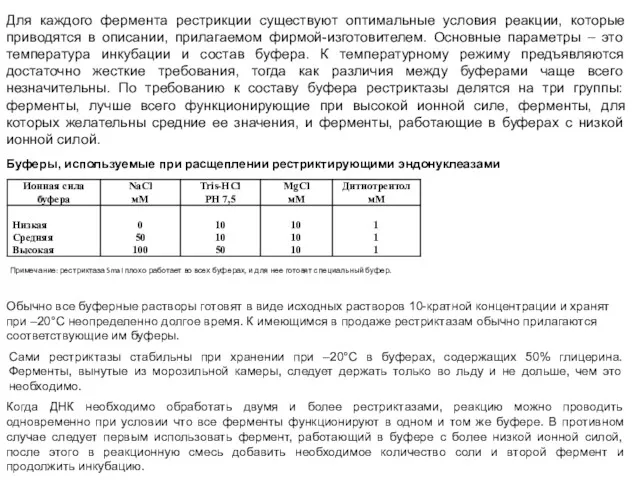
- 40. Для каждого фермента рестрикции существуют оптимальные условия реакции, которые приводятся в описании, прилагаемом фирмой-изготовителем. Основные параметры
- 41. Прежде, чем начать работать, следует запомнить следующее 1. Рестриктазы никогда не вынимаются из ледяной бани или
- 42. Если плазмида при выделении не очищена от РНК, то в смесь добавляют рибонуклеазу. Она не мешает
- 43. Другие ферменты молекулярного клонирования ДНК-полимераза E.coli 5'-3'- полимераза 5'-3‘ экзонуклеаза 3'-5‘ экзонуклеаза Применение: Nic – трансляция
- 44. Фрагмент Кленова Получают протеолизом ДНКП I. 5'-3'- полимераза 3'-5‘ экзонуклеаза Применение: Достраивание укороченных 3'-концов. Теоретически возможно
- 45. Полинуклеотидкиназа фага Т-4 Фосфорилирует фрагменты ДНК, у которых отсутствуют 5’-концевые фосфаты Применение: Фосфорилирование ПЦР-ных фрагментов (если
- 46. Нуклеаза S Деградирует однонитчатую ДНК – выступающие концы и однонитчатые петли Применение: Затупление 5‘-выступающего липкого конца.
- 47. Терминальная дезоксинуклеотидилтрансферраза Применение: Пришивание к 3’-концу [поли(dA)], [поли (dG)] и др. в процессе получения липких концов.
- 48. Какие приемы обычно используют при создании конструкций? Как соединять фрагменты рекомбинантной ДНК? Липкие концы – сшиваем
- 49. 5. ПЦР-ные фрагменты не имеют на 5’-конце фосфатной группы, поэтому лигаза не может их пришить. Как
- 50. 7. Ориентация фрагмента В случае клонирования по двум разным сайтам с липкими концами ориентация фрагмента задана
- 51. Полимеразная цепная реакция (ПЦР) — экспериментальный метод молекулярной биологии, способ значительного увеличения малых концентраций определённых фрагментов
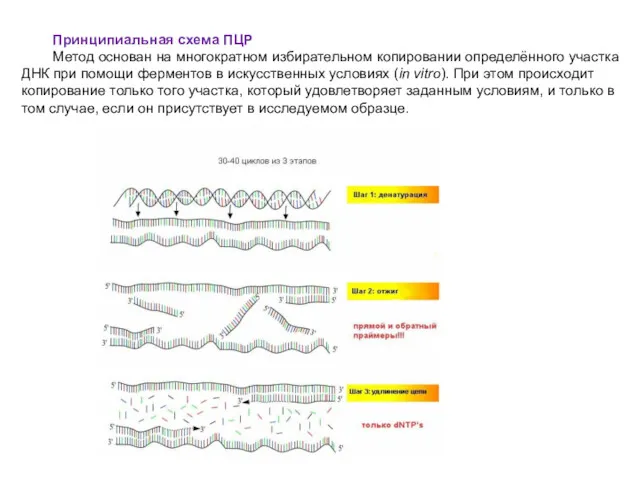
- 52. Принципиальная схема ПЦР Метод основан на многократном избирательном копировании определённого участка ДНК при помощи ферментов в
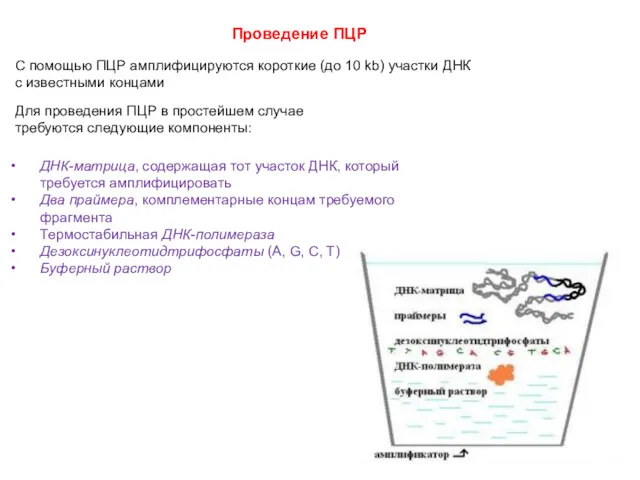
- 53. Проведение ПЦР С помощью ПЦР амплифицируются короткие (до 10 kb) участки ДНК с известными концами Для
- 54. ПЦР проводят в амплификаторе (термоциклёре) — приборе, обеспечивающем периодическое охлаждение и нагревание пробирок, обычно, с точностью
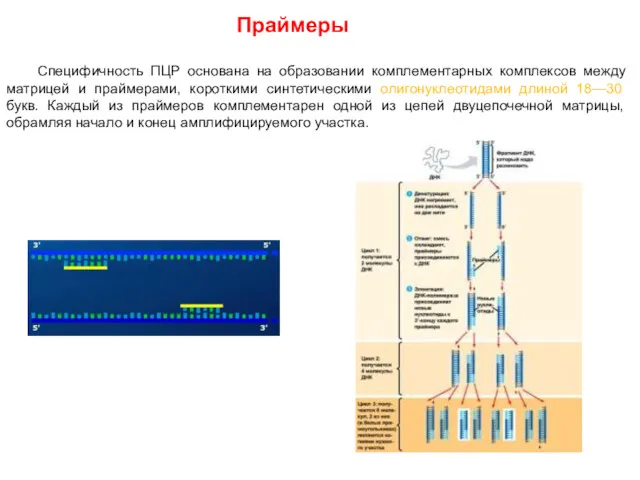
- 55. Праймеры Специфичность ПЦР основана на образовании комплементарных комплексов между матрицей и праймерами, короткими синтетическими олигонуклеотидами длиной
- 56. Важнейшая характеристика праймеров — температура плавления (Tm) комплекса праймер-матрица. Она определяется, как температура, при которой половина
- 57. Размер праймера должен быть 16-25 нуклеотидов. Меньше 16-ти: слабая связь с целью Разница в температуре плавления
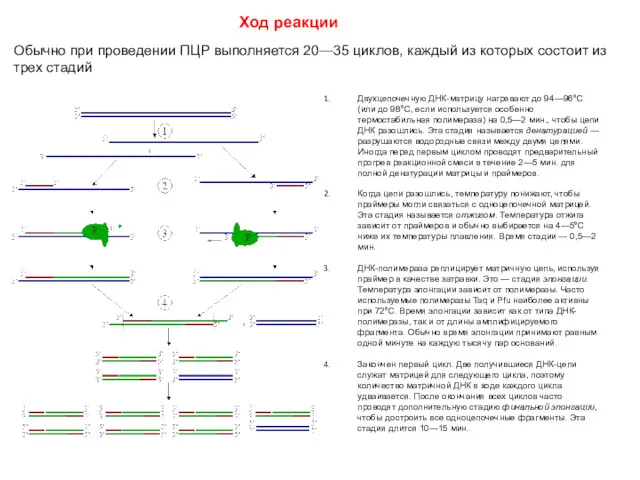
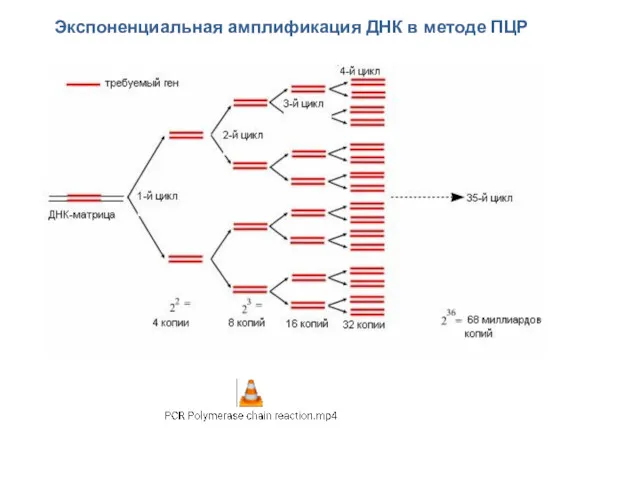
- 58. Ход реакции Обычно при проведении ПЦР выполняется 20—35 циклов, каждый из которых состоит из трех стадий
- 59. Экспоненциальная амплификация ДНК в методе ПЦР
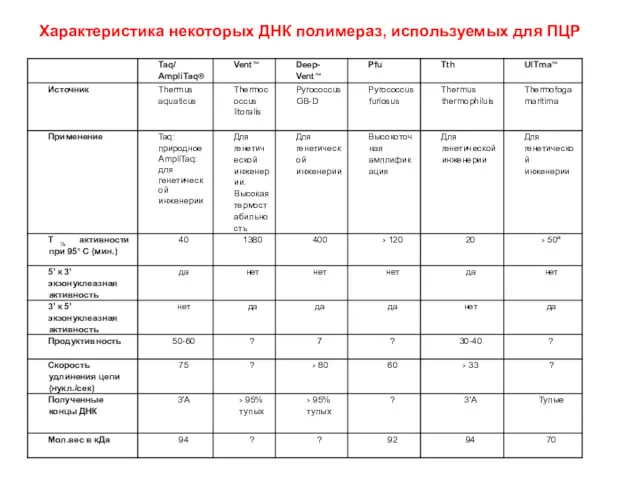
- 60. ДНК полимераза Первой использованной термостабильной ДНК полимеразой была Taq ДНК полимераза, выделенная из бактерий Thermus aquaticus.
- 61. Характеристика некоторых ДНК полимераз, используемых для ПЦР
- 62. Реакционные буферы и MgCl2 в реакциях ПЦР В дополнение к реагентам, непосредственно участвующим в реакции, метод
- 63. «Эффект плато» Процесс накопления специфических продуктов амплификации по геометрической прогрессии идет лишь ограниченное время, а затем
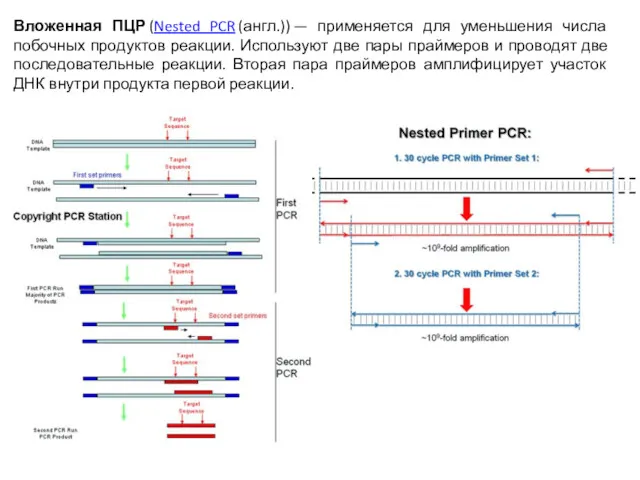
- 65. Вложенная ПЦР (Nested PCR (англ.)) — применяется для уменьшения числа побочных продуктов реакции. Используют две пары
- 66. Инвертированная ПЦР (Inverse PCR (англ.)) — используется в том случае, если известен лишь небольшой участок внутри
- 67. ПЦР с обратной транскрипцией (Reverse Transcription PCR, RT-PCR) — используется для амплификации, выделения или идентификации известной
- 68. Асимметричная ПЦР (англ. Asymmetric PCR) — проводится тогда, когда нужно амплифицировать преимущественно одну из цепей исходной
- 69. Количественная ПЦР (Quantitative PCR, Q-PCR (англ.)) или ПЦР в реальном времени — используется для непосредственного наблюдения
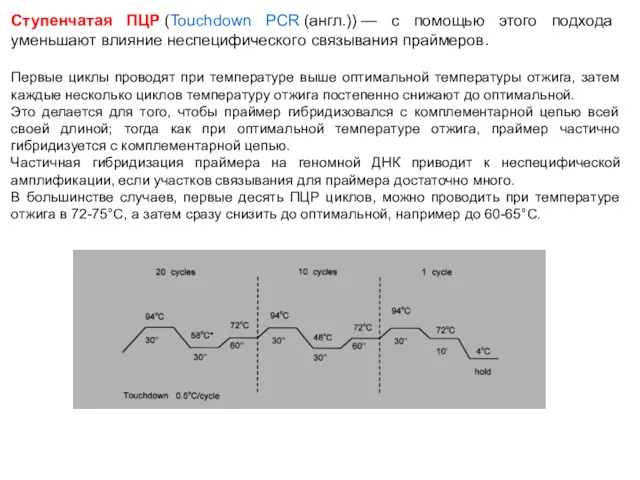
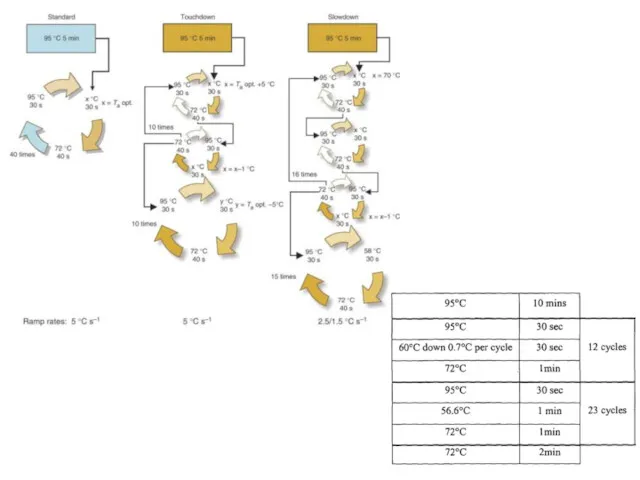
- 71. Ступенчатая ПЦР (Touchdown PCR (англ.)) — с помощью этого подхода уменьшают влияние неспецифического связывания праймеров. Первые
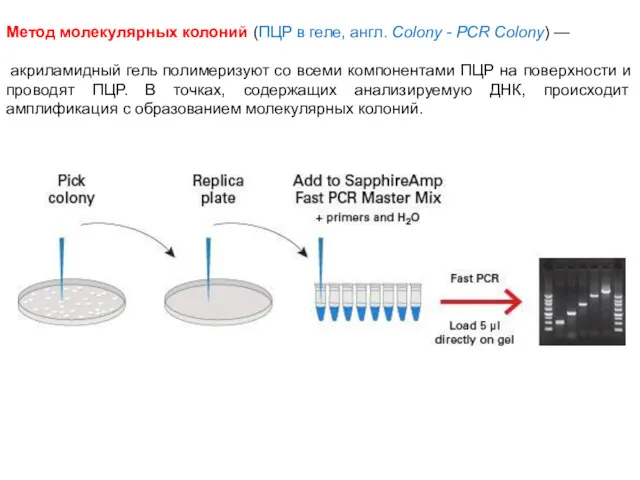
- 73. Метод молекулярных колоний (ПЦР в геле, англ. Colony - PCR Colony) — акриламидный гель полимеризуют со
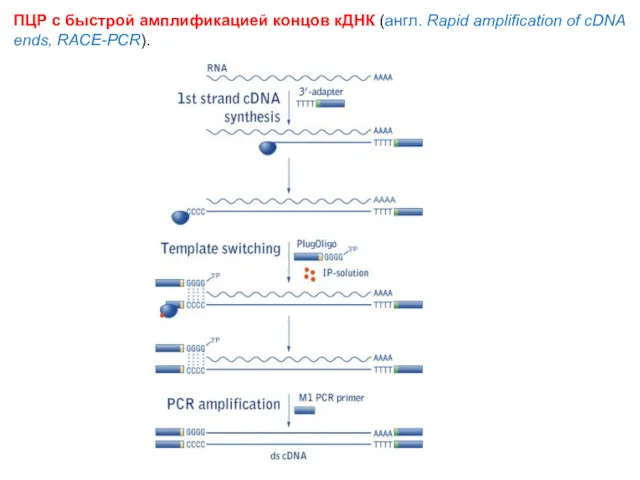
- 74. ПЦР с быстрой амплификацией концов кДНК (англ. Rapid amplification of cDNA ends, RACE-PCR).
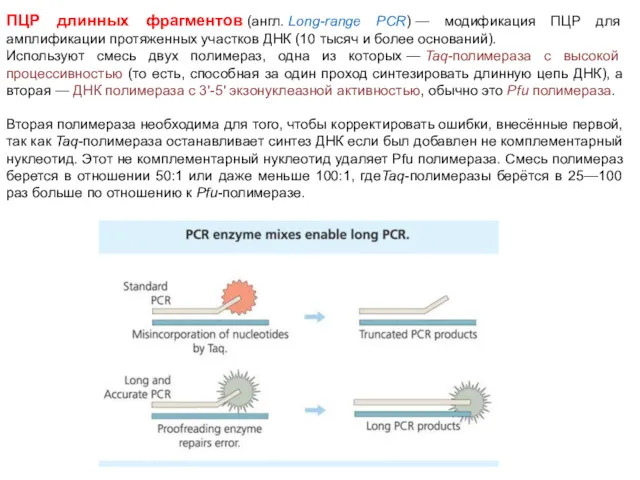
- 76. ПЦР длинных фрагментов (англ. Long-range PCR) — модификация ПЦР для амплификации протяженных участков ДНК (10 тысяч
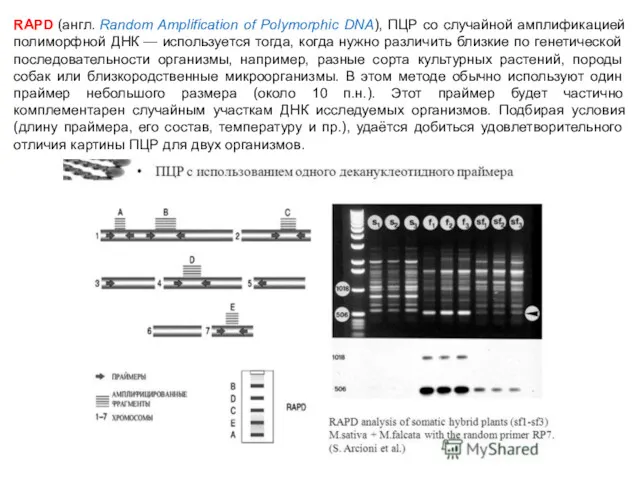
- 77. RAPD (англ. Random Amplification of Polymorphic DNA), ПЦР со случайной амплификацией полиморфной ДНК — используется тогда,
- 78. Групп-специфическая ПЦР (англ. group-specific PCR) — ПЦР для родственных последовательностях внутри одного или между разными видами,
- 79. Виртуальная ПЦР (англ. in silico PCR, цифровая ПЦР, электронная ПЦР, е-ПЦР) — математический метод компьютерного анализа
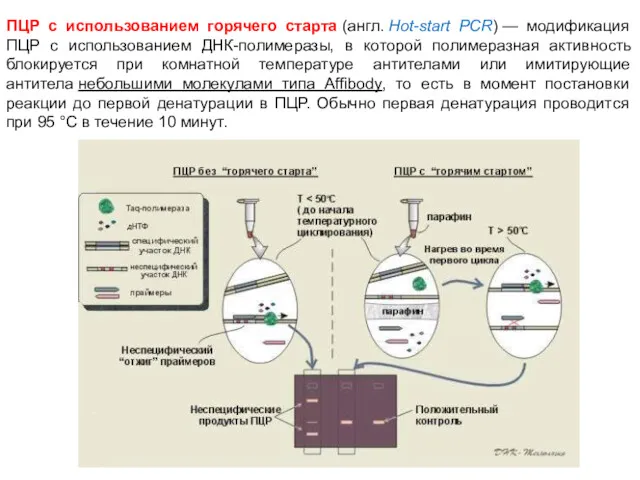
- 80. ПЦР с использованием горячего старта (англ. Hot-start PCR) — модификация ПЦР с использованием ДНК-полимеразы, в которой
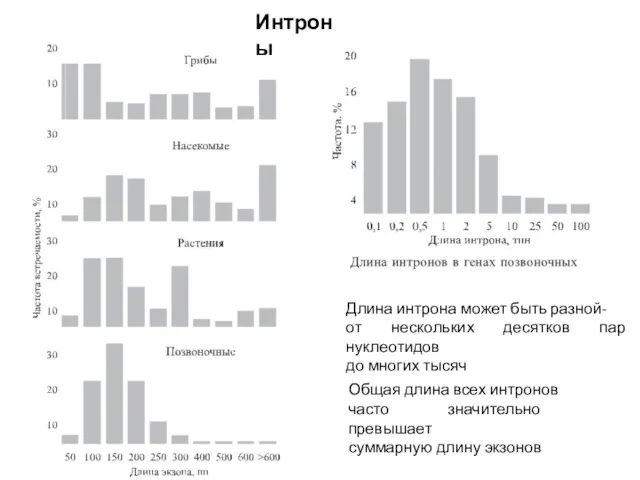
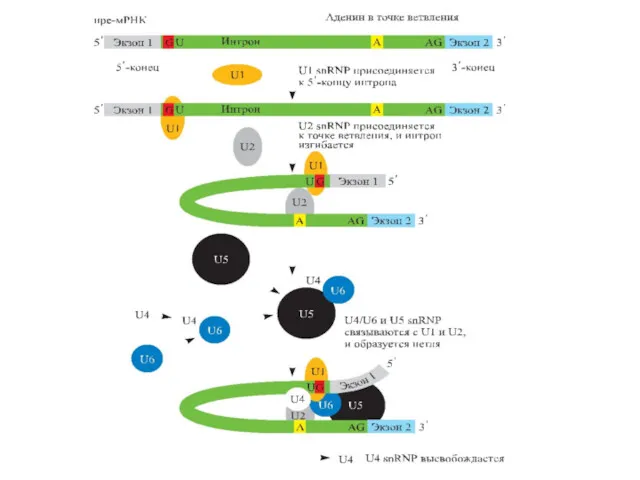
- 81. Общая длина всех интронов часто значительно превышает суммарную длину экзонов Длина интрона может быть разной- от
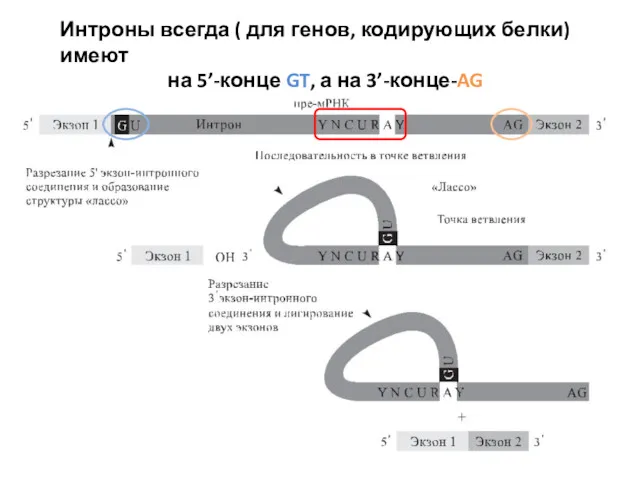
- 82. Интроны всегда ( для генов, кодирующих белки) имеют на 5’-конце GT, а на 3’-конце-AG
- 85. Скачать презентацию





















![Терминальная дезоксинуклеотидилтрансферраза Применение: Пришивание к 3’-концу [поли(dA)], [поли (dG)] и](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/133723/slide-46.jpg)



















 Происхождение человека
Происхождение человека Пестициды (ядохимикаты)
Пестициды (ядохимикаты) Мышечные ткани
Мышечные ткани Строение и жизнедеятельность инфузорий
Строение и жизнедеятельность инфузорий Красная книга Удмуртии. Животные
Красная книга Удмуртии. Животные Развитие животных с превращением и без превращения
Развитие животных с превращением и без превращения Шкіра має 3 прошарки
Шкіра має 3 прошарки Методы выделения, очистки, концентрирования и консервации целевых продуктов в биотехнологии
Методы выделения, очистки, концентрирования и консервации целевых продуктов в биотехнологии Углеводы. Функции углеводов
Углеводы. Функции углеводов Понятие о биосфере
Понятие о биосфере Ферментативный катализ
Ферментативный катализ Открытия в области биологии в эпоху НТР
Открытия в области биологии в эпоху НТР Лось, как представитель класса диких животных
Лось, как представитель класса диких животных Зеленая революция: сегодня и завтра
Зеленая революция: сегодня и завтра Лесоводство. Рубки спелых и перестойных лесных насаждений, естественное лесовозобновление
Лесоводство. Рубки спелых и перестойных лесных насаждений, естественное лесовозобновление Жасуша және тін дақылдары, вирустарды дақылдандыру, вирусологиялық зерттеу әдістері
Жасуша және тін дақылдары, вирустарды дақылдандыру, вирусологиялық зерттеу әдістері Материал для подготовки к ОГЭ по биологии для 9 класса
Материал для подготовки к ОГЭ по биологии для 9 класса Предмет и задачи зоопсихологии и сравнительной психологии
Предмет и задачи зоопсихологии и сравнительной психологии Катаболизм аминокислот и обезвреживание аммиака
Катаболизм аминокислот и обезвреживание аммиака Игра по окружающему миру для 5 класса
Игра по окружающему миру для 5 класса Природные заповедники Украины
Природные заповедники Украины Биосинтез ДНК
Биосинтез ДНК методическая разработка урока на тему: клеточное строение листа для 6 класса
методическая разработка урока на тему: клеточное строение листа для 6 класса Утворення перлин
Утворення перлин Характеристика сложных белков. Структура и свойства
Характеристика сложных белков. Структура и свойства Основы анатомии и физиологии. Сенсорные системы
Основы анатомии и физиологии. Сенсорные системы Протерозойская эра
Протерозойская эра Экзотические плоды. Ягоды. Орехи
Экзотические плоды. Ягоды. Орехи