Слайд 2

Этапы выделения ДНК из клеточного образца
0. Гомогенизация образца.
1. Лизис клеток.
– SDS
(SLS, додецилсульфат (лаурилсульфат) натрия), лизоцим, гуанидина изотиоцианат (GITC), протеазы
2. Удаление примесей (белки, липиды и др.).
– фенол+хлороформ
– высаливание
3. Преципитация ДНК.
– осаждение (этанол, изопропанол)
– преципитация на сорбент (колонки, силикагель)
4. Растворение ДНК.
Слайд 3

Этап 0. Гомогенизация образца ткани
Этап требуется в случае необходимости выделения ДНК
из материала, содержащего прочные механические ткани (членистоногие, жёсткие части растений).
Осуществляется механически: перетирание материала в пестике в жидком азоте до образования мелкого порошка (пудры).
Слайд 4

Этап 1. Лизис клеток
Разрушение клеточной оболочки – клеточной стенки (если есть)
и мембран
1. Физический способ.
ультразвуковая обработка
воздействие гипотонической среды
2. Химический способ.
детергенты (напр., додецилсульфат натрия, SDS) – ПАВ, растворяют компоненты клетки, денатурируют белки
хаотропные агенты (гуанидинизотиоцианат, GITC) – увеличивают растворимость липидов и белков в воде
лизирующие ферменты (лизоцим) – разрушают клеточную стенку
Слайд 5

Этап 2. Удаление примесей
Разрушение “ненужных” нуклеиновых кислот специфическими нуклеазами (напр., РНКаза)
Разрушение
белков протеазами (напр., протеиназа K, проназа)
Денатурирование белков и растворение неполярных молекул (липиды) органическим растворителем (фенол) + ЦФ
Слайд 6

Этап 3. Преципитация ДНК
1. Осаждение ДНК из раствора:
соль (NaCl, AcNa)
+ концентрированный спирт (изопропанол или этанол, 96-100%) + ЦФ
2. Сорбция ДНК на твёрдом носителе:
силикаты (частицы силикагеля, фильтр колонок)
магнитные частицы (могут быть также покрыты силикатами, либо олигонуклеотидными фрагментами)
Слайд 7
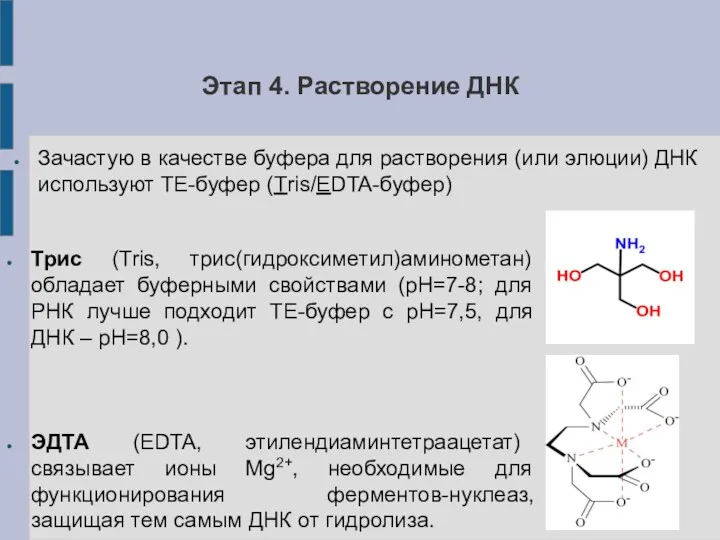
Этап 4. Растворение ДНК
Зачастую в качестве буфера для растворения (или элюции)
ДНК используют TE-буфер (Tris/EDTA-буфер)
Трис (Tris, трис(гидроксиметил)аминометан) обладает буферными свойствами (pH=7-8; для РНК лучше подходит TE-буфер с pH=7,5, для ДНК – pH=8,0 ).
ЭДТА (EDTA, этилендиаминтетраацетат) связывает ионы Mg2+, необходимые для функционирования ферментов-нуклеаз, защищая тем самым ДНК от гидролиза.
Слайд 8

Сохранность выделенной ДНК в TE-буфере
+4ºC: недели
-20ºC: месяцы
-80ºC: годы
Слайд 9
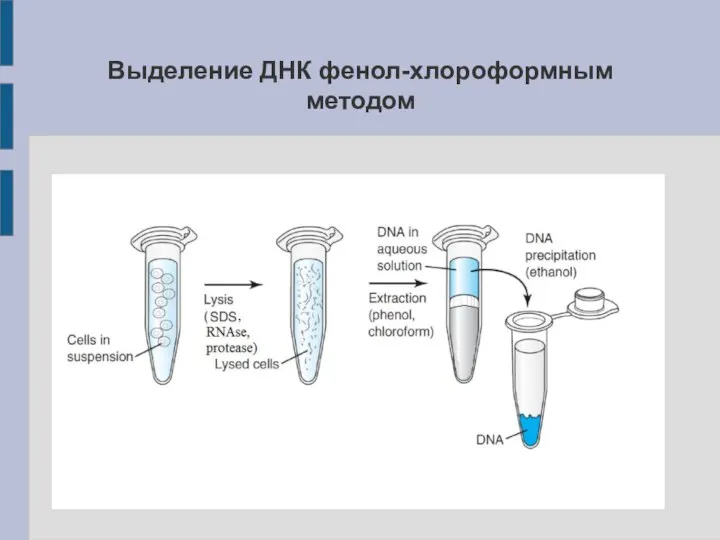
Выделение ДНК фенол-хлороформным методом
Слайд 10
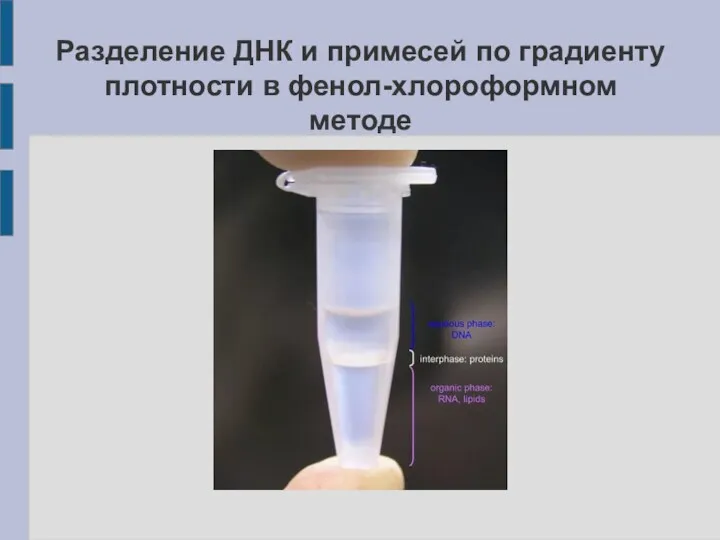
Разделение ДНК и примесей по градиенту плотности в фенол-хлороформном методе
Слайд 11
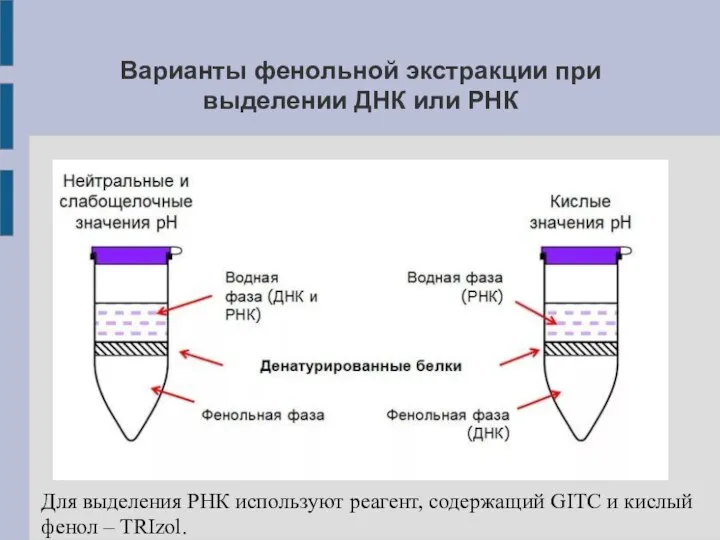
Варианты фенольной экстракции при выделении ДНК или РНК
Для выделения РНК используют
реагент, содержащий GITC и кислый фенол – TRIzol.
Слайд 12

Преимущества и недостатки метода фенол-хлороформной экстракции
Преимущества:
подходит для выделения из разных материалов
является
“золотым стандартом” выделения
обеспечивает высокий выход ДНК
Недостатки:
относительно трудоёмок
работа с токсичными реагентами (фенол, хлороформ)
Слайд 13
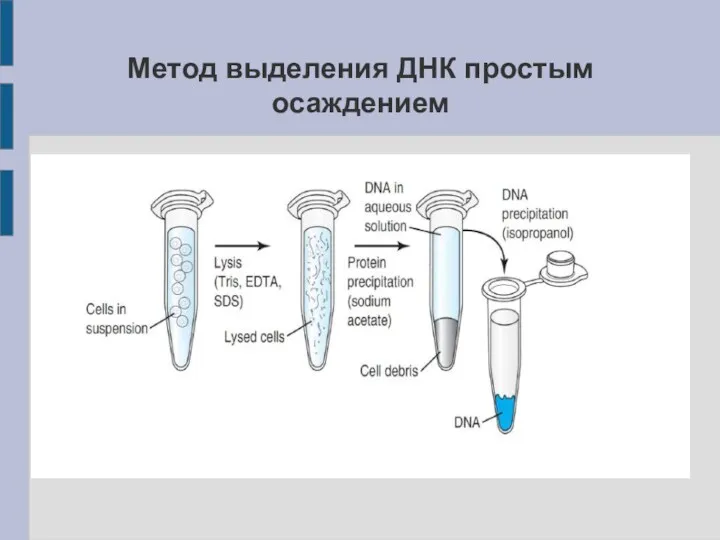
Метод выделения ДНК простым осаждением
Слайд 14

Преимущества и недостатки метода выделения простым осаждением
Преимущества:
по качеству выделения сопоставим с
ФХЭ
не требует использования токсичных веществ
не занимает много времени
Недостатки:
не является стандартным
Слайд 15
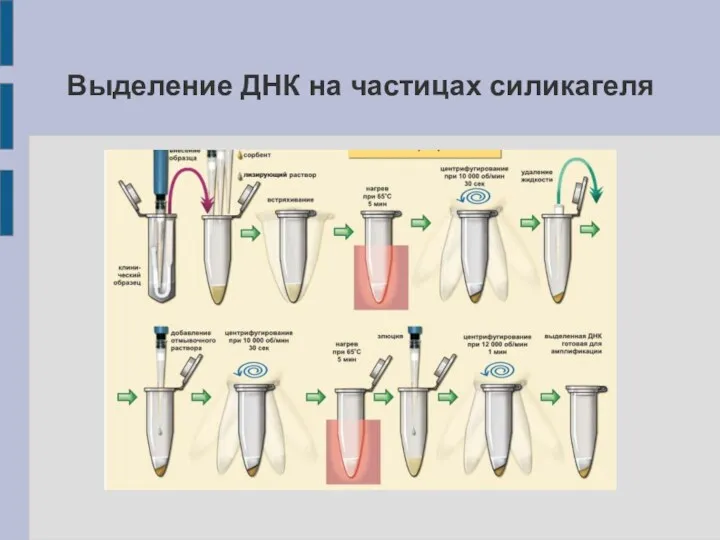
Выделение ДНК на частицах силикагеля
Слайд 16
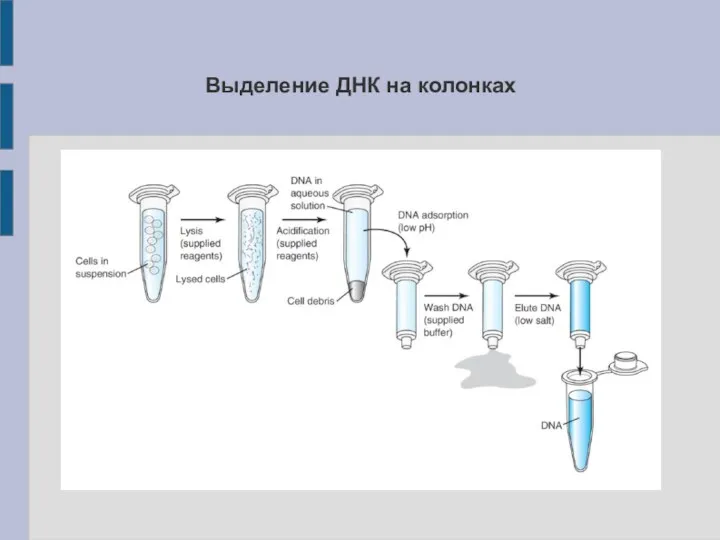
Выделение ДНК на колонках
Слайд 17
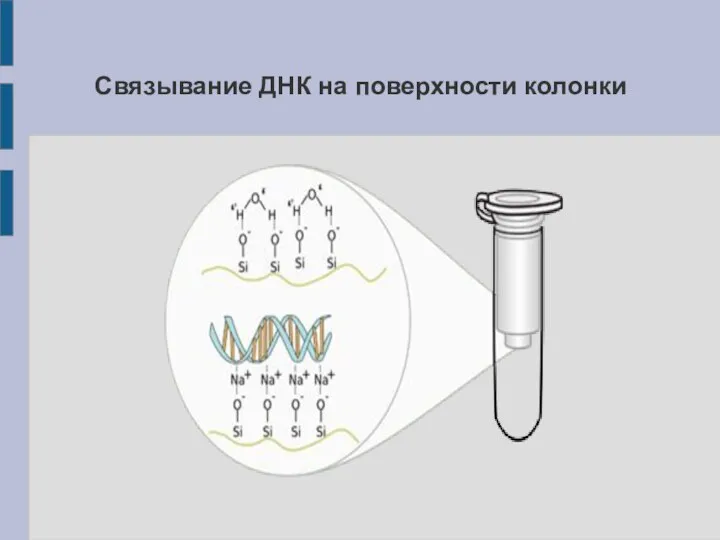
Связывание ДНК на поверхности колонки
Слайд 18
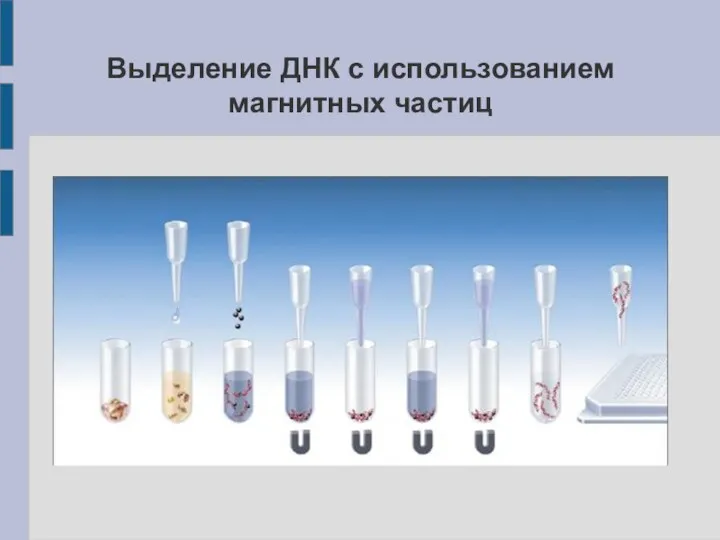
Выделение ДНК с использованием магнитных частиц
Слайд 19
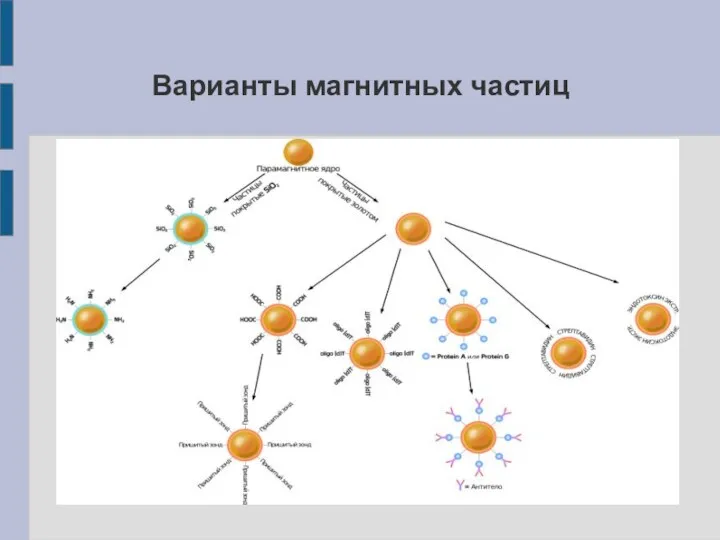
Варианты магнитных частиц
Слайд 20

Слайд 21

Преимущества и недостатки метода выделения на сорбенте (частицы силикагеля, колонки, магнитные
частицы)
Преимущества:
сравнительно быстрый метод
нет токсичных соединений
Недостатки:
малый выход ДНК
низкая чувствительность
Слайд 22

Параметры оценки качества выделения ДНК
1. Количество выделенной ДНК (концентрация)
– спектрофотометр
– флюориметр
2.
Качество ДНК:
а). Наличие примесей (чистота ДНК)
– спектрофотометр
– флюориметр
б). Длина выделенных фрагментов
– гель-электрофорез
Слайд 23

Спектрофотометр
Спектрофотометр измеряет отношение интенсивностей падающего на вещество (раствор) и прошедшего через
него потоков света определённой длины волны. Десятичный логарифм этого отношения – оптическая плотность (A или OD)
Слайд 24

Спектрофотометрия: оценка концентрации ДНК
C (мкг/мл) = Aλ * K
C – концентрация
вещества (ДНК) в растворе
Aλ– оптическая плотность растворённого вещества при длине волны λ (для ДНК и РНК λ=260 нм)
K – коэффициент, учитывающий поглощение света данной длины волны данным веществом, а также длину на которой происходит поглощение (размер кюветы)
K (дцДНК) = 50
K (оцДНК) = 37
K (оцРНК) = 40
Слайд 25

Оценка содержания примесей и чистоты ДНК
Содержание примесей оценивается по величине отношения
поглощения света при разных длинах волн:
260 нм – поглощают дцДНК, оцДНК, оцРНК
280 нм – поглощают белки
230 нм – поглощают другие органические молекулы (ЭДТА, хаотропы, фенол)
A260/A280 = 1,8-1,9 – чистая ДНК
A260/A230 = 2,0-2,2 – чистая ДНК
Слайд 26

Флюориметрическое (спектрофлюориметрическое) определение концентрации ДНК
К исследуемому образцу добавляют специфический флюорохром и
определяют интенсивность флюоресценции при облучении светом соответствующей длины волны.
Слайд 27

Преимущества и недостатки флюориметрии по сравнению со спектрофотометрией
Преимущества:
высокая селективность (за счёт
специфичного связывания флюорохрома)
высокая чувствительность (0,01 мкг/мл против 0,1 мкг/мл)
точность измерения равномерна на всём диапазоне измерений (нет необходимости в повторах)
Недостатки:
сложность в измерении содержания примесей (для каждого вещества нужен свой флюорохром)
Слайд 28
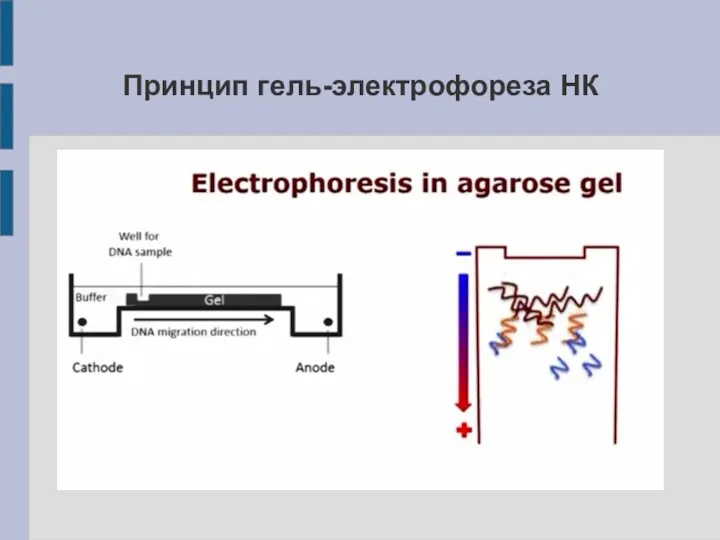
Принцип гель-электрофореза НК
Слайд 29

Электрофорез: 1. Внесение образца ДНК в лунку геля
Пластину агарозного геля кладут
в камеру для фореза. К образцу ДНК добавляют интеркалирующий флюорохром и вносят образец в лунку геля. В соседнюю лунку помещают маркер молекулярных весов
Слайд 30

Электрофорез: 2. Запуск электрофореза
Камеру для фореза закрывают крышкой, устанавливают режим (напряжение,
время) электрофореза.
Слайд 31

Электрофорез: 3. Просмотр в трансиллюминаторе
Гель перемещают в трансиллюминатор, где происходит облучение
геля ультрафиолетом. Результат оценивают визуально непосредственно или через систему фотодокументации.






























 Методы определения параметров гумусового состояния почв
Методы определения параметров гумусового состояния почв Углеводы. Моносахариды. (Лекция 13)
Углеводы. Моносахариды. (Лекция 13) Методы селекции
Методы селекции Рёбра. Анатомия. Физиология
Рёбра. Анатомия. Физиология Корсак
Корсак Микробиология - наука о микроорганизмах. История становления
Микробиология - наука о микроорганизмах. История становления Протопласты растительных клеток, как объекты биологического конструировании
Протопласты растительных клеток, как объекты биологического конструировании Микробиология
Микробиология Регуляція роботи серця
Регуляція роботи серця Проводящие пути ЦНС
Проводящие пути ЦНС The methods for the preparation of permanent stains. the structure and the working principle of the fermenter
The methods for the preparation of permanent stains. the structure and the working principle of the fermenter Плазмиды
Плазмиды Адаптации организмов к условиям обитания
Адаптации организмов к условиям обитания Вода - основной источник жизни и здоровья
Вода - основной источник жизни и здоровья Древнейшие люди
Древнейшие люди Световая микроскопия. Занятие 1
Световая микроскопия. Занятие 1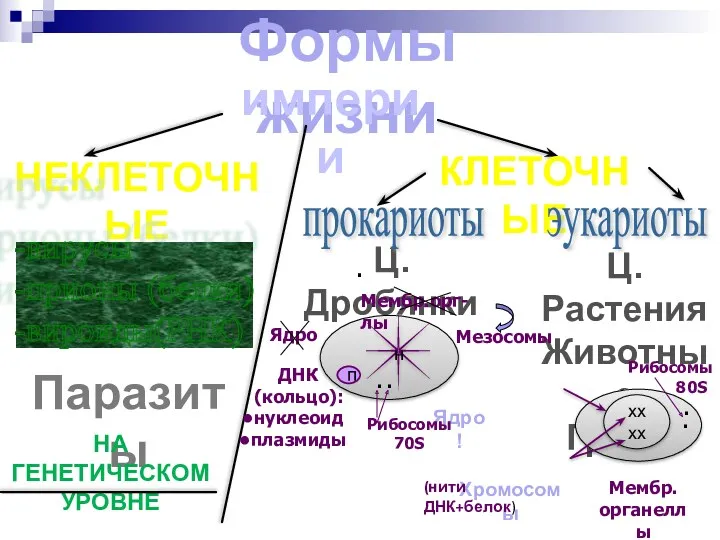 Строение эукариотической клетки
Строение эукариотической клетки Цитологический атлас
Цитологический атлас Гости из далёких стран
Гости из далёких стран Растения и окружающая среда
Растения и окружающая среда Перелетные птицы весной
Перелетные птицы весной Серая ворона
Серая ворона Микроорганизмы – инструменты научных исследований
Микроорганизмы – инструменты научных исследований Семейство сложноцветные (астровые)
Семейство сложноцветные (астровые) Капуста
Капуста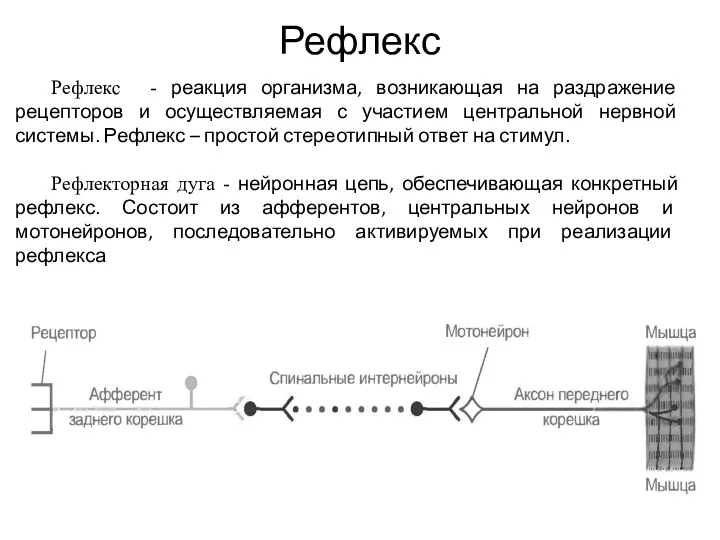 Кодирование информации в нервной системе
Кодирование информации в нервной системе Дәрілік препараттардың синтезі мен олардың классификациясы
Дәрілік препараттардың синтезі мен олардың классификациясы Зимующие птицы
Зимующие птицы