Содержание
- 2. Структура и функции нуклеиновых кислот. Репликация ДНК
- 3. Нуклеиновые кислоты Высокомолекулярные соединения, состоящие из нуклеотидов. Типы: ДНК (дезоксирибонуклеиновая кислота) РНК (рибонуклеиновая кислота): мРНК. рРНК.
- 4. Функции нуклеиновых кислот Хранение и передача генетической информации.
- 5. Нуклеотиды – мономеры нуклеиновых кислот 3 компонента: Азотистое основание Пентоза Фосфорная кислота
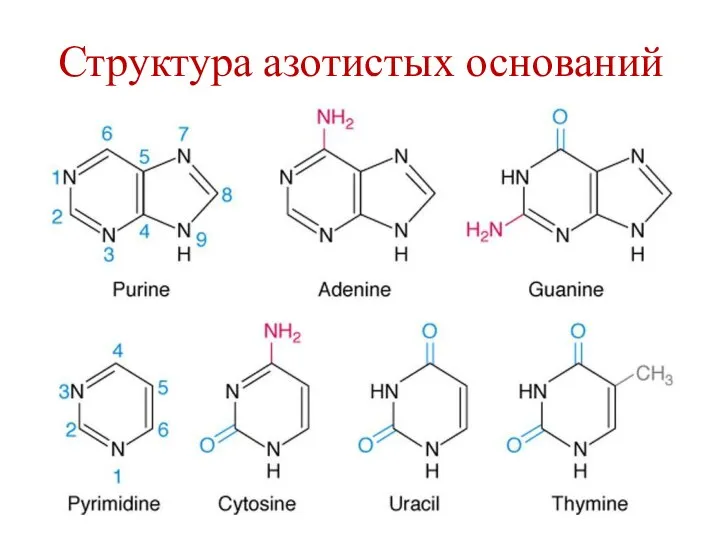
- 6. Азотистые основания Пуриновые: Аденин (А) Гуанин (G) Пиримидиновые: Цитозин (C) Урацил (U) Тимин (T)
- 7. Структура азотистых оснований
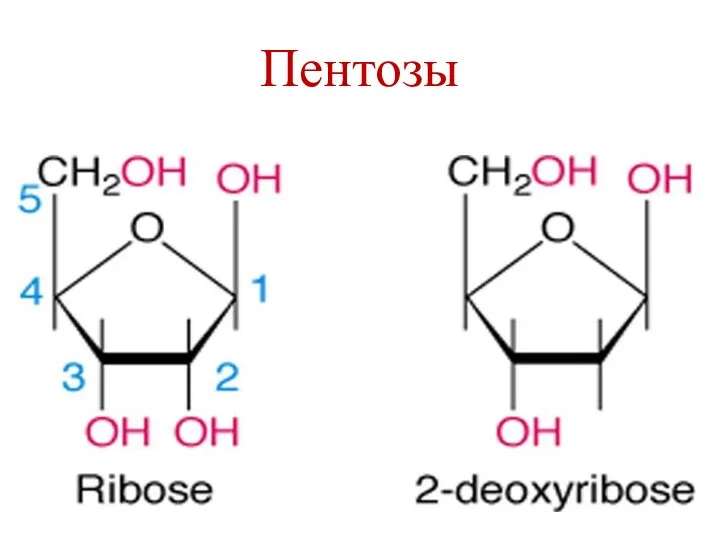
- 8. Пентозы
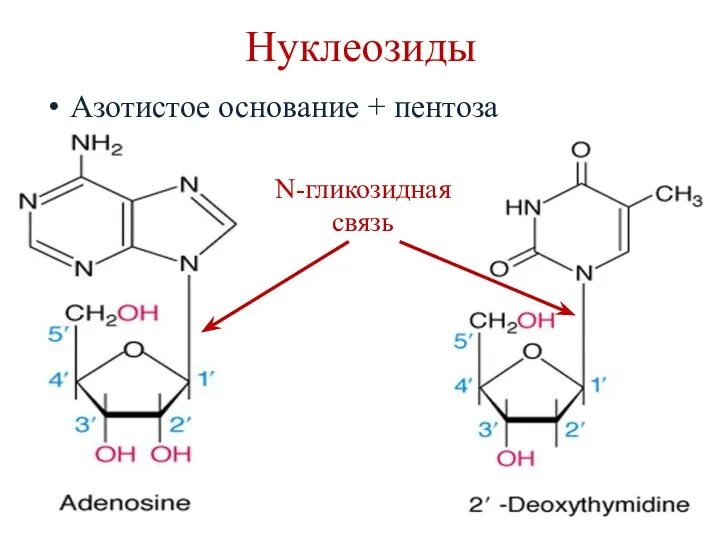
- 9. Нуклеозиды Азотистое основание + пентоза N-гликозидная связь
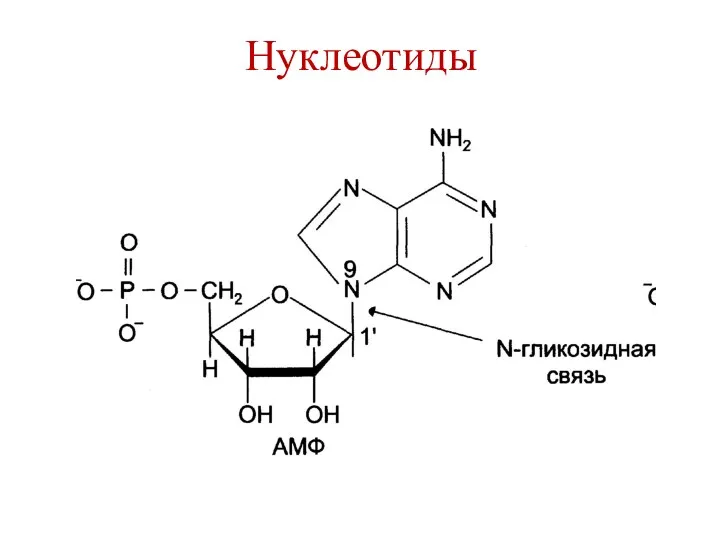
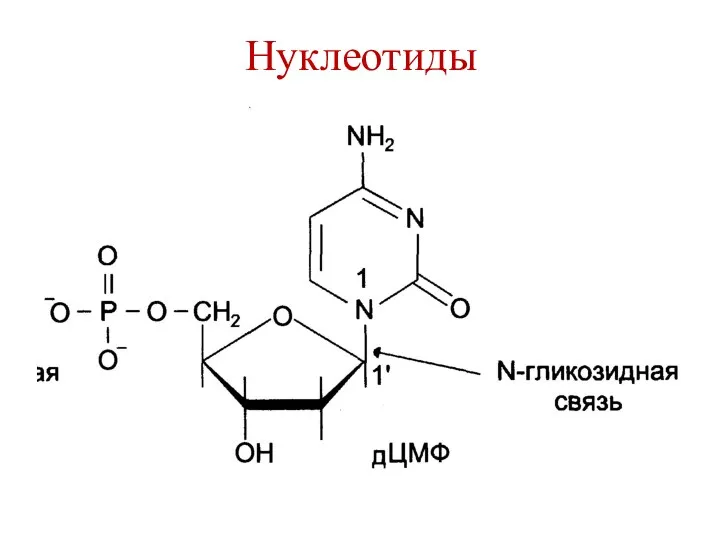
- 10. Нуклеотиды
- 11. Нуклеотиды
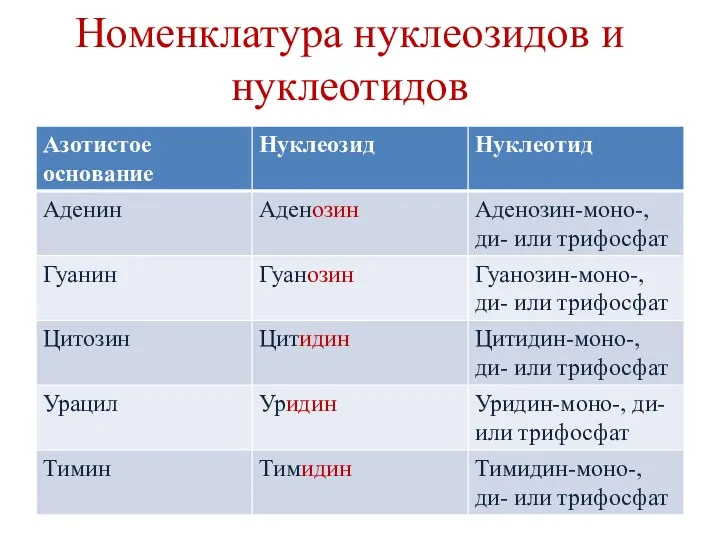
- 12. Номенклатура нуклеозидов и нуклеотидов
- 13. Функции нуклеотидов Предшественники и мономеры нуклеиновых кислот Макроэргические соединения Кофакторы Активаторы определенных веществ (УДФ-глюкоза, ЦДФ-холин) Вторичные
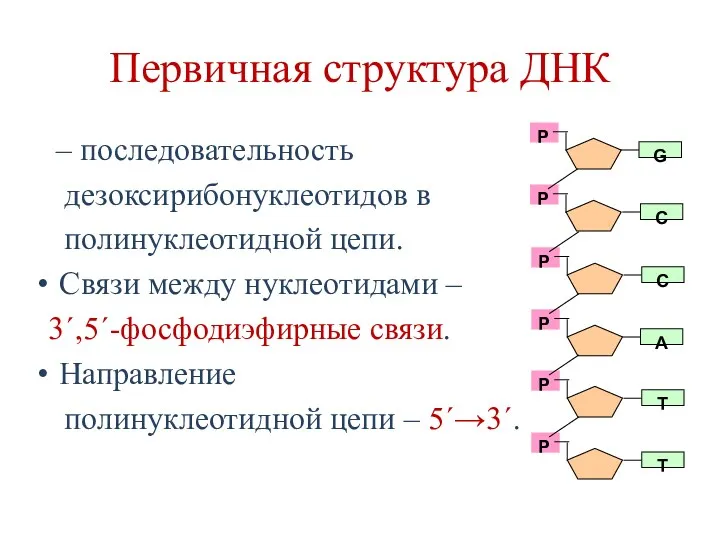
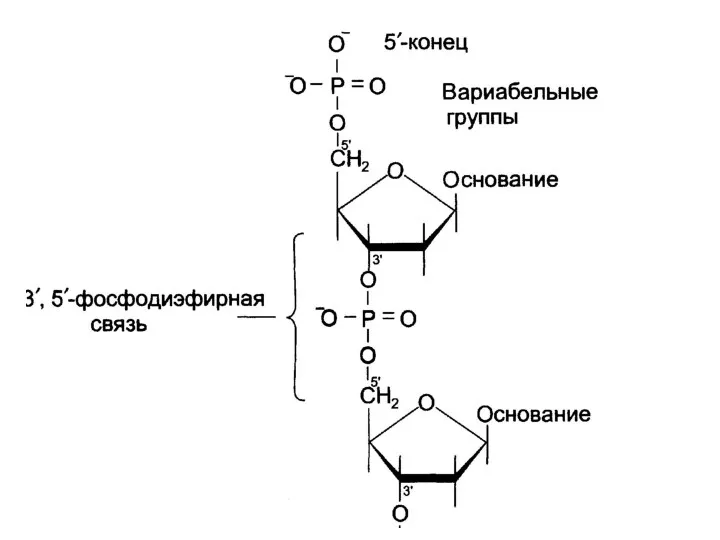
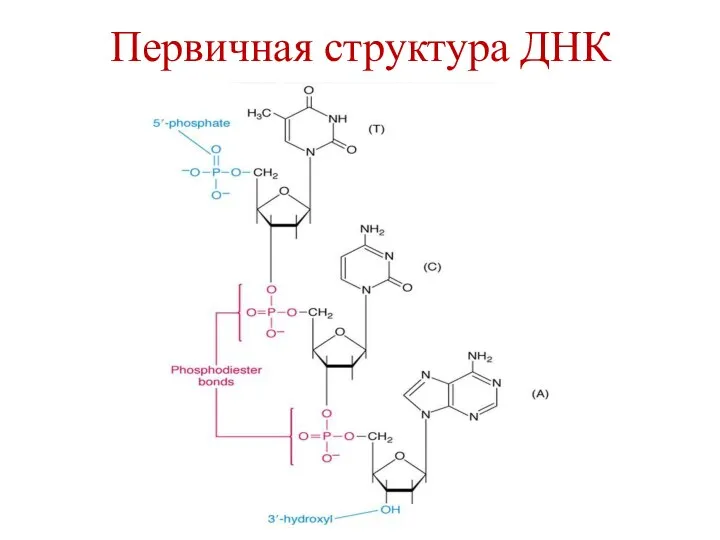
- 14. Первичная структура ДНК – последовательность дезоксирибонуклеотидов в полинуклеотидной цепи. Связи между нуклеотидами – 3´,5´-фосфодиэфирные связи. Направление
- 16. Первичная структура ДНК
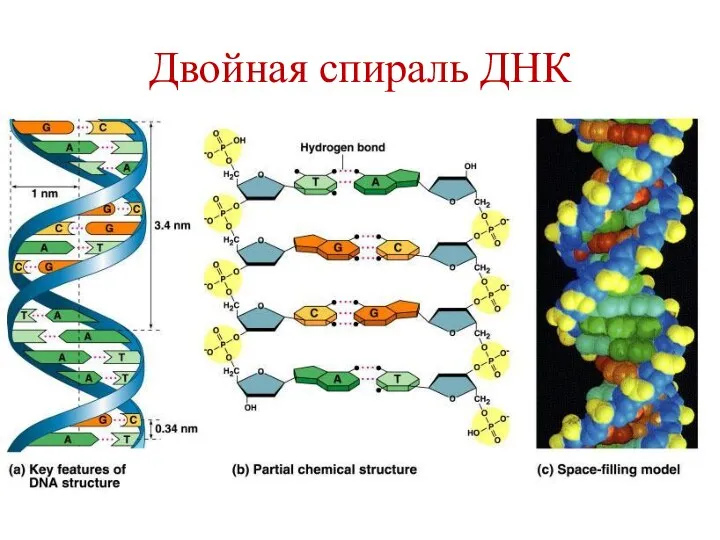
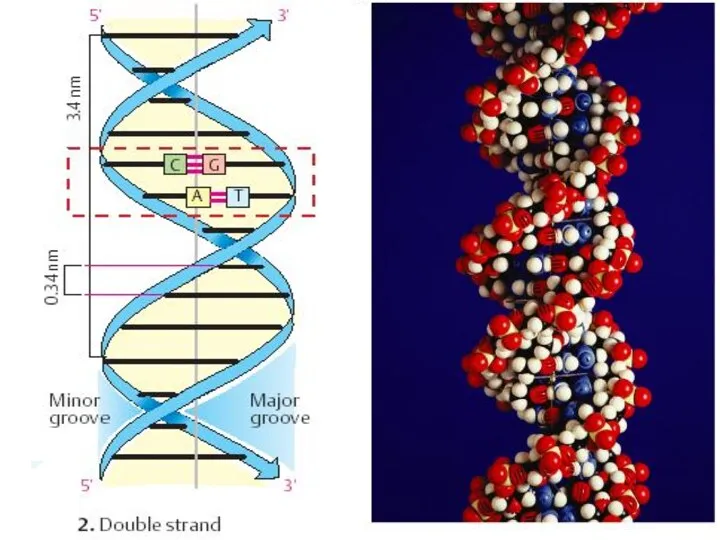
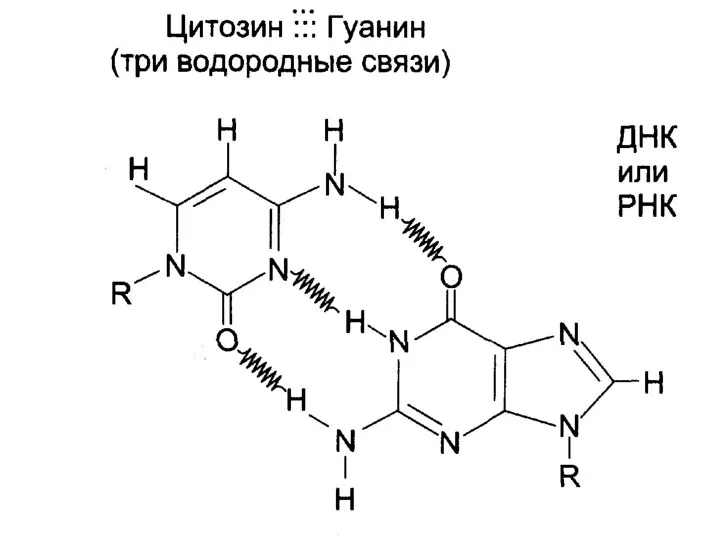
- 17. Двойная спираль ДНК (модель Дж. Уотсона и Ф. Крика, 1953 г.) Две антипаралельные, комплементарные полинуклеотидные цепи,
- 18. Двойная спираль ДНК
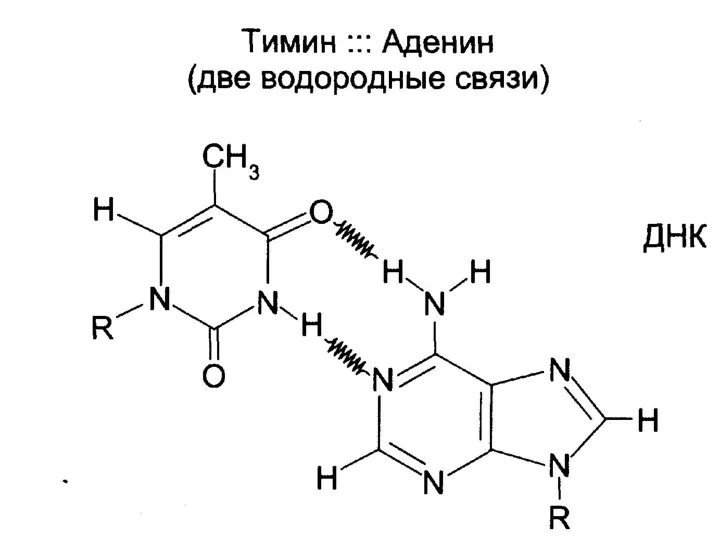
- 22. Правила Чаргаффа 1) молярная доля пуринов равна молярной доле пиримидинов: А+Г = Т+Ц 2) А+Ц =
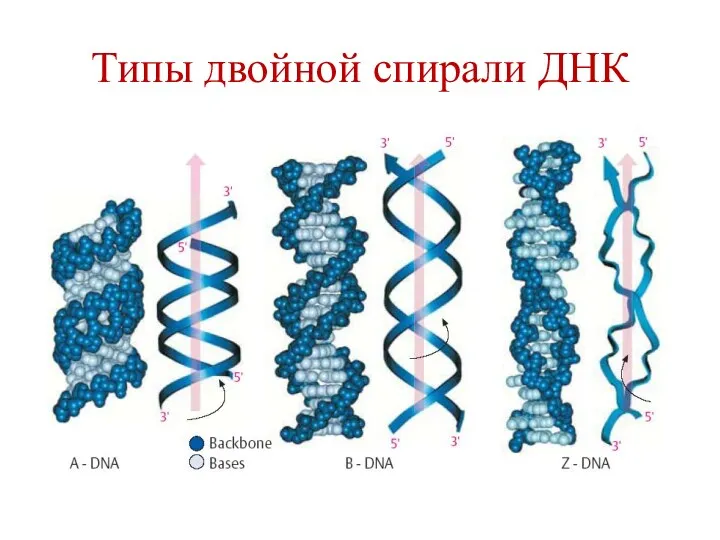
- 23. Типы двойной спирали ДНК Правозакрученные А, В, С Левозакрученная Z Тип В двойной спирали ДНК: Один
- 24. Типы двойной спирали ДНК
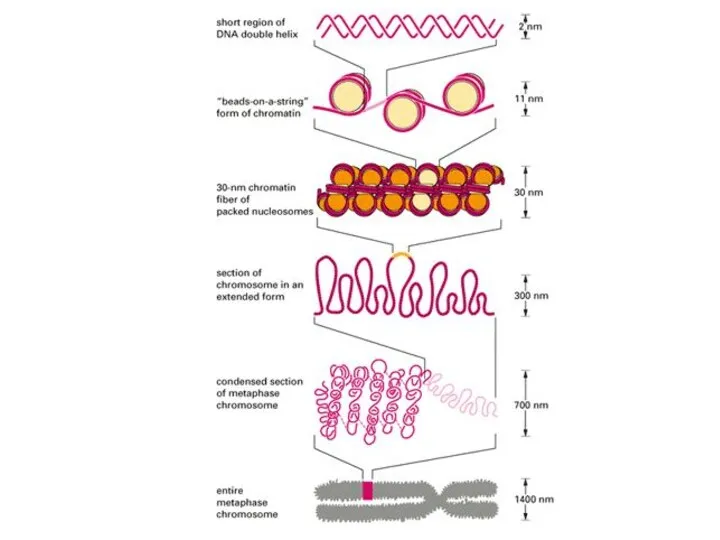
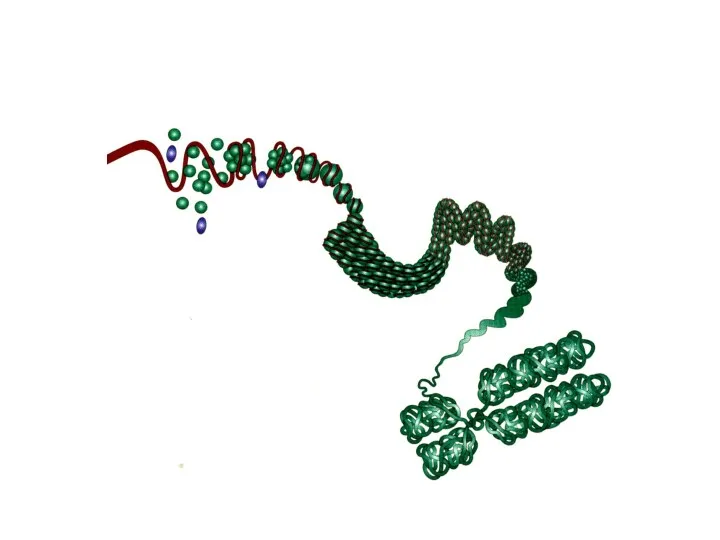
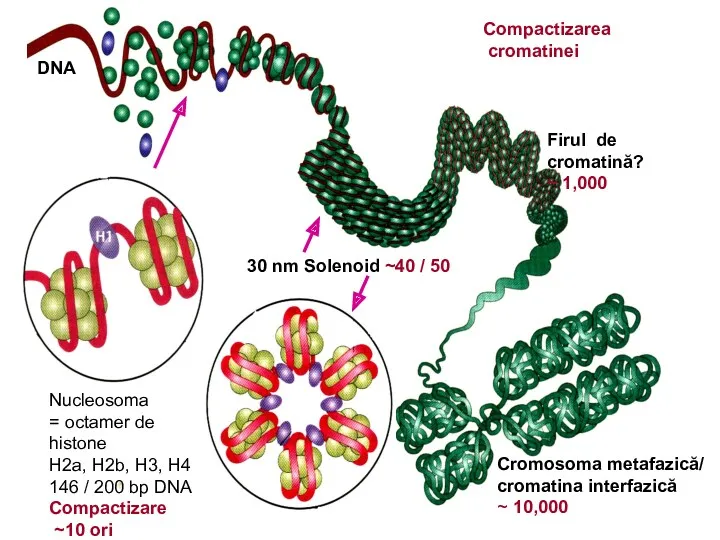
- 25. Следующий уровень компактизации и суперспирализации ДНК осуществляется с участием гистоновых и негистоновых белков. Гистоны – щелочные
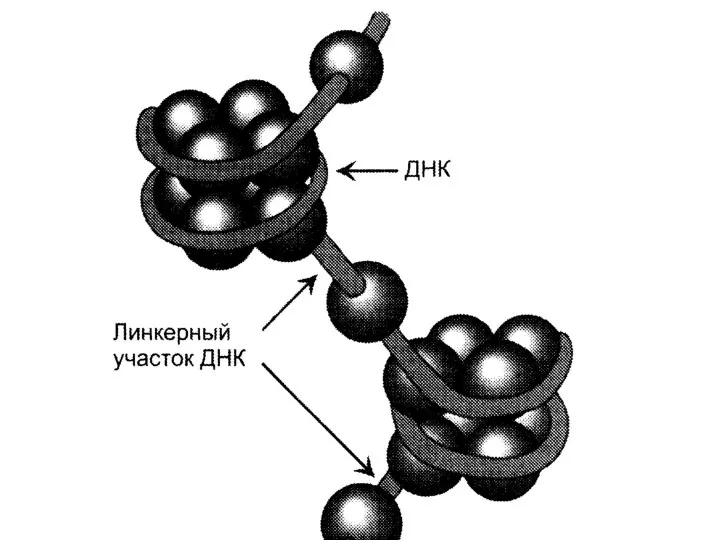
- 26. Нуклеосомы - 4 гистона образуют октамерный комплекс (Н2А, Н2В, Н3, Н4)2, вокруг которого накручивается двойная спираль
- 30. 30 nm Solenoid ~40 / 50 DNA Firul de cromatină? ~ 1,000 Cromosoma metafazică/ cromatina interfazică
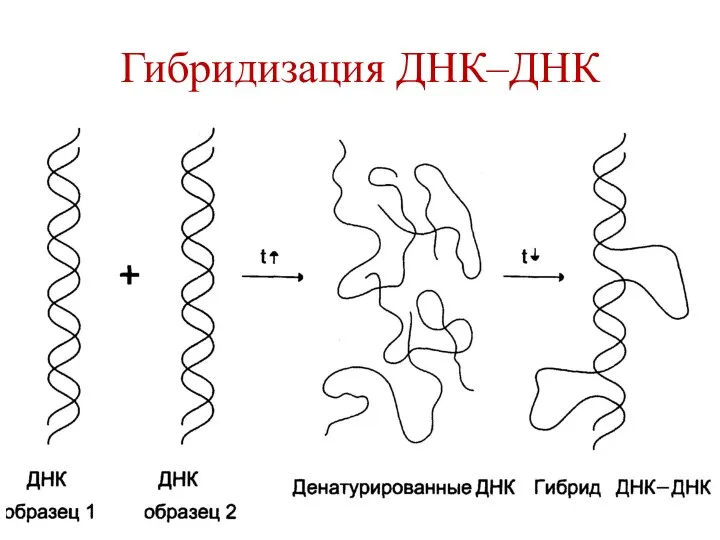
- 31. Денатурация ДНК Обратимый процесс (ренатурация или ренативация) – из-за комплементарности
- 32. Гибридизация ДНК–ДНК
- 33. Гибридизация ДНК–ДНК используется для: установления сходства или различия первичной структуры разных образцов ДНК: ДНК разных видов
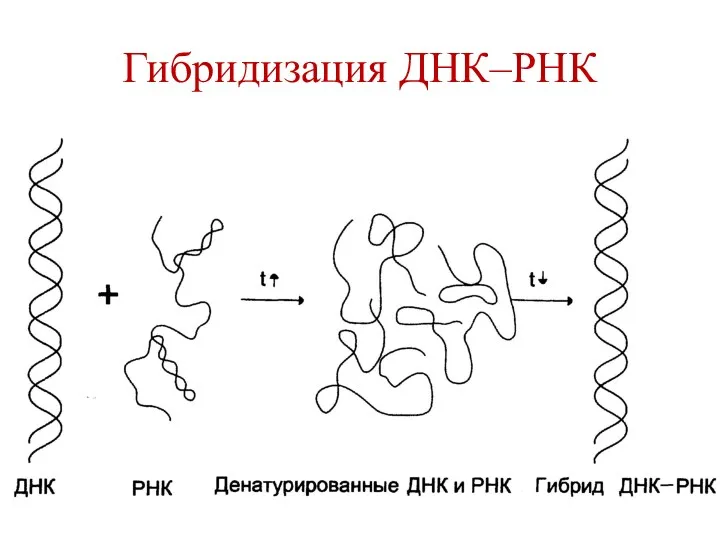
- 34. Гибридизация ДНК–РНК
- 35. Репликация ДНК Синтез ДНК на матрице ДНК (удвоение содержания ДНК) – протекает в S-фазе клеточного цикла,
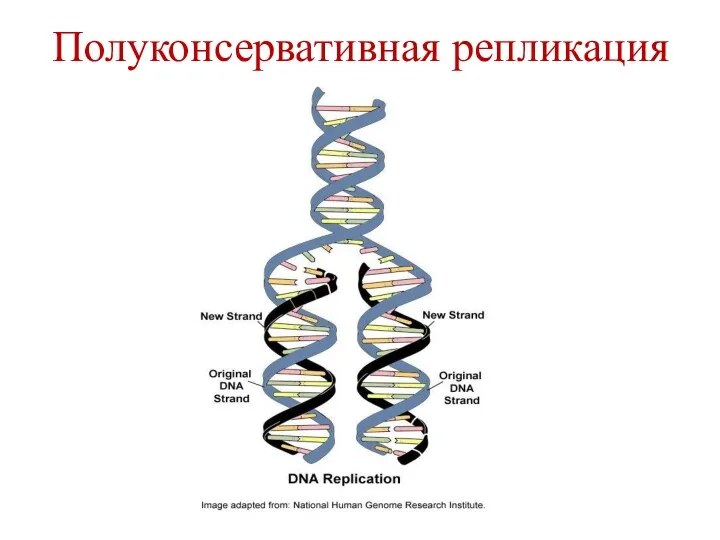
- 36. Полуконсервативная репликация
- 37. Необходимые условия для репликации ДНК Двухцепочечная матричная ДНК Дезоксирибонуклеозид трифосфаты (dАТФ, dГТФ, dЦТФ, dТТФ) Рибонуклеозид трифосфаты
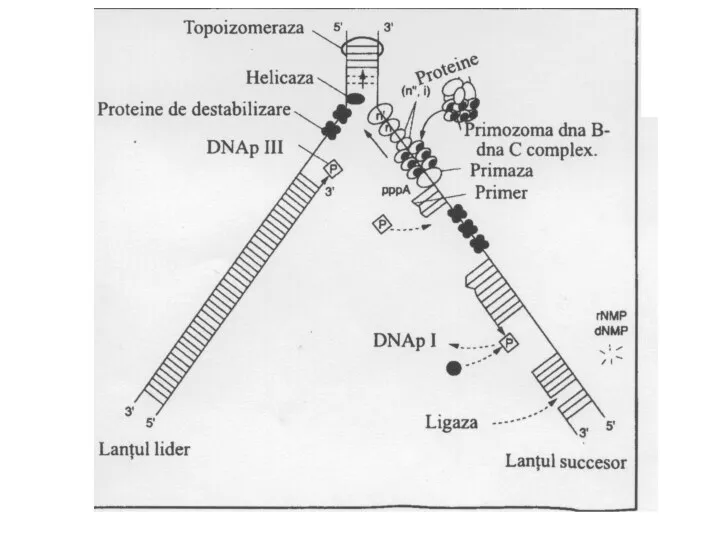
- 38. Ферменты репликации Геликазы – раскручивают (расплетают) двойную спираль ДНК, образуя репликационную вилку. SSB-белки – связываются к
- 39. Ферменты репликации Топоизомеразы – устраняют суперспирализацию ДНК. Эти ферменты создают супервитки, а также уничтожают суперспирализацию путем
- 40. Ферменты репликации ДНК-полимеразы ДНК-зависимые I,II, III. ДНК-полимераза III – основной фермент репликации: обладает полимеразной активностью 5´→3´
- 41. Ферменты репликации ДНК-лигаза – образует фосфодиэфирные связи между двумя фрагментами ДНК (в ходе репликации сшивает фрагменты
- 42. Этапы репликации Инициация Элонгация Терминация
- 43. Инициация репликации Включает: образование репликативной вилки – (геликаза, SSB-белки) синтез праймера на лидирующей цепи (праймаза) связывание
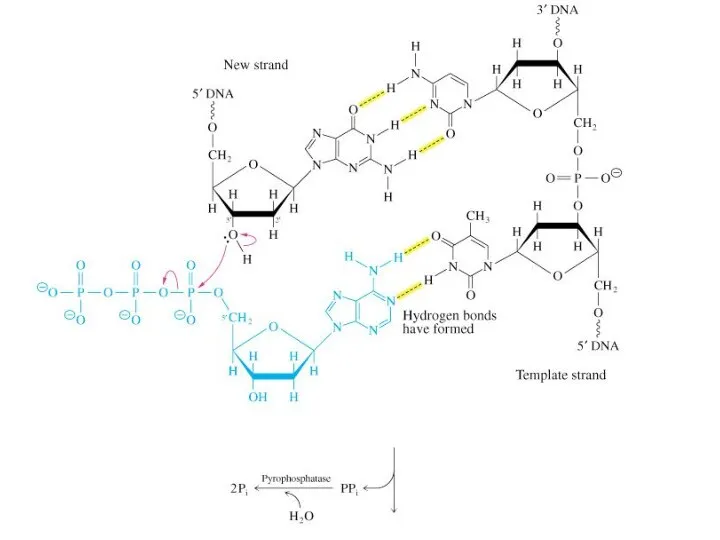
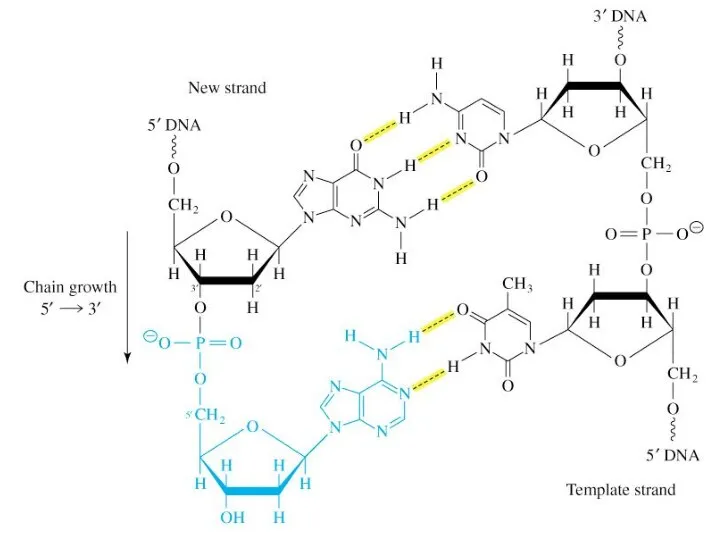
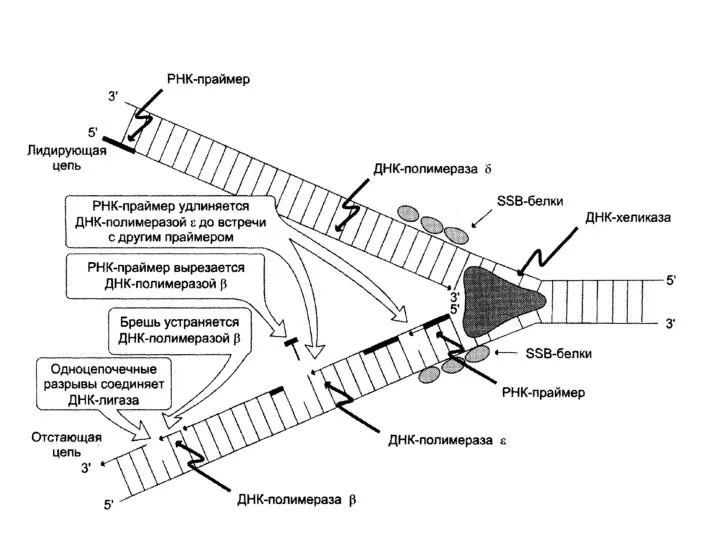
- 44. Элонгация репликации Заключается в последовательном присоединении дезоксирибонуклеотидов к растущей цепи (ДНК-полимераза III). Синтез одной цепи происходит
- 47. Элонгация репликации ДНК-полимераза I удаляет затравки и заменяет их на соответствующие фрагменты ДНК. ДНК-лигаза связывает фрагменты
- 49. Терминация репликации
- 50. Особенности репликации у эукариотов ДНК-полимеразы α, β, γ, δ, ε. ДНК-полимеразы не обладают экзонуклеазной активностью. Наличие
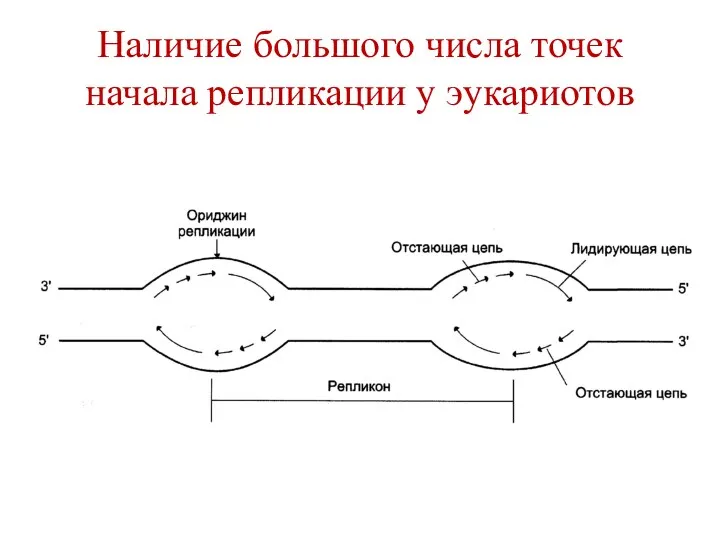
- 51. Наличие большого числа точек начала репликации у эукариотов
- 52. Точность репликации Частота ошибок при репликации составляет 10-6 -10-7. Точность репликации обеспечивается 2-мя факторами: Соблюдение принципа
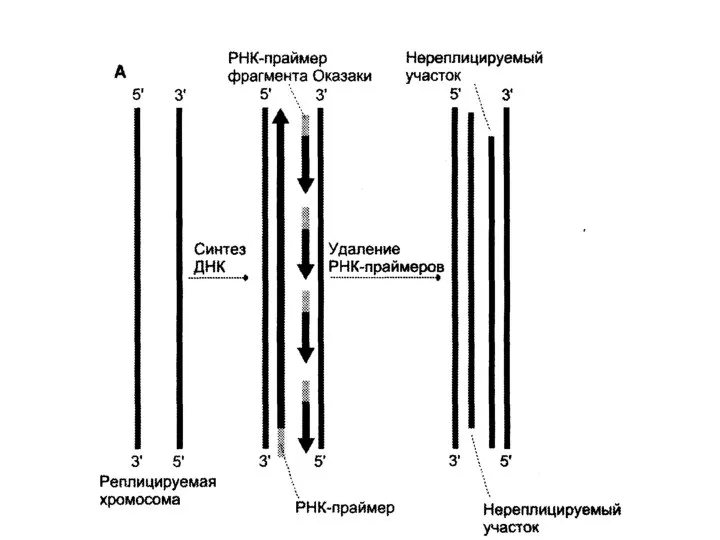
- 54. Теломеры и теломеразы Теломеры - повторяющиеся последовательности нуклеотидов ГГГТТА на концах хромосом. Теломеры необходимы для сохранения
- 55. Теломеры и теломеразы Это происходит потому, что ДНК-полимераза β, отвечающая за заполнение бреши, образованной после удаления
- 56. Теломеры и теломеразы Укорочение теломер в большинстве клеток по мере их старения – фактор, определяющий продолжительность
- 57. Теломеры и теломеразы В эмбриональных и других быстро делящихся клетках (эпителий кишечника, сперматозоиды) имеется фермент теломераза
- 60. Репарация ДНК Исправление ошибок, оставшихся после репликации, а также возникших под действием внешних физических или химических
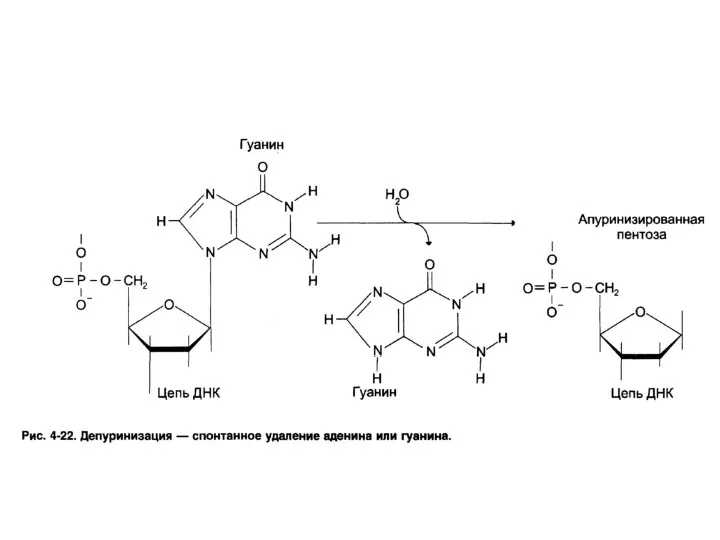
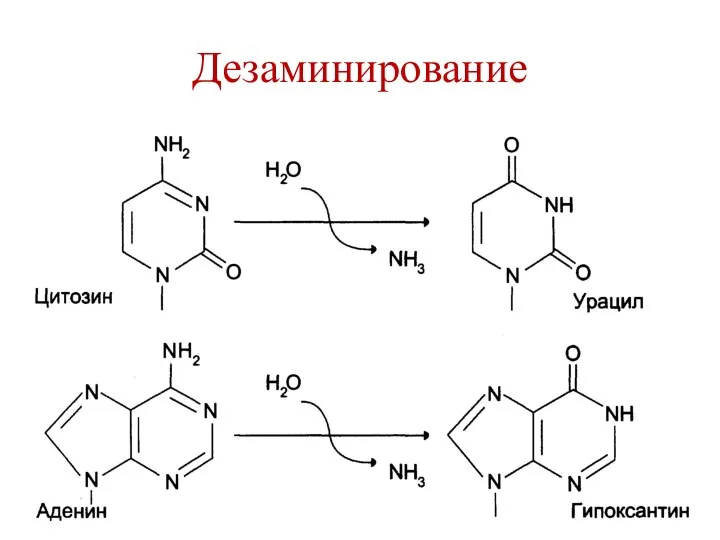
- 62. Дезаминирование
- 63. Этапы репарации ДНК (общие принципы) Выявление ошибки Устранение азотистого основания, нуклеотида или фрагмента ДНК. Замена правильным
- 64. Ферменты репарации ДНК ДНК-гликозидазы Эндонуклеазы Полимеразы ДНК-лигазы
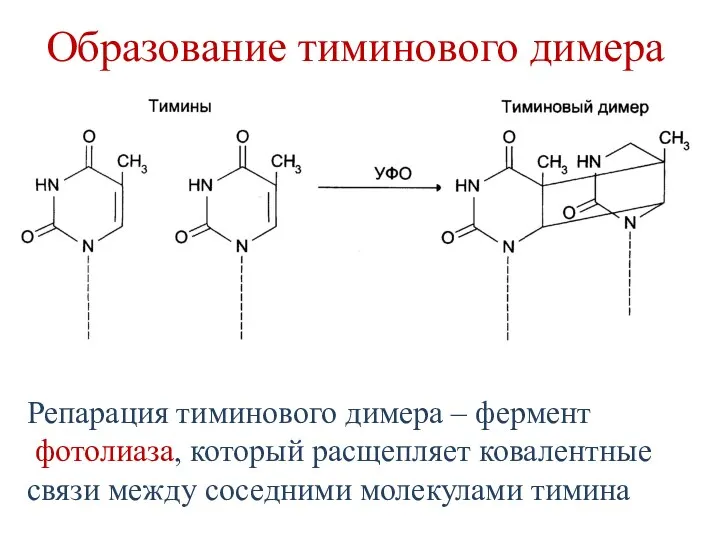
- 65. Образование тиминового димера Репарация тиминового димера – фермент фотолиаза, который расщепляет ковалентные связи между соседними молекулами
- 66. Наследственные болезни, вызванные дефектами репарационных систем Пигментная ксеродерма – сверх-чувствительность к УФ-свету, часто рак кожи.
- 67. Точечные мутации Замены Вставки Делеции
- 68. Мутации по типу замены «Молчащие» мутации (из-за вырожденности генетического кода)
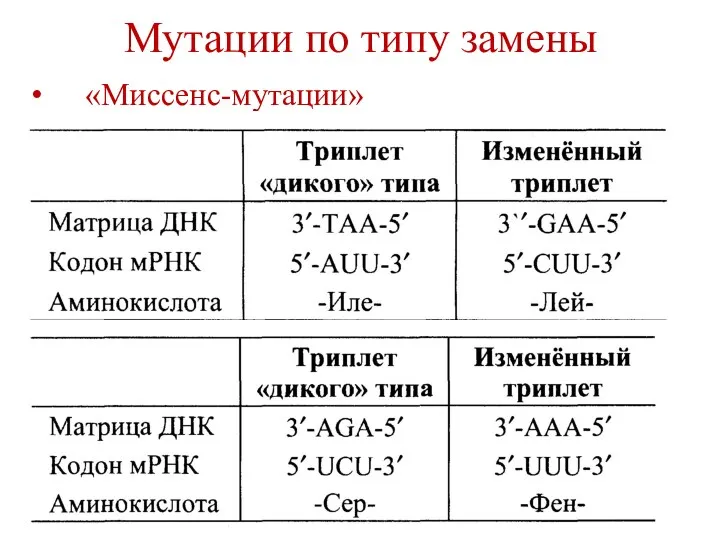
- 69. Мутации по типу замены «Миссенс-мутации»
- 70. Мутации по типу замены «Нонсенс-мутация»
- 71. Мутации по типу вставки или делеции Происходит сдвиг «рамки считывания» информации ДНК
- 72. Структура и функции РНК. Транскрипция
- 73. Типы и функции основных РНК транспортные РНК (тРНК) – транспорт аминокислот матричные РНК (мРНК) – являются
- 74. Первичная структура РНК – последовательность рибонуклеотидов в полинуклеотидной цепи. Связи между нуклеотидами – 3´,5´-фосфодиэфирные связи. Направление
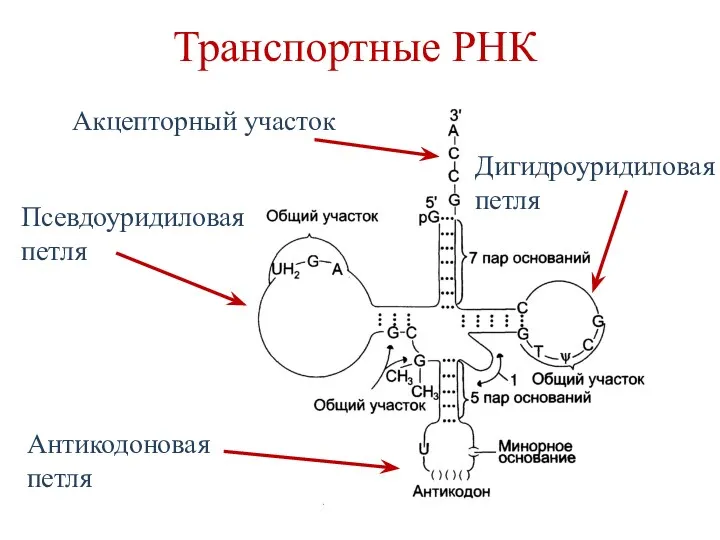
- 75. Транспортные РНК Вторичная структура – «клеверный лист» Короткие молекулы – 70-95 нуклеотидов Содержат много минорных оснований
- 76. Транспортные РНК Акцепторный участок – содержит ЦЦА-последовательность. Функция – связывание аминокислоты. Антикодоновая петля – содержит триплет
- 77. Транспортные РНК Акцепторный участок Псевдоуридиловая петля Дигидроуридиловая петля Антикодоновая петля
- 78. Транскрипция Биосинтез РНК на матрице ДНК. Направление транскрипции – 5´→3´. Принцип – комплементарность. Ассиметричный процесс –
- 79. Необходимые условия для транскрипции Двухцепочечная матричная ДНК Рибонуклеозид трифосфаты (АТФ, ГТФ, ЦТФ, УТФ) Mg2+ , Mn2+,
- 80. РНК-полимераза является холоферментом, состоящим из 2α, по одной β, β´и σ субъединиц. Субъединица σ соединяется с
- 81. Отличия транскрипции и репликации
- 82. Этапы транскрипции Инициация Элонгация Терминация
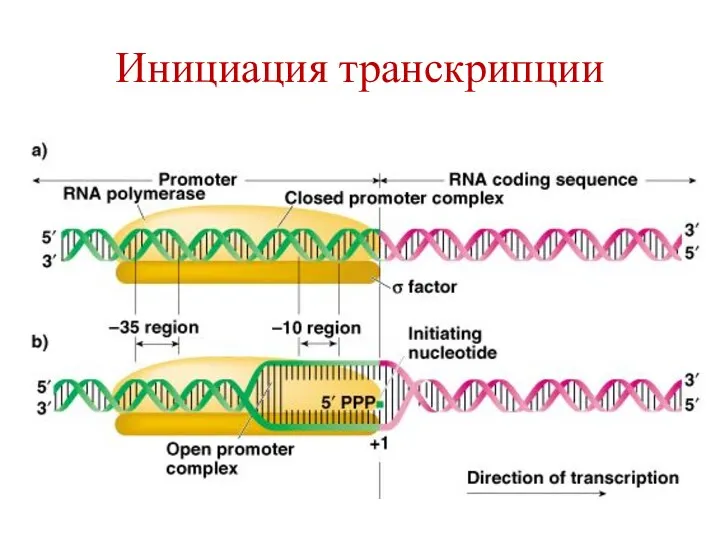
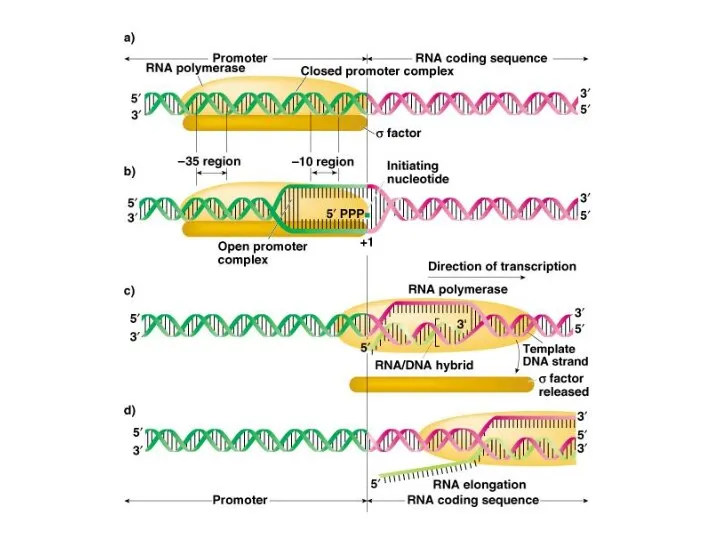
- 83. Инициация транскрипции РНК полимераза связывается к промотору в участке ТТГАЦА (-35) благодаря σ-субчастице, которая узнает этот
- 84. Инициация транскрипции Когда фермент достигает точку начала транскрипции (+1), он образует фосфодиэфирную связь между первыми 2-мя
- 85. Инициация транскрипции
- 86. Элонгация транскрипции РНК-полимераза скользит по ДНК, образуя фосфодиэфирные связи между рибонуклеотидами, используя в качестве матрицы антикодогенную
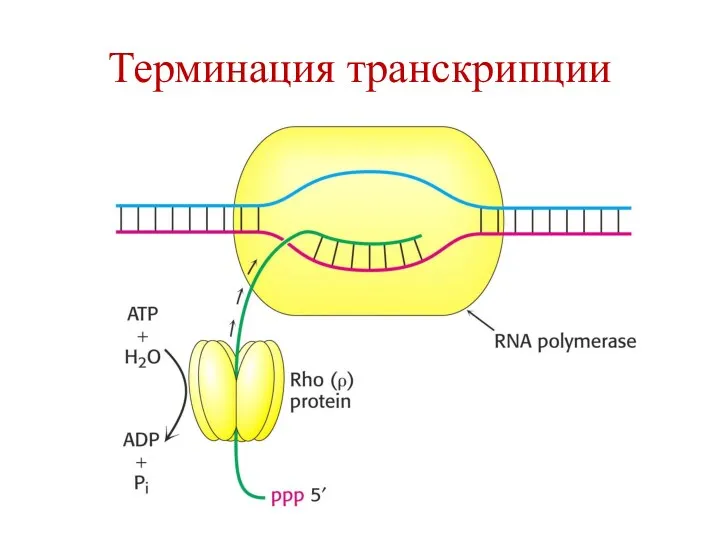
- 88. Терминация транскрипции происходит когда РНК-полимераза достигает терминирующего участка, содержащего много пар Г-Ц. ρ-фактор присоединяется к «кор-ферменту»
- 89. Терминация транскрипции
- 90. Особенности транскрипции у эукариот Наличие 3-х РНК-полимераз: РНК-полимераза I – синтезирует рРНК 45S. РНК-полимераза II –
- 91. Особенности транскрипции у эукариот Наличие кассеты ЦААТ и ГЦ – отвечают за частоту транскрипции. Наличие кассеты
- 92. Процессинг РНК у эукариот В результате транскрипции образуются предшественники РНК (пре-РНК), которые несут и неинформативные участки.
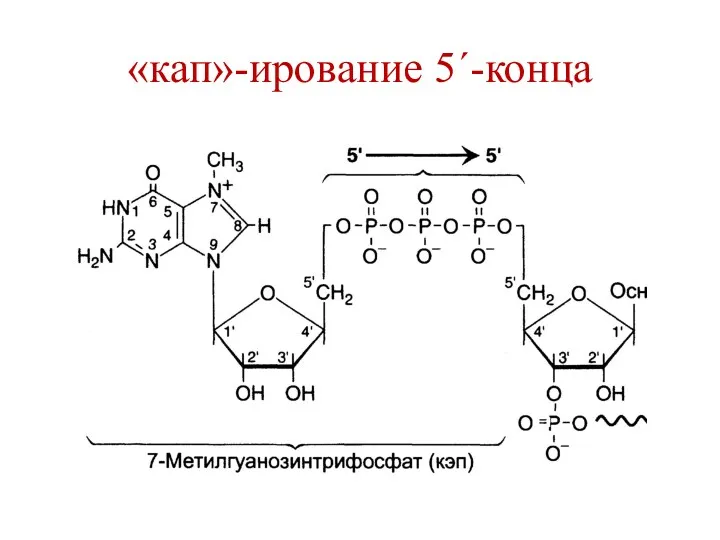
- 93. Процессинг мРНК «кап»-ирование 5´-конца. Фермент гуанилилтрансфераза переносит с ГТФ на 5´-конец мРНК ГДФ, образуя 5´-5´-фосфодиэфирную связь.
- 94. «кап»-ирование 5´-конца
- 95. Процессинг мРНК 2. «полиаденилирование» 3´-конца – присоединение к 3´-концу мРНК 100-200 адениловых нуклеотидов (фермент поли-А-полимераза). Значение:
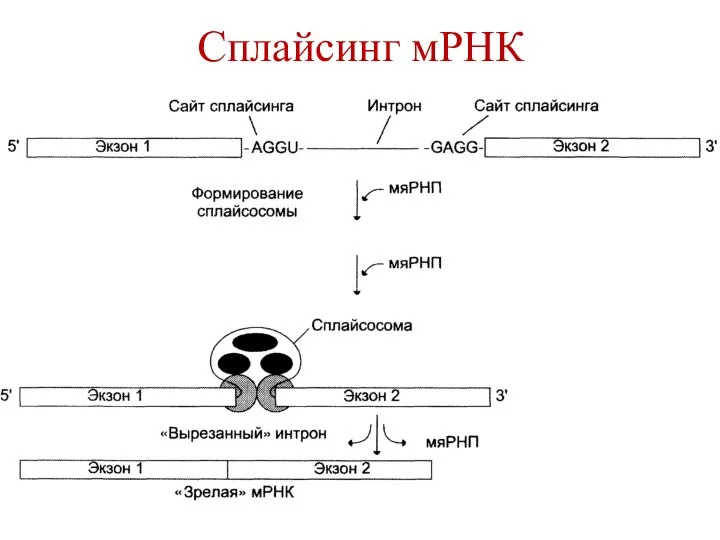
- 96. Процессинг мРНК 3. Сплайсинг – вырезание интронов и соединение концов экзонов. Осуществляется с участием малоядерных РНК
- 97. Сплайсинг мРНК На первой стадии мяРНК связываются с сайтами сплайсинга. При образовании сплайсосомы концы экзонов сближаются.
- 98. Сплайсинг мРНК
- 99. Процессинг тРНК 1. Образование ЦЦА-последовательности на 3´-конце: За счет отщепления нуклеотидов под действием РНК-нуклеаз до достижения
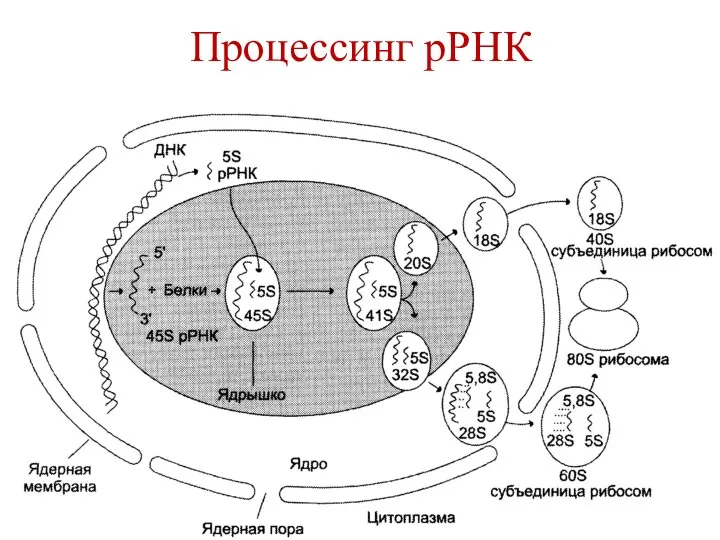
- 100. Процессинг рРНК Из общего предшественника 45S рРНК образуются: 18S рРНК (входит в состав малой субчастицы рибосомы),
- 101. Процессинг рРНК
- 102. Регуляция экспрессии генов у прокариотов Ферменты 3-х типов: Конститутивные – присутствующие в клетках в постоянных количествах.
- 103. Теория Lac-оперона (Франсуа Жакоб и Жак Моно, 1961) Теория индукции ферментов была разработана на пример Lac-оперона
- 104. Теория Lac-оперона (Франсуа Жакоб и Жак Моно, 1961) Кишечная палочка обычно культивируется на среде, содержащей в
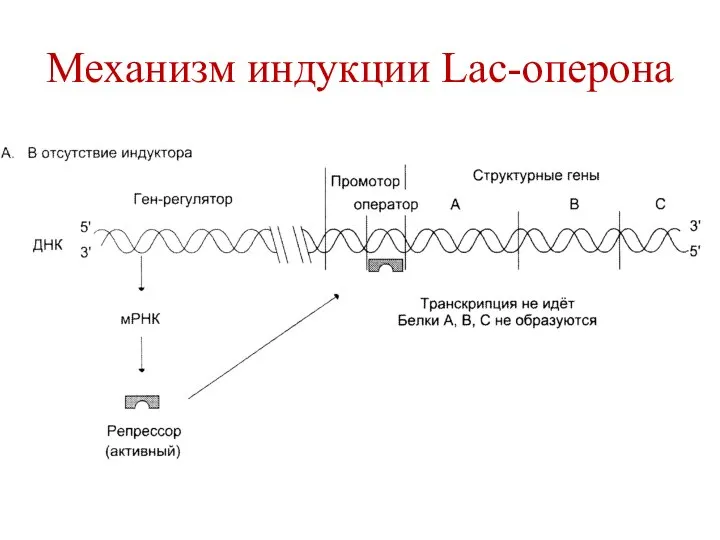
- 105. Механизм индукции Lac-оперона В отсутствии индуктора (лактозы), белок-репрессор связан с оператором, что препятствует связыванию РНК-полимеразы с
- 106. Механизм индукции Lac-оперона
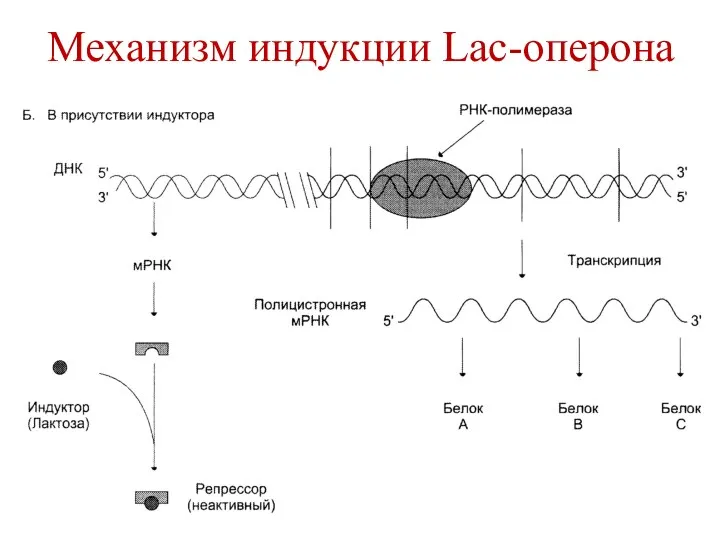
- 107. Механизм индукции Lac-оперона При появлении в среде индуктора, он присоединяется к белку-репрессору и уменьшает его сродство
- 108. Механизм индукции Lac-оперона
- 109. Механизм репрессии синтеза белков Если кишечная палочка растет на среде, содержащей в качестве источника азота соли
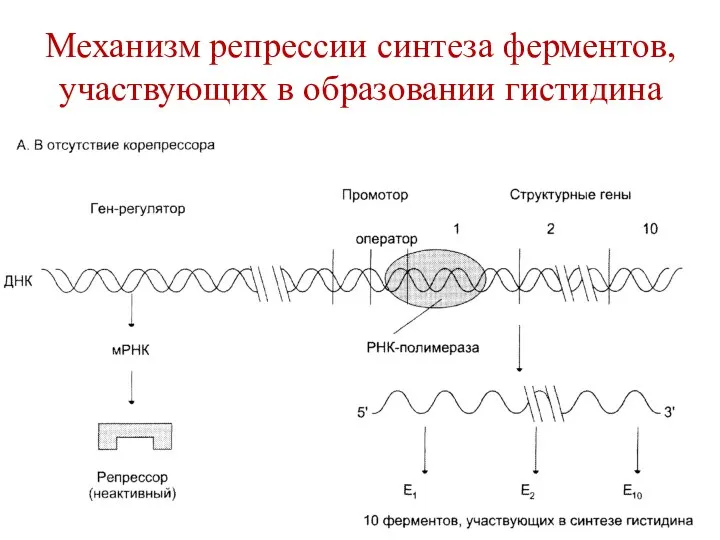
- 110. Механизм репрессии синтеза ферментов, участвующих в образовании гистидина При отсутствии в среде гистидина белок-репрессор неактивен и
- 111. Механизм репрессии синтеза ферментов, участвующих в образовании гистидина
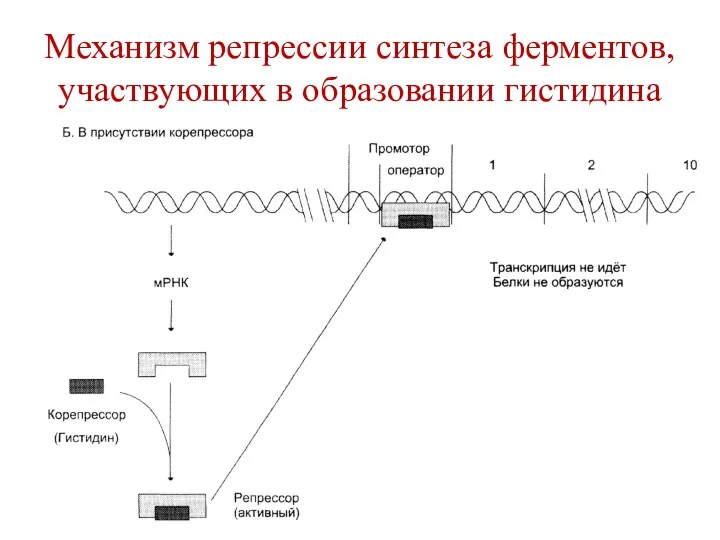
- 112. Механизм репрессии синтеза ферментов, участвующих в образовании гистидина При добавлении в среду гистидина (корепрессор), он связывается
- 113. Механизм репрессии синтеза ферментов, участвующих в образовании гистидина
- 114. Индукция и репрессия (отличия)
- 115. Механизмы регуляции экспрессии генов у эукариотов Организация хроматина: Гены гетерохроматина подвергаются репрессии. Гены эухроматина обладают транскрипционной
- 116. Механизмы регуляции экспрессии генов у эукариотов 3. Перестройка генов: Генетическая рекомбинация. Регуляция транскрипции. Посттранскрипционная регуляция: Альтернативный
- 117. Механизмы регуляции экспрессии генов у эукариотов 6. Регуляция трансляции и посттрансляционных модификаций: Изменение скорости трансляции. Различия
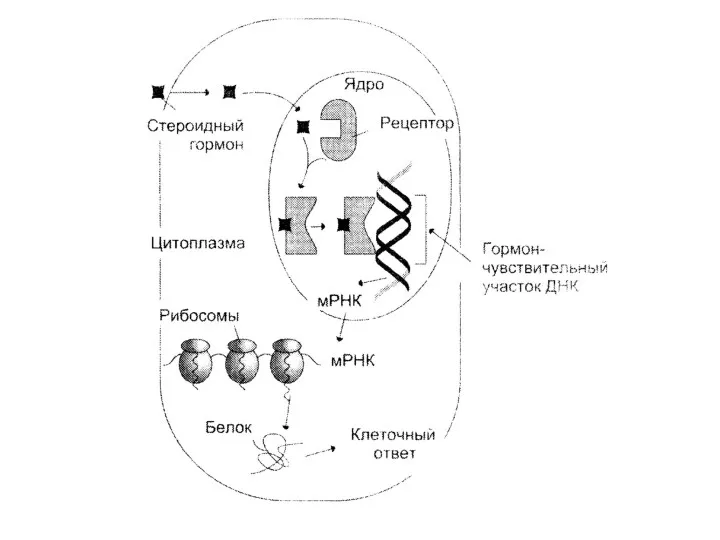
- 118. Регуляция транскрипции 1. Белки-активаторы транскрипции. Содержат следующие домены: ДНК-связывающие домены. Домены, активирующие транскрипцию. Антирепрессорные домены. Лиганд-связывающие
- 119. Регуляция транскрипции 1. Лиганды-индукторы транскрипции. Стероидные гормоны Тиреоидные гормоны Кальцитриол Ретиноевая кислота 2. Лиганды-репрессоры транскрипции Конечные
- 120. Регуляция транскрипции Энхансеры и сайленсеры Элементы ответа, или cis-элементы.
- 122. Обратная транскрипция Синтез РНК на матрице ДНК. Характерна для РНК-содержащих вирусов (ретровирусы, онкорновирусы). Эти вирусы имеют
- 123. Обратная транскрипция При поступлении вируса в клетку-хозяина обратная транскриптаза синтезирует цепь ДНК, используя в качестве матрицы
- 124. Биосинтез белка (трансляция)
- 125. Биосинтез белков (трансляция) перевод информации, заключенной в нуклеотидной последовательности мРНК, в аминокислотную последовательность белка.
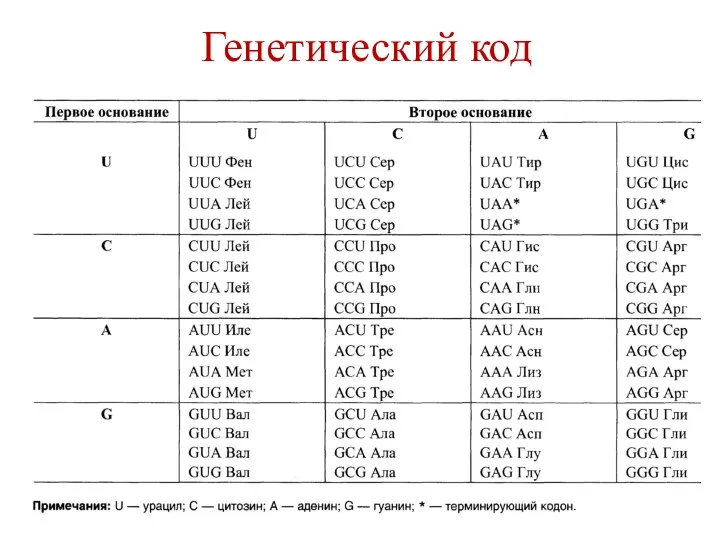
- 126. Генетический код «словарь», посредством которого генетическая информация, заключенная в определенную последовательность нуклеотидов в ДНК и мРНК,
- 127. Свойства генетического кода Триплетность – одна аминокислота кодируется 3-мя нуклеотидами (кодон) – 43=64 61 кодон –
- 128. Свойства генетического кода Специфичность – каждому кодону соответствует только одна определенная аминокислота. Вырожденность – большая часть
- 129. Генетический код
- 130. Биосинтез белка – необходимые компоненты Аминокислоты тРНК Аминоацил-тРНК-синтетазы мРНК Рибосомы АТФ, ГТФ Ионы магния Белковые факторы
- 131. Рибосомы Прокариоты – 70S: Малая субъединица 30S – рРНК 16S и 21 белок. Большая субъединица 50S
- 132. Рибосомы Эукариоты – 80S : Малая субъединица 40S – рРНК 18S и 33 белка. Большая субъединица
- 133. Этапы биосинтеза белка Активация аминокислот Собственно-биосинтез белка: Инициация Элонгация Терминация
- 134. Активация аминокислот присоединение аминокислоты к соответствующей ей тРНК (к 3´-концу). Происходит в цитоплазме Необходимые компоненты: Все
- 135. Активация аминокислот суммарная реакция Аминокислота + тРНК + АТФ → аминоацил-тРНК + АМФ + Н4Р2О7 Реакция
- 136. Аминоацил-тРНК-синтетазы в активном центре содержится 4 участка: Для связывания аминокислоты Для связывания тРНК Для связывания АТФ
- 137. Собственно-биосинтез белка синтез полипептидной цепи протекает в направлении N→C. мРНК читается в направлении 5´→3´.
- 138. Инициация трансляции – необходимые компоненты мРНК с инициирующим кодоном AUG Малая и большая субъединицы рибосомы Формил-метионил-тРНК
- 139. Инициация трансляции К малой субъединице присоединяется IF-3, препятствующий связыванию большой субъединицы. Малая субъединица присоединяется к 5´
- 140. Инициация трансляции В процессе связывания формил-метионил-тРНК участвуют факторы инициации IF-1 и IF-2 и происходит гидролиз ГТФ
- 141. Элонгация трансляции – необходимые компоненты Иницииующий комплекс Все аминоацил-тРНК ГТФ, ионы магния Белковые факторы элонгации Tu,
- 142. Элонгация трансляции Связывание следующей аминоацил-тРНК к мРНК напротив 2-го кодона, находящегося в участке А рибосомы. Правильное
- 143. Элонгация трансляции Транспептидация – образование пептидной связи между первыми 2-мя аминокислотами за счет переноса формил-метионина на
- 144. Элонгация трансляции Транслокация – перемещение рибосомы к 3´-концу мРНК на один кодон. тРНК, связанная к инициирующему
- 145. Элонгация трансляции процесс повторяется до достижения рибосомой одного из терминирующих кодонов.
- 146. Терминация трансляции – необходимые условия Наличие на мРНК одного из терминирующих кодонов Белковые факторы терминации R1,
- 147. Терминация трансляции Отщепление полипептидной цепи от тРНК. Освобождение тРНК от рибосомы Диссоциация рибосомы на субъединицы Гидролиз
- 148. Особенности трансляции у эукариот Инициирующей аминокислотой является метионин мРНК является моноцистронной Скорость синтеза выше мРНК читается
- 149. Посттрансляционные изменения полипептидной цепи протекают во время и после синтеза белка. Частичный протеолиз Ковалентная модификация аминокислот:
- 150. Посттрансляционные изменения полипептидной цепи протекают во время и после синтеза белка. Частичный протеолиз Ковалентная модификация аминокислот:
- 151. Ингибиторы синтеза белка На уровне репликации: Aктиномицин D – интеркалирует между парами оснований Г-Ц, блокируя репликацию
- 152. Ингибиторы трансляции Стрептомицин – ингибирует инициацию (связываются к малой субъединице рибосомы, препятствуя связыванию метионил-тРНК к рибосоме
- 153. Ингибиторы трансляции Левомицетин – ингибируют элонгацию (связывается к большой субъединце, ингибируя пептидилтрансферазу). Эритромицин – ингибирует элонгацию
- 154. Полиморфизм белков существование в популяции 2-х или большего числа аллелей одного гена. Примеры: Гемоглобины человека Группы
- 155. Варианты гемоглобинов HbA – 2α2β HbA2 – 2α2δ HbF – 2α2γ – фетальный HbE – 2α2ε2
- 156. Группы крови 3 аллельных варианта гена фермента гликозилтрансфераза А, В и 0. Фермент участвует в синтезе
- 157. Группы крови Вариант А катализирует присоединение к олигосахариду N-ацетилгалактозамина. Вариант В катализирует присоединение к олигосахариду галактозы.
- 158. Группы крови 4 группы крови: I – 0 (содержит анти-А и анти-В) – «универсальные доноры» эритроцитарной
- 160. Скачать презентацию

















































































































 Нервная система, органы чувств, эндокринная система
Нервная система, органы чувств, эндокринная система Опора и движение
Опора и движение Генетика пола. Сцепленное с полом наследование
Генетика пола. Сцепленное с полом наследование Немецкая овчарка
Немецкая овчарка Дикие и домашние животные
Дикие и домашние животные Мир комнатных растений. Окружающий мир 2 класс
Мир комнатных растений. Окружающий мир 2 класс Аурулардың патогенді факторлары. Дәнді дақылдардың саңырауқұлақ аурулары
Аурулардың патогенді факторлары. Дәнді дақылдардың саңырауқұлақ аурулары Урок по ФГОС . История изучения клетки. Методы изучения клетки. Лабораторная работа Строение клеток кожицы чешуи лука.
Урок по ФГОС . История изучения клетки. Методы изучения клетки. Лабораторная работа Строение клеток кожицы чешуи лука. Вирусы в биотехнологии
Вирусы в биотехнологии Цитология - наука о клетке
Цитология - наука о клетке Строение и функции пищеварительной системы
Строение и функции пищеварительной системы Царство Гриби. Вищі гриби. Шапкові гриби
Царство Гриби. Вищі гриби. Шапкові гриби Способы размножения. Митоз
Способы размножения. Митоз Предмет і завдання медичної мікробіології. Систематика і номенклатура мікроорганізмів
Предмет і завдання медичної мікробіології. Систематика і номенклатура мікроорганізмів Обмен липидов
Обмен липидов Мастер-класс Использование MimioStudio в учебном процессе
Мастер-класс Использование MimioStudio в учебном процессе Доказательства и основные этапы антропогенеза
Доказательства и основные этапы антропогенеза Дыхание. Значение дыхания в живых организмах
Дыхание. Значение дыхания в живых организмах Механизмы эволюции. Микроэволюция. Вид, популяция и её характеристики
Механизмы эволюции. Микроэволюция. Вид, популяция и её характеристики Бурундуки
Бурундуки Биологические полимеры – нуклеиновые кислоты
Биологические полимеры – нуклеиновые кислоты ПрезентацияХрящевые рыбы
ПрезентацияХрящевые рыбы Красная книга растений
Красная книга растений Кожа. Особенности строения. Функции кожи
Кожа. Особенности строения. Функции кожи Черенкование комнатных растений. Лабораторная работа № 5
Черенкование комнатных растений. Лабораторная работа № 5 Собственно бесполое размножение растений
Собственно бесполое размножение растений Живое клеточный уровень. Живое организменный уровень ботаника. Живое организменный уровень зоология
Живое клеточный уровень. Живое организменный уровень ботаника. Живое организменный уровень зоология Задание к теме:формы естественного отбора.
Задание к теме:формы естественного отбора.