Содержание
- 2. Строение Ферменты – это биокатализаторы, преимущественно белковой природы и некоторые РНК, которые принимают участие в химических
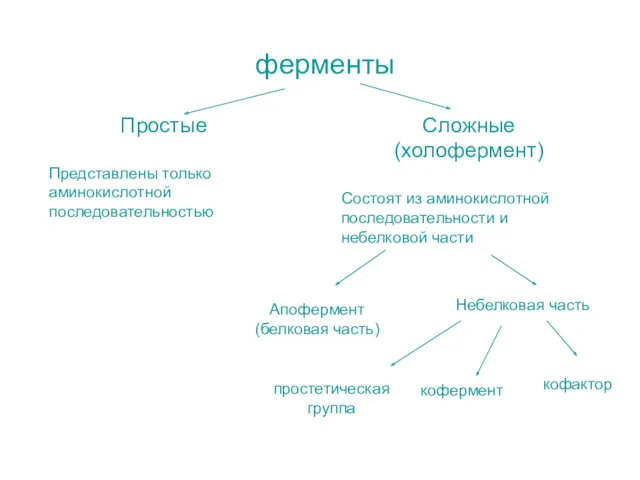
- 3. ферменты Простые Представлены только аминокислотной последовательностью Сложные (холофермент) Состоят из аминокислотной последовательности и небелковой части Апофермент
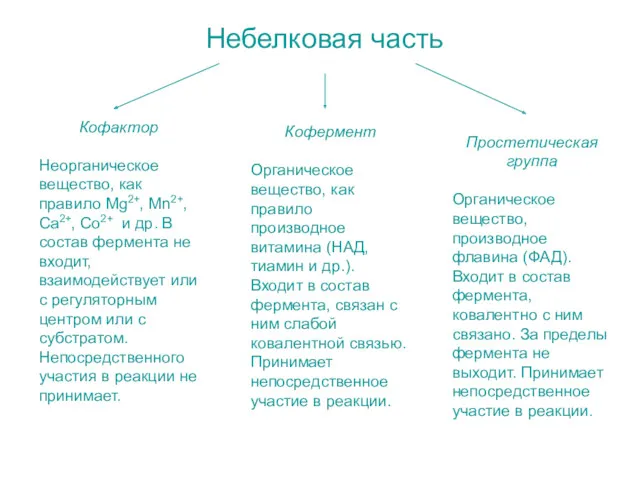
- 4. Небелковая часть Кофактор Неорганическое вещество, как правило Mg2+, Mn2+, Ca2+, Co2+ и др. В состав фермента
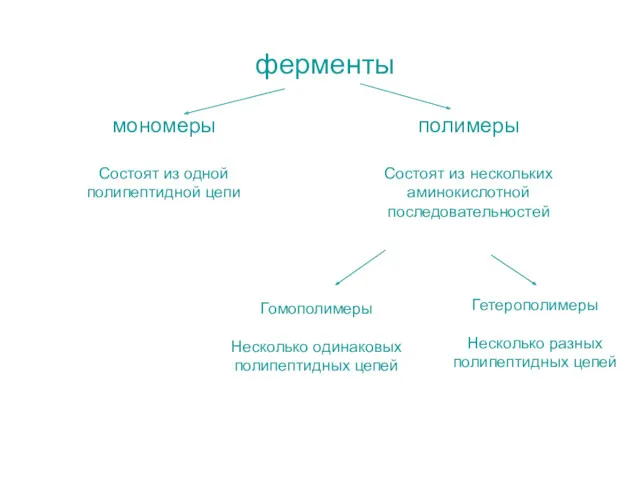
- 5. ферменты мономеры Состоят из одной полипептидной цепи полимеры Состоят из нескольких аминокислотной последовательностей Гомополимеры Несколько одинаковых
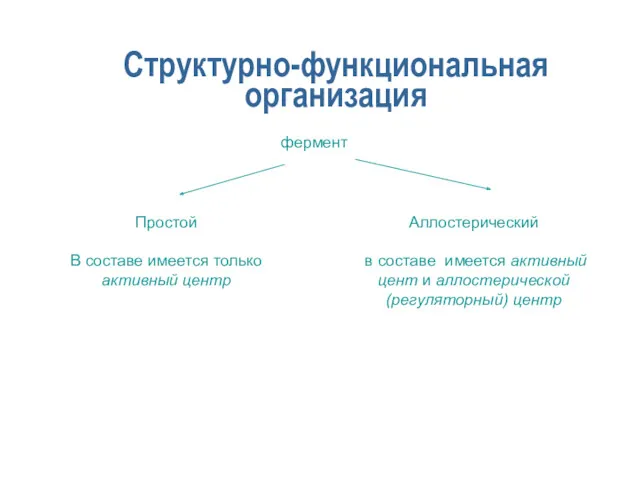
- 6. Структурно-функциональная организация фермент Простой В составе имеется только активный центр Аллостерический в составе имеется активный цент
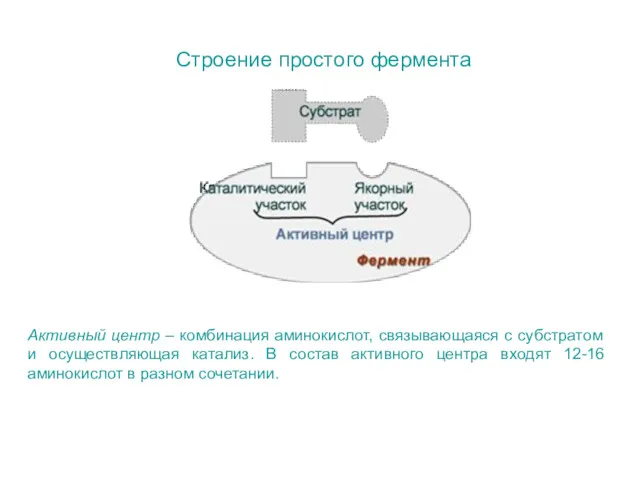
- 7. Строение простого фермента Активный центр – комбинация аминокислот, связывающаяся с субстратом и осуществляющая катализ. В состав
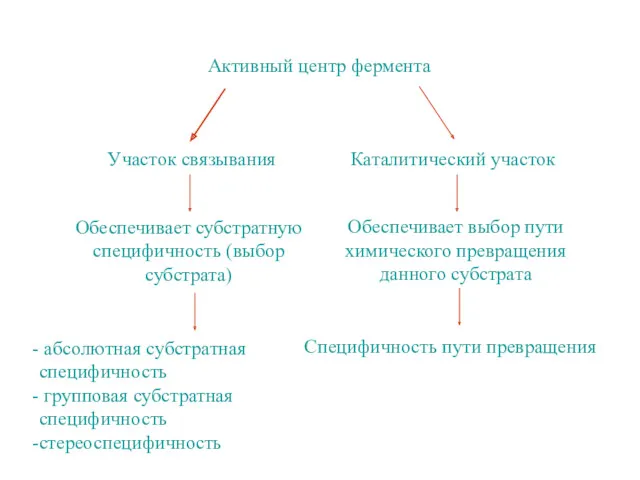
- 8. Активный центр фермента Участок связывания Каталитический участок Обеспечивает субстратную специфичность (выбор субстрата) абсолютная субстратная специфичность групповая
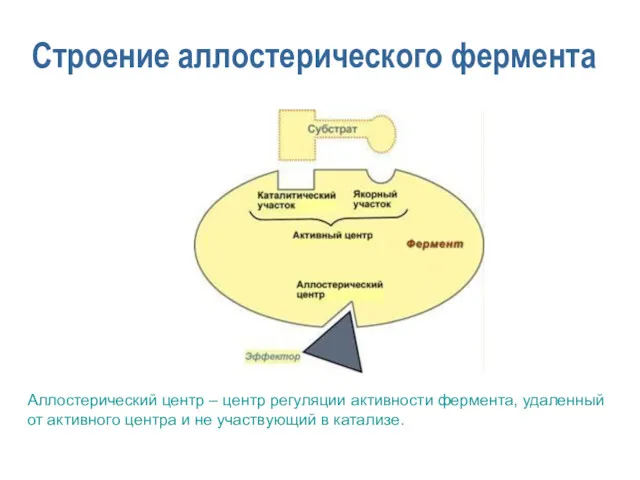
- 9. Строение аллостерического фермента Аллостерический центр – центр регуляции активности фермента, удаленный от активного центра и не
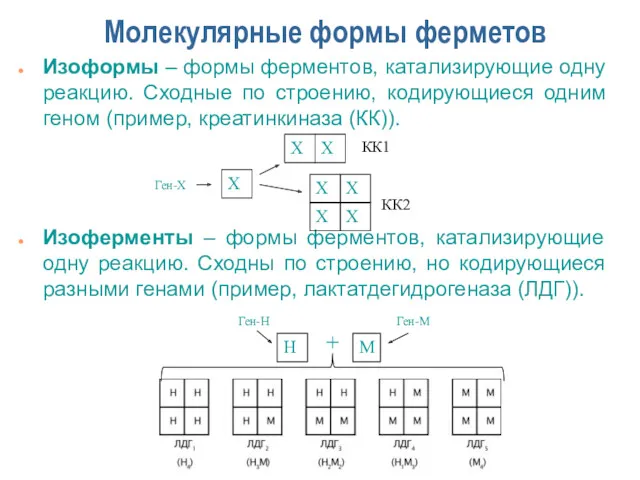
- 10. Молекулярные формы ферметов Изоформы – формы ферментов, катализирующие одну реакцию. Сходные по строению, кодирующиеся одним геном
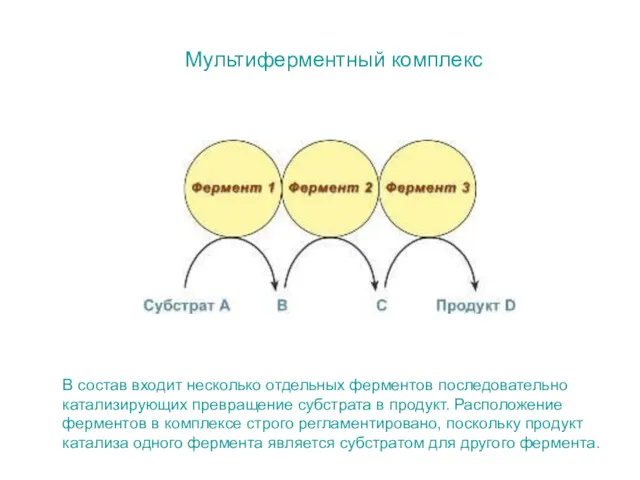
- 11. Мультиферментный комплекс В состав входит несколько отдельных ферментов последовательно катализирующих превращение субстрата в продукт. Расположение ферментов
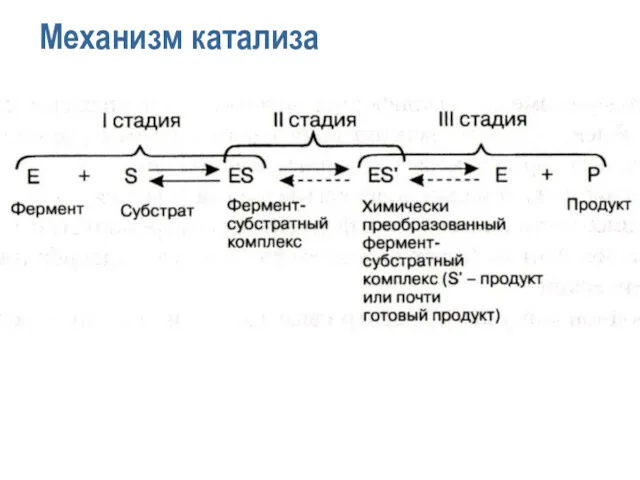
- 12. Механизм катализа
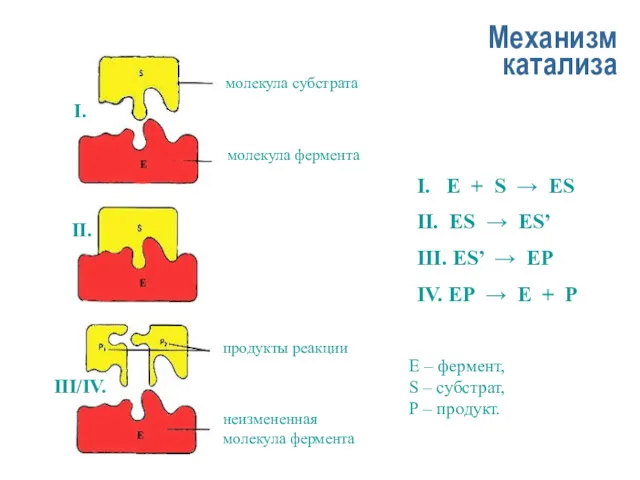
- 13. Механизм катализа I. E + S → ES II. ES → ES’ III. ES’ → EP
- 14. Механизм катализа (по типу взаимодействия) Кислотно-основный В активном центре фермента находятся специфические аминокислоты, являющиеся донорами или
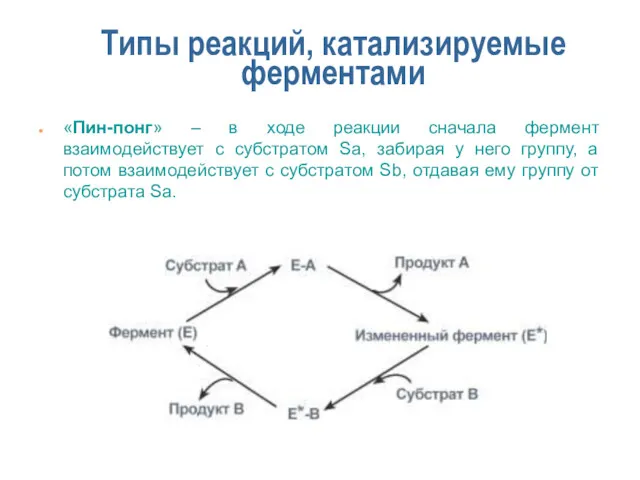
- 15. Типы реакций, катализируемые ферментами «Пин-понг» – в ходе реакции сначала фермент взаимодействует с субстратом Sa, забирая
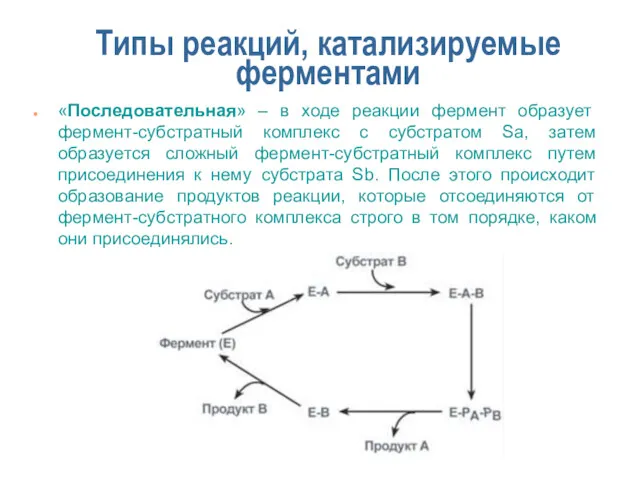
- 16. Типы реакций, катализируемые ферментами «Последовательная» – в ходе реакции фермент образует фермент-субстратный комплекс с субстратом Sa,
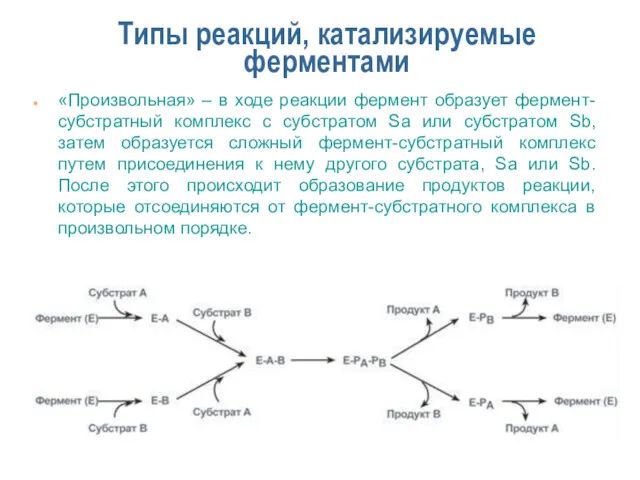
- 17. Типы реакций, катализируемые ферментами «Произвольная» – в ходе реакции фермент образует фермент-субстратный комплекс с субстратом Sa
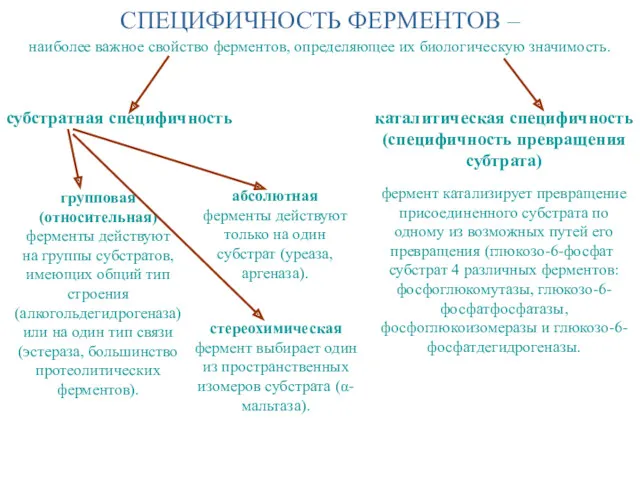
- 18. СПЕЦИФИЧНОСТЬ ФЕРМЕНТОВ – групповая (относительная) ферменты действуют на группы субстратов, имеющих общий тип строения (алкогольдегидрогеназа) или
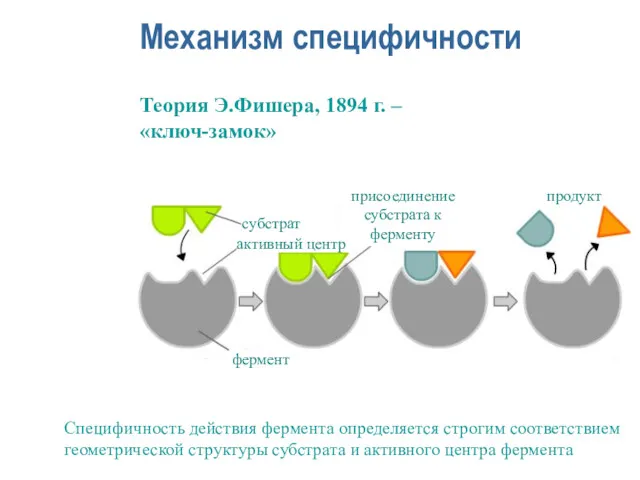
- 19. Механизм специфичности Теория Э.Фишера, 1894 г. – «ключ-замок» Специфичность действия фермента определяется строгим соответствием геометрической структуры
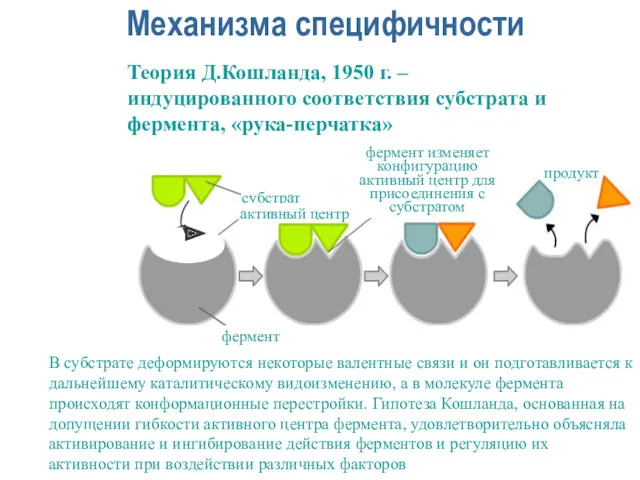
- 20. Механизма специфичности Теория Д.Кошланда, 1950 г. – индуцированного соответствия субстрата и фермента, «рука-перчатка» В субстрате деформируются
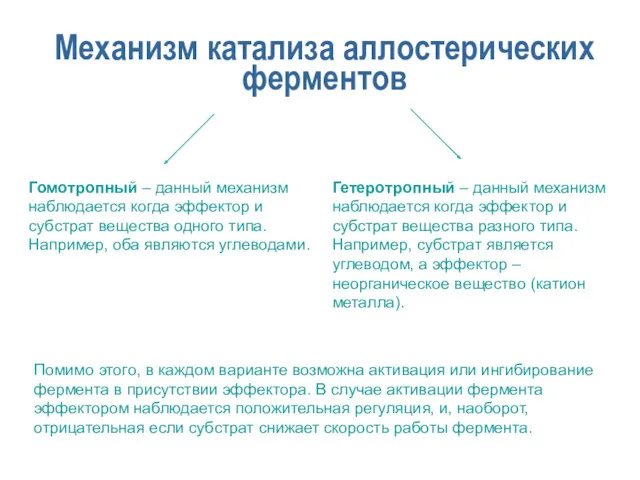
- 21. Механизм катализа аллостерических ферментов Гомотропный – данный механизм наблюдается когда эффектор и субстрат вещества одного типа.
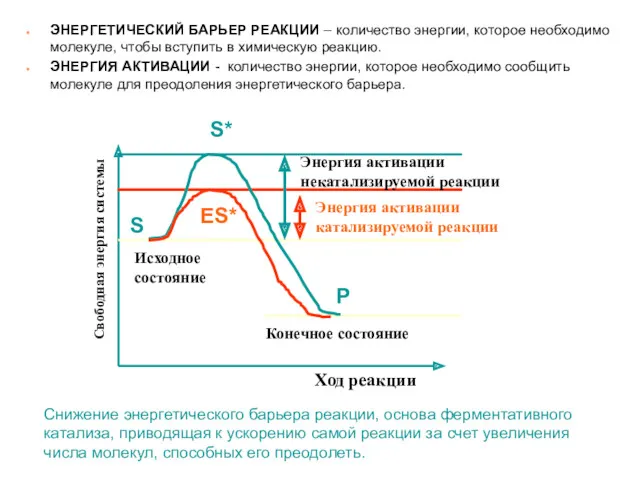
- 22. Энергетика ферментативных реакций Ферменты снижают энергию активации Скорость химической реакции зависит от концентрации реагирующих веществ В
- 23. Свободная энергия системы Ход реакции Исходное состояние Конечное состояние Энергия активации катализируемой реакции Энергия активации некатализируемой
- 24. Активность ферментов Активность фермента – это процесс преобразования субстрата в продукт, но при том необходимо учитывать
- 26. Скачать презентацию




 Клетка. Её состав, строение и жизнедеятельность
Клетка. Её состав, строение и жизнедеятельность Эволюция адаптации – основной результат действия естественного отбора
Эволюция адаптации – основной результат действия естественного отбора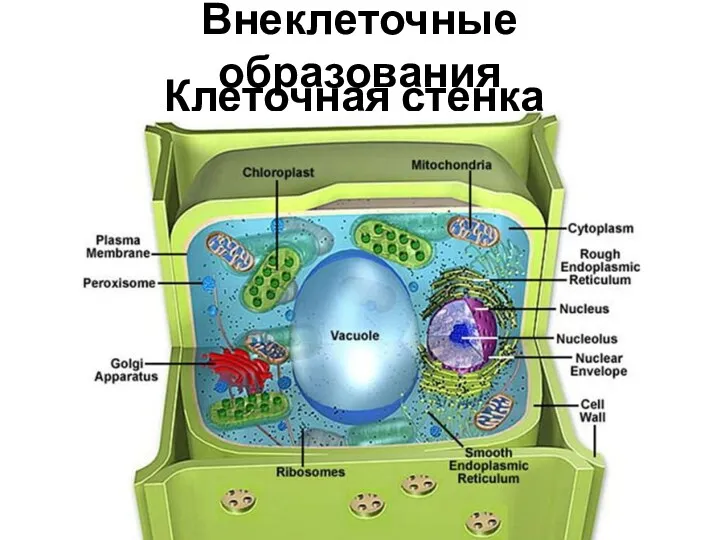 Внеклеточные образования. Клеточная стенка
Внеклеточные образования. Клеточная стенка Царство Вирусы
Царство Вирусы Why Aren’t Animals Human?
Why Aren’t Animals Human? Масти лошадей
Масти лошадей Отряд Лососеобразные
Отряд Лососеобразные Память и обучение
Память и обучение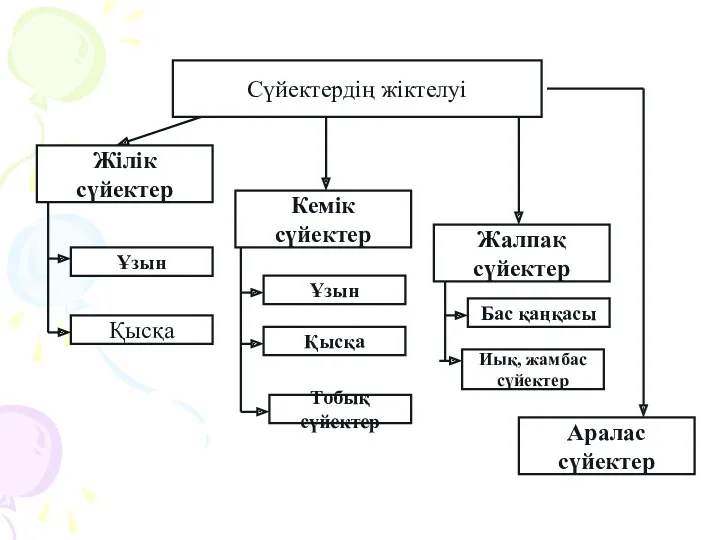 Сүйектердің жіктелуі
Сүйектердің жіктелуі Перелетные птицы
Перелетные птицы Безусловные и условные рефлексы
Безусловные и условные рефлексы Обмен белков. Источники и пути обезвреживания аммиака. (Лекция 15)
Обмен белков. Источники и пути обезвреживания аммиака. (Лекция 15) Осуществление закупок масличного сырья на условиях барьерной компании
Осуществление закупок масличного сырья на условиях барьерной компании Немного о дельфинах
Немного о дельфинах Серце у людини
Серце у людини Животные тундры. 4 класс
Животные тундры. 4 класс Зоологическая викторина
Зоологическая викторина Жири. Склад жирів, їх утворення. Жири у природі. Біологічна роль жирів
Жири. Склад жирів, їх утворення. Жири у природі. Біологічна роль жирів Исследование способностей джунгарского хомяка, как домашнего питомца
Исследование способностей джунгарского хомяка, как домашнего питомца Биологическая защита
Биологическая защита Отруйні гриби
Отруйні гриби Биология росомахи
Биология росомахи Соединения костей туловища
Соединения костей туловища Царства живой природы
Царства живой природы Ботаника
Ботаника Проект о животных Красной книги Свердловской области: есть ли у них будущее?
Проект о животных Красной книги Свердловской области: есть ли у них будущее? Биологически активные низкомолекулярные вещества
Биологически активные низкомолекулярные вещества Гречиха посевная
Гречиха посевная