Содержание
- 2. Химия ОС - наука о процессах, определяющих химический состав и свойства объектов ОС. Предметом ХОС являются
- 3. Задачи ХОС от решения которых зависит сохранение среды обитания: Оценка воздействия на ОС загрязняющих веществ. 2
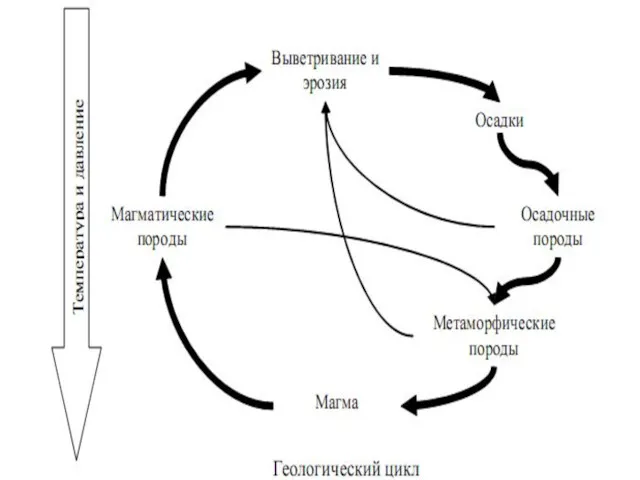
- 4. Основными природными факторами, обуславливающими изменения в ОС являются: I астрономические: - периодические изменения активности Солнца, а
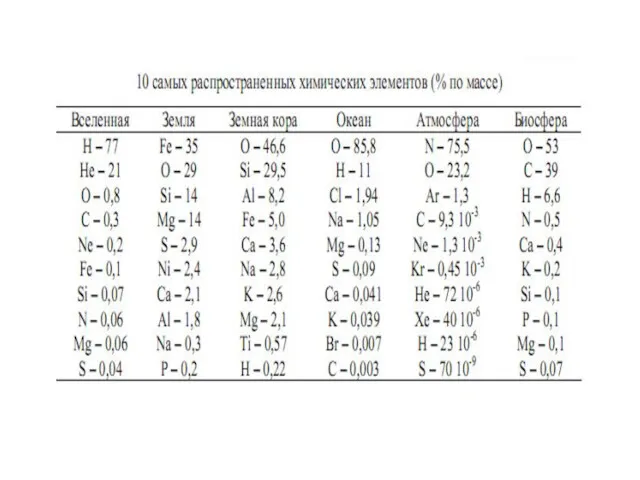
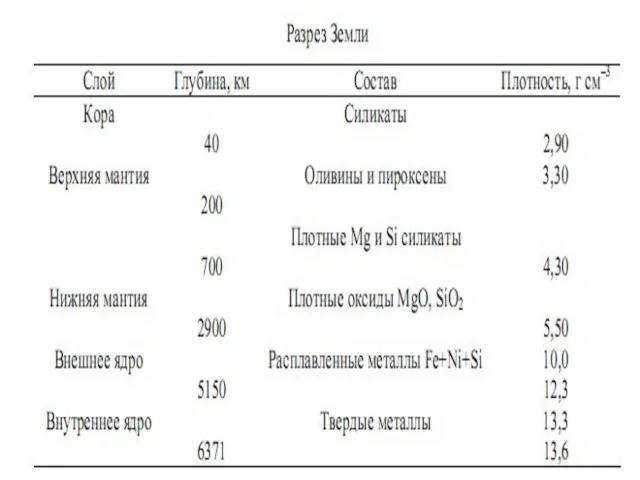
- 5. масса 6* 1021 т состоит из 88 различных химических элементов. Земля составные части: ядро, мантия, кора,
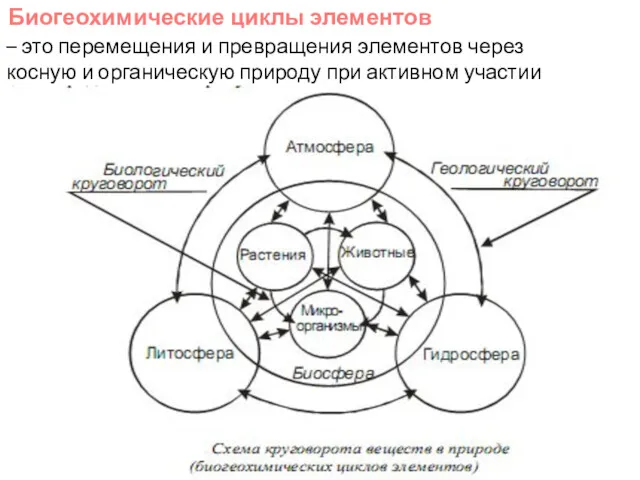
- 9. Биогеохимические циклы - перемещения и превращения веществ и элементов в природе под действием биологических и геологических
- 10. – это перемещения и превращения элементов через косную и органическую природу при активном участии живого вещества.
- 11. Фонды биогеохимических циклов: 1) резервный – большая масса медленно движущихся веществ, содержащих данный элемент, в основном
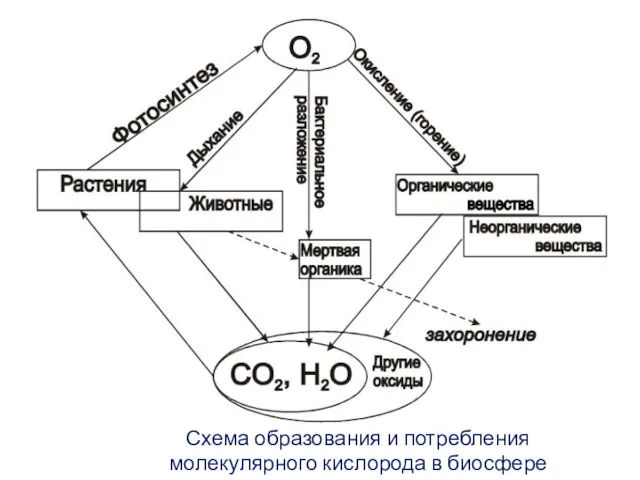
- 12. Кислород в природе находится: – В атмосфере в свободном (молекулярном и атомарном) виде, в виде озона,
- 13. Схема образования и потребления молекулярного кислорода в биосфере
- 14. Дыхание растений, животных, человека, выполнение микроорганизмами окислительных реакций расходует свободный кислород. Уравнение клеточного дыхания: Лишь 25
- 15. Ежегодное потребление кислорода составляет более 210-230 млрд т (из них 2,6 млрд т в год на
- 16. Особенности углерода – способность образовывать одинарные, кратные связи, соединяться в цепи и циклы; основа органических соединений
- 17. Биологический круговорот углерода Фотосинтез Клеточное дыхание В процессе фотосинтеза из углекислого газа и воды образуются органические
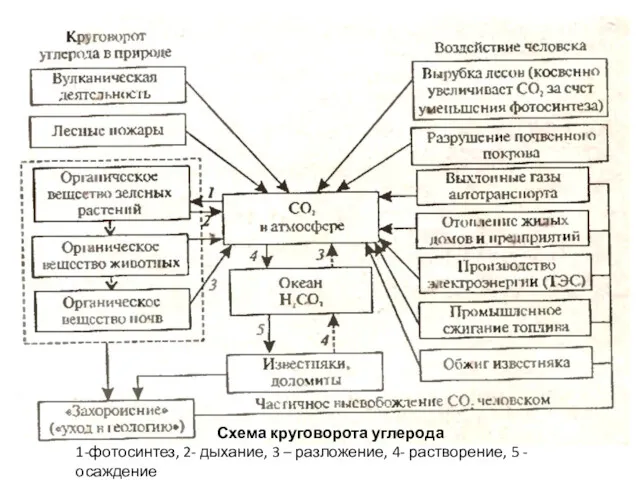
- 18. Глобальный круговорот углерода В глобальном круговороте углерода происходит: – растворение углекислого газа в Мировом океане и
- 19. Схема круговорота углерода 1-фотосинтез, 2- дыхание, 3 – разложение, 4- растворение, 5 - осаждение
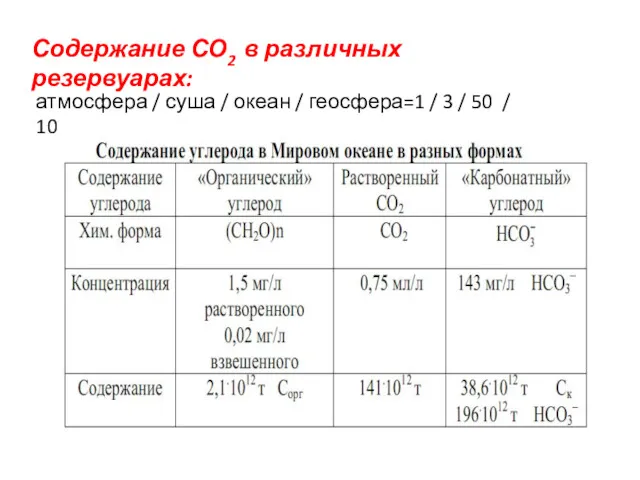
- 20. Содержание СО2 в различных резервуарах: атмосфера / суша / океан / геосфера=1 / 3 / 50
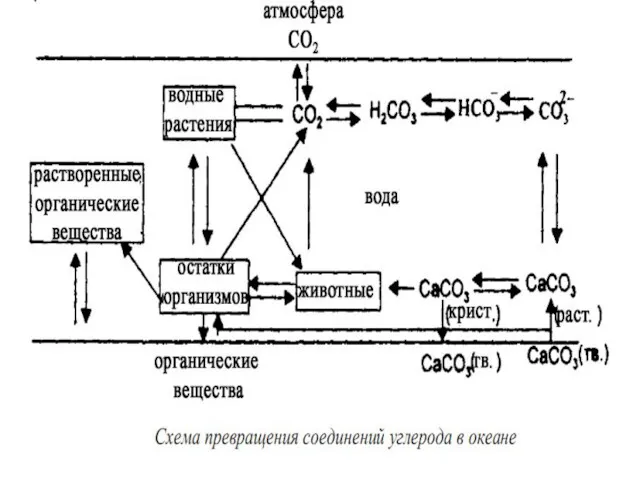
- 21. – при растворении углекислого газа в воде образуется слабая угольная кислота, которая диссоциирует ступенчато и образуется
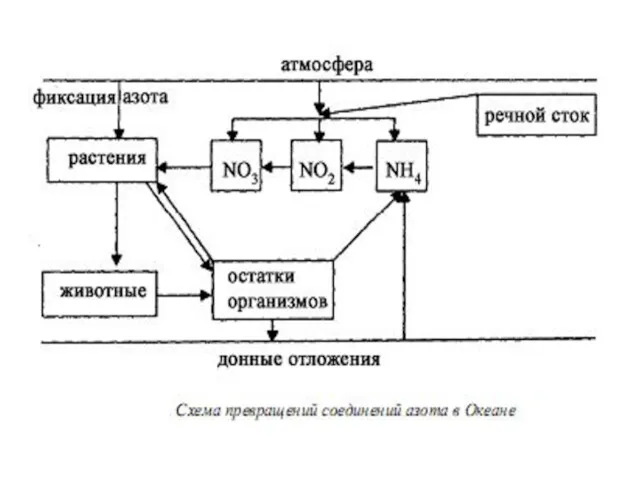
- 23. Азот в биосфере находится – В атмосфере в молекулярном виде, в виде оксидов, в составе сложных
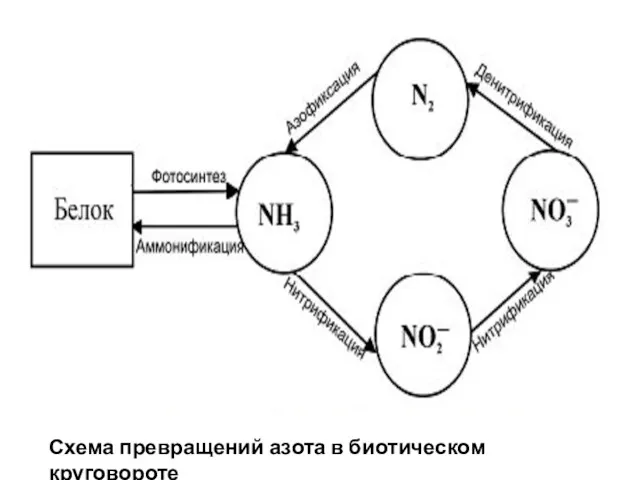
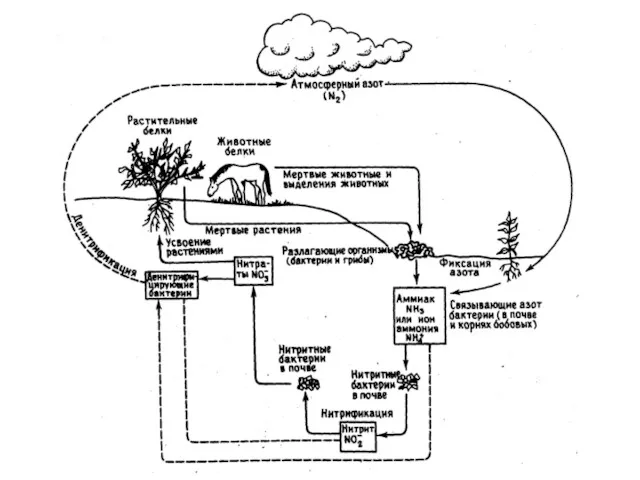
- 24. Схема превращений азота в биотическом круговороте
- 25. Азофиксация – превращение азота в азотные соединения, в усваиваемые растениями форму (NO3-) Небиологический механизм – молнии
- 26. Стадии распада белков: I. Расщепление белков до аминокислот микроорганизмами, вырабаты-вающими ферменты протеазы белки → пептоны →
- 27. Нитрификация – окисление аммиака до нитратов и нитритов при участии нитрифицирующих бактерий. Этот процесс протекает в
- 28. Безазотистые органические вещества окисляются за счет нитратов и нитритов, которые при этом восстанавливаются до газообразного азота,
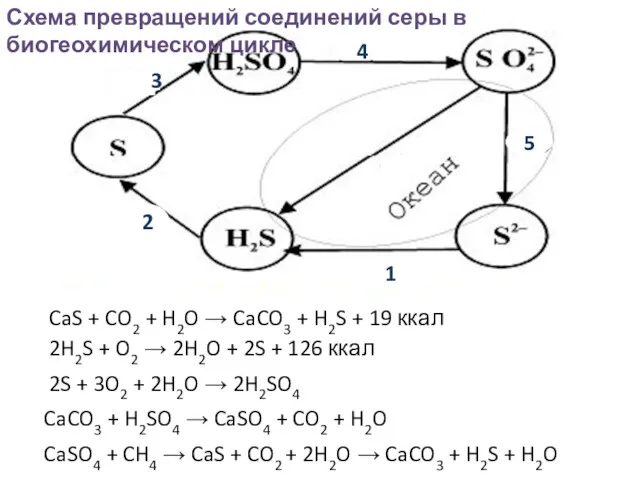
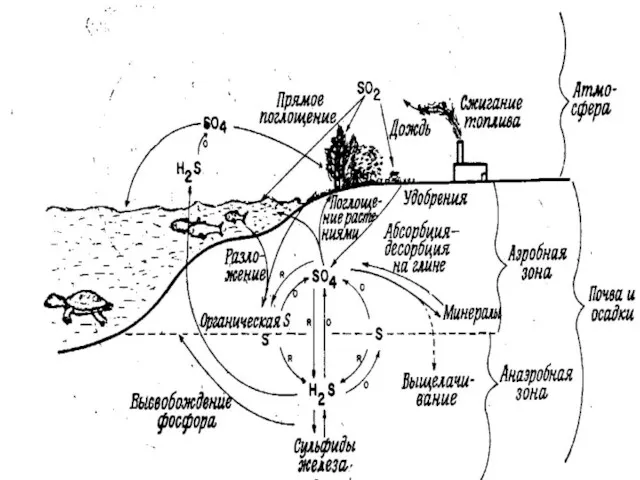
- 31. Сера в природе находится – В атмосфере в виде оксидов, сероводорода, растворенного SO42– в атмосферных осадках,
- 32. Основные черты биогеохимического круговорота серы: 1) обширный резервный фонд в почве и отложениях и меньший –
- 33. 4 1 3 1 Схема превращений соединений серы в биогеохимическом цикле CaS + CO2 + H2O
- 35. В биосфере фосфор находится: – В атмосфере – практически нет. – На суше в биомассе 5
- 37. Скачать презентацию





















 ЭкоТимуровцы. Проект
ЭкоТимуровцы. Проект 20 команда. Наш город
20 команда. Наш город Теоретические основы экологического образования дошкольников
Теоретические основы экологического образования дошкольников Экологическая характеристика групп растений по отношению к засолению почв
Экологическая характеристика групп растений по отношению к засолению почв Контроль и надзор в области природопользования и охраны природных ресурсов
Контроль и надзор в области природопользования и охраны природных ресурсов Ластану және қалдықтарды кәдеге жарату. Қолданыстан шыққан материалдарды қайта өңдеу мүмкіндіктері
Ластану және қалдықтарды кәдеге жарату. Қолданыстан шыққан материалдарды қайта өңдеу мүмкіндіктері Законы Российской Федерации о природоохранной деятельности. (Глава 14)
Законы Российской Федерации о природоохранной деятельности. (Глава 14) Инструктаж по обращению с отходами производства и потребления ОАО Северсталь-метиз
Инструктаж по обращению с отходами производства и потребления ОАО Северсталь-метиз Отходы деятельности человека, как ресурсы. (Лекция 1-5)
Отходы деятельности человека, как ресурсы. (Лекция 1-5) Greenpin. Экология начинается дома
Greenpin. Экология начинается дома The planet Earth
The planet Earth Исследование обезвреживания почв и шламов, загрязненных нефтепродуктами, с помощью микроорганизмов
Исследование обезвреживания почв и шламов, загрязненных нефтепродуктами, с помощью микроорганизмов Загрязнение пресных вод
Загрязнение пресных вод Экологическая экспертиза природных систем: принципы, модели, критерии оценки
Экологическая экспертиза природных систем: принципы, модели, критерии оценки Визуальные птицезащитные маркеры
Визуальные птицезащитные маркеры Загрязнение вод океана и последствия
Загрязнение вод океана и последствия Экология и биосфера
Экология и биосфера Современные проблемы науки в области защиты окружающей среды
Современные проблемы науки в области защиты окружающей среды Опыт работы ФГБУ Заповедное Приамурье в области охраны окружающей среды 2015-2018гг
Опыт работы ФГБУ Заповедное Приамурье в области охраны окружающей среды 2015-2018гг Без води нема життя
Без води нема життя Рациональное питание
Рациональное питание Пластиковая бомба
Пластиковая бомба Use of environmentally friendly technologies in railway transport
Use of environmentally friendly technologies in railway transport Экологические акции школьников
Экологические акции школьников Топырақ қорғау егіншілігіндегі арамшөптермен күресу ерекшеліктері. (Дәріс 14)
Топырақ қорғау егіншілігіндегі арамшөптермен күресу ерекшеліктері. (Дәріс 14) Значение летнего оздоровительного лагеря для экологического образования детей в интересах устойчивого развития
Значение летнего оздоровительного лагеря для экологического образования детей в интересах устойчивого развития Поколение эко. Направление - событийное волонтерство: экологическое. Новомосковск
Поколение эко. Направление - событийное волонтерство: экологическое. Новомосковск Проблема эксплуатации автомобилей
Проблема эксплуатации автомобилей