Содержание
- 2. Электролитами принято называть проводящие среды, в которых протекание электрического тока сопровождается переносом вещества. Носителями свободных зарядов
- 3. Основными представителями электролитов, широко используемыми в технике, являются водные растворы неорганических кислот, солей, оснований, щёлочей. Прохождение
- 4. Электролиз Это совокупность процессов, протекающих в растворе или расплаве электролита, при пропускании через него электрического тока.
- 5. ЭЛЕКТРОЛИТИЧЕСКАЯ ВАННА. Катод (-) Анод (+) Восстановление Окисление Электроды
- 6. Электрический ток в электролитах представляет собой перемещение ионов обоих знаков в противоположных направлениях. Положительные ионы движутся
- 7. Сущность электролиза В результате электролиза на электродах (катоде и аноде) выделяются соответствующие продукты восстановления и окисления,
- 8. Закон электролиза был экспериментально установлен английским физиком М. Фарадеем в 1833 году. Закон Фарадея определяет количества
- 9. * Электролитические процессы *классифицируются следующим образом: получение неорганических веществ(водорода, кислорода, хлора, щелочей и т.д.) получение металлов(литий,
- 13. Скачать презентацию
 Спектроскопические методы. Импульсные методы исследования. Тема 2.3
Спектроскопические методы. Импульсные методы исследования. Тема 2.3 Электрические переходы. Тема 2
Электрические переходы. Тема 2 Энергия топлева
Энергия топлева Простые механизмы
Простые механизмы Физика плазмы
Физика плазмы Аморфные тела
Аморфные тела Передаточные функции и структурные схемы бокового движения самолета (лекция 9)
Передаточные функции и структурные схемы бокового движения самолета (лекция 9) The Ideal Fluid (Liquid) Viscosity of a Liquid Laminar and Turbulent Flow
The Ideal Fluid (Liquid) Viscosity of a Liquid Laminar and Turbulent Flow Физика – наука о природе
Физика – наука о природе Магнитные свойства вещества
Магнитные свойства вещества Выталкивающая сила. Урок физики в 7 классе
Выталкивающая сила. Урок физики в 7 классе Лазер. Спонтанное (самопроизвольное) излучение
Лазер. Спонтанное (самопроизвольное) излучение Термодинамикалық функциялық ерітінділер құрамына тәуелділігі
Термодинамикалық функциялық ерітінділер құрамына тәуелділігі Работа и Мощность
Работа и Мощность Лазерное сканирование в строительстве (ЛС)
Лазерное сканирование в строительстве (ЛС) Материалдардың созылуын және сығылуын эксперимент арқылы зерттеу
Материалдардың созылуын және сығылуын эксперимент арқылы зерттеу Редукторы. Классификация и устройство редукторов. Планетарные, волновые и комбинированные редукторы
Редукторы. Классификация и устройство редукторов. Планетарные, волновые и комбинированные редукторы Презентация к уроку по теме Электромагнитная индукция 11 клас
Презентация к уроку по теме Электромагнитная индукция 11 клас Предельные отклонения на размеры деталей
Предельные отклонения на размеры деталей Закон сохранения импульса и механической энергии. Решение задач
Закон сохранения импульса и механической энергии. Решение задач Направление тока и направление линий его магнитного поля. (Урок 40)
Направление тока и направление линий его магнитного поля. (Урок 40) Элементы оптоэлектроники. Приборы с зарядовой связью. Светодиоды. (Лекция 14.2)
Элементы оптоэлектроники. Приборы с зарядовой связью. Светодиоды. (Лекция 14.2) Магнитное поле электрического тока
Магнитное поле электрического тока Ядерна енергетика та сучасний світ
Ядерна енергетика та сучасний світ интегрированный урок физика+математика
интегрированный урок физика+математика Физика Солнца
Физика Солнца Электромагниттік толқындар. Инфрақызыл сәулелер. Жылу инфрақызыл түсірістер
Электромагниттік толқындар. Инфрақызыл сәулелер. Жылу инфрақызыл түсірістер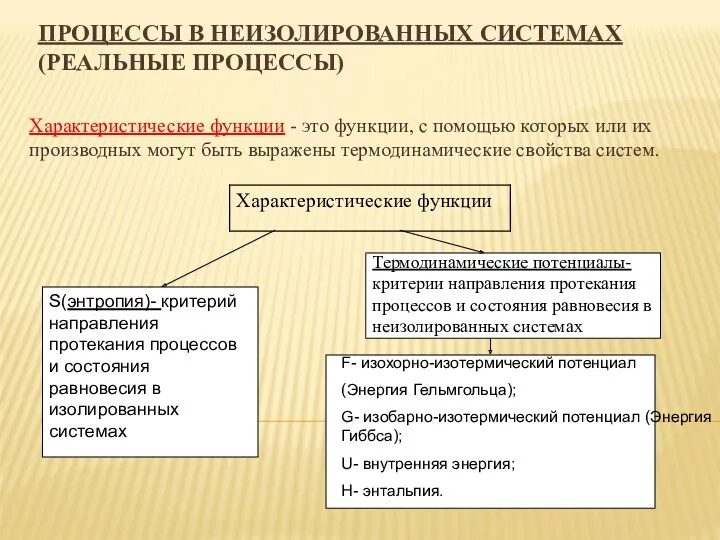 Процессы в неизолированных системах
Процессы в неизолированных системах