Содержание
- 2. Проблемні питання Як ви думаєте чи проводить вода електричний струм?
- 3. Електроліти – речовини, водні розчини або розплави яких проводять електричний струм. Електроліти Солей Лугів Кислот Водні
- 4. Електричний струм в електролітах Що відбувається в розчині електроліту коли електричне поле відсутнє?
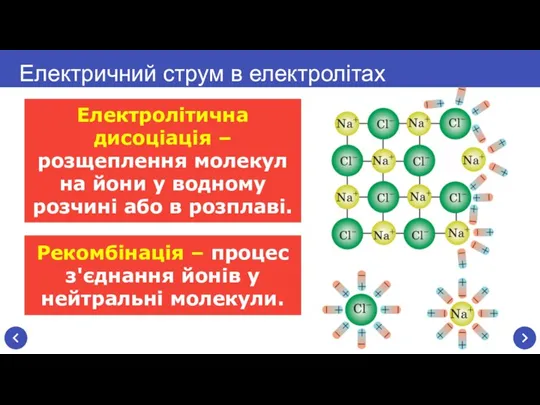
- 5. Електролітична дисоціація – розщеплення молекул на йони у водному розчині або в розплаві. Електричний струм в
- 6. Електричний струм в електролітах Що ж відбудеться, якщо в розчині електроліту створити електричне поле?
- 7. Електричний струм в електролітах – це напрямлений рух позитивних і негативних йонів. Електричний струм в електролітах
- 8. Електричний струм в електролітах Чи залежить опір електролітів від температури?
- 9. Опір зменшується Електричний струм в електролітах Нагріваємо електроліт Сила струму збільшується
- 10. Електроліз Що сталося із даними електродами під час проходження струму в електроліті?
- 11. Електроліз – це процес виділення речовин на електродах, пов'язаний з окисно-відновними реакціями, які відбуваються на електродах
- 12. Закон Фарадея Майкл Фарадей (1791-1867) Встановив кількісні співвідношення явища електролізу
- 13. k – електрохімічний еквівалент Перший закон Фарадея Маса речовини, яка виділяється на електроді, прямо пропорційна заряду,
- 14. Електрохімічний еквівалент чисельно дорівнює масі певної речовини, яка виділяється на електроді внаслідок проходження через електроліт заряду
- 15. Застосування електролізу Очищають метали (рафінування) Мідь Срібло
- 16. Застосування електролізу Одержують метали Алюміній Цинк Нікель
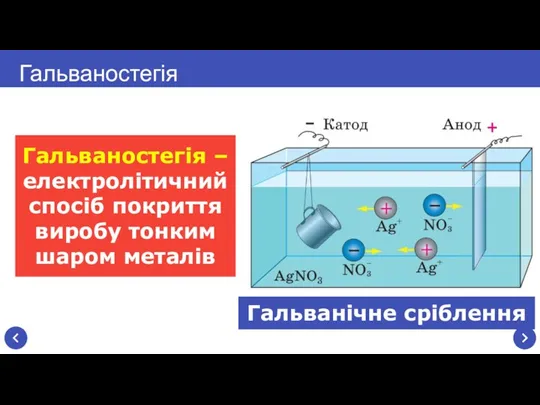
- 17. Гальванічне сріблення Гальваностегія – електролітичний спосіб покриття виробу тонким шаром металів Гальваностегія
- 19. Скачать презентацию














 Гидравлика. Закон Паскаля
Гидравлика. Закон Паскаля Изотопы. Радиоактивные превращения атомных ядер
Изотопы. Радиоактивные превращения атомных ядер Обобщающий урок по теме Давление, физика, 7 класс
Обобщающий урок по теме Давление, физика, 7 класс Квантование сигналов по уровню
Квантование сигналов по уровню Внутрицентровое поглощение света на примесных уровнях в ИК-диапазоне
Внутрицентровое поглощение света на примесных уровнях в ИК-диапазоне Принципы радиосвязи и телевидения
Принципы радиосвязи и телевидения Электрический ток в жидкостях
Электрический ток в жидкостях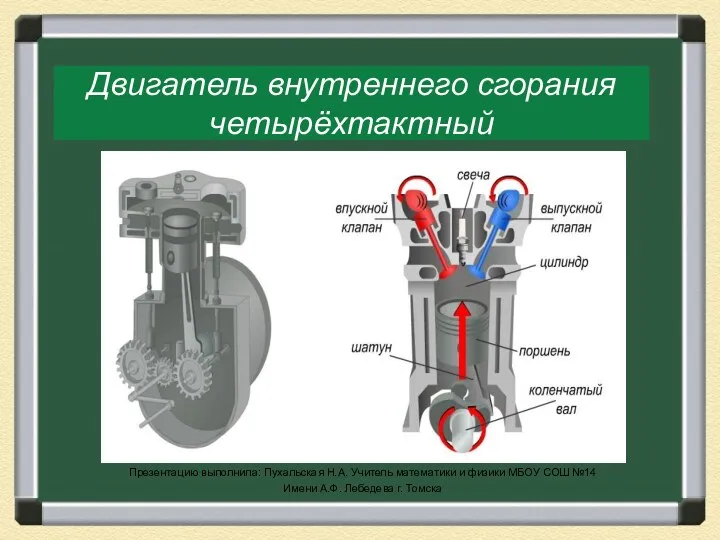 Двигатель внутреннего сгорания.
Двигатель внутреннего сгорания. Презентация к уроку по физике по теме Давление в твердых телах, жидкостях и газах
Презентация к уроку по физике по теме Давление в твердых телах, жидкостях и газах Презентация Основные положения МКТ
Презентация Основные положения МКТ Электрическое напряжение. Единицы напряжения. Вольтметр
Электрическое напряжение. Единицы напряжения. Вольтметр Статистическое описание системы частиц
Статистическое описание системы частиц Кристаллы, их структура, виды связей. Дефекты. Деформации твердого тела
Кристаллы, их структура, виды связей. Дефекты. Деформации твердого тела Дифракция света
Дифракция света Полупроводники. Собственная проводимость полупроводников. Полупроводниковые приборы
Полупроводники. Собственная проводимость полупроводников. Полупроводниковые приборы Исследование термодинамических процессов водяного пара. Смеси идеальных газов. Влажный воздух. (Занятие 5)
Исследование термодинамических процессов водяного пара. Смеси идеальных газов. Влажный воздух. (Занятие 5) Summary of effective use 6
Summary of effective use 6 Плотность вещества, плотность сплавов, нахождение объёма полости
Плотность вещества, плотность сплавов, нахождение объёма полости Субмикронная литография
Субмикронная литография Кинематика твердого тела введение
Кинематика твердого тела введение Подшипники скольжения и качения
Подшипники скольжения и качения Переработка и захоронение токсичных радиоактивных отходов
Переработка и захоронение токсичных радиоактивных отходов Эксплуатация и техническое обслуживание двигателя 8ЧСПН18/22
Эксплуатация и техническое обслуживание двигателя 8ЧСПН18/22 Судовые устройства. Классификация
Судовые устройства. Классификация Организация работ по монтажу, ремонту и наладке систем автоматизации, средств измерений и мехатронных систем
Организация работ по монтажу, ремонту и наладке систем автоматизации, средств измерений и мехатронных систем Последовательное соединение проводников
Последовательное соединение проводников Изобретение радио А.С. Поповым
Изобретение радио А.С. Поповым Аналогии физических свойств сегнетоэлектрических и ферромагнитных кристаллов
Аналогии физических свойств сегнетоэлектрических и ферромагнитных кристаллов