Содержание
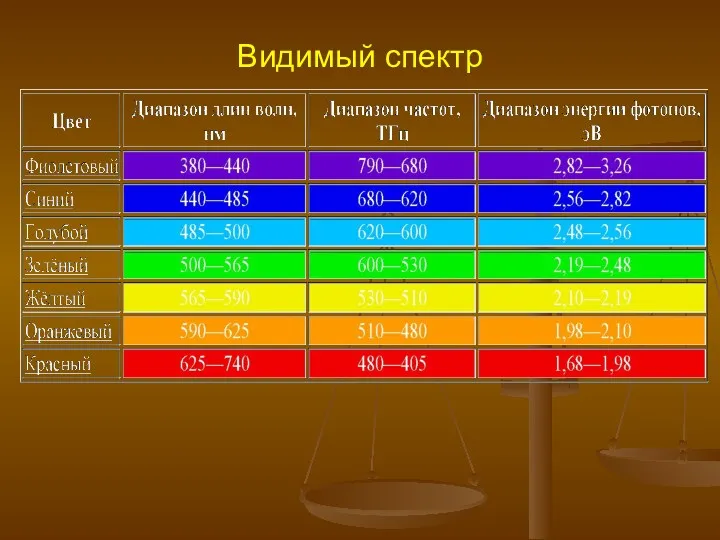
- 2. Видимый спектр
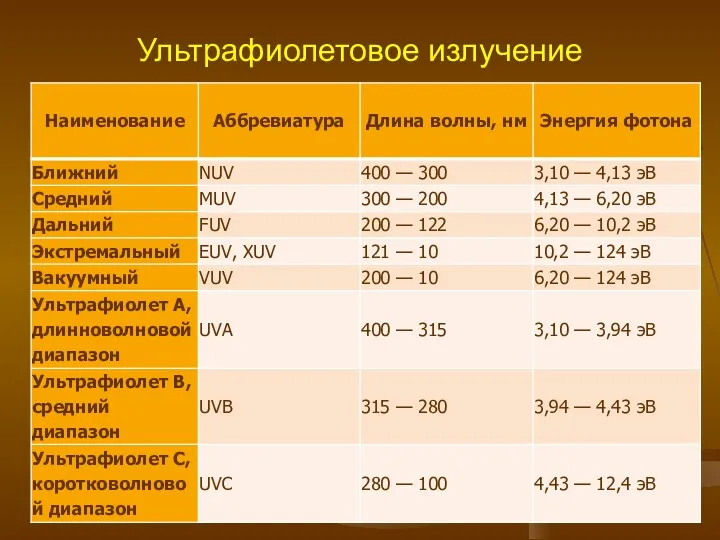
- 3. Ультрафиолетовое излучение
- 4. Рентгеновское излучение и γ-излучение от 0,1 нм до 0,01 нм — жёсткое рентгеновское излучение. Источники: некоторые
- 5. Отношение интенсивностей отраженной и падающей лучей называется коэффициентом отражения R электромагнитной волны от поверхности раздела двух
- 6. Если часть энергии падающей на вещество электромагнитной волны преобразуется во внутреннюю энергию вещества, то имеет место
- 7. Дисперсия – зависимость абсолютного показателя преломления вещества от частоты света. Например, разложение белого света при прохождении
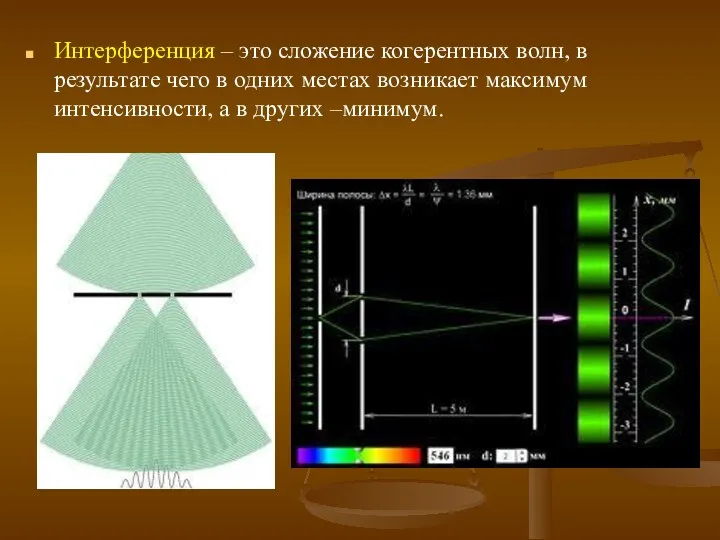
- 8. Интерференция – это сложение когерентных волн, в результате чего в одних местах возникает максимум интенсивности, а
- 9. Дифракция – огибание светом препятствий (например, при прохождении вблизи границ непрозрачных тел или через узкие щели
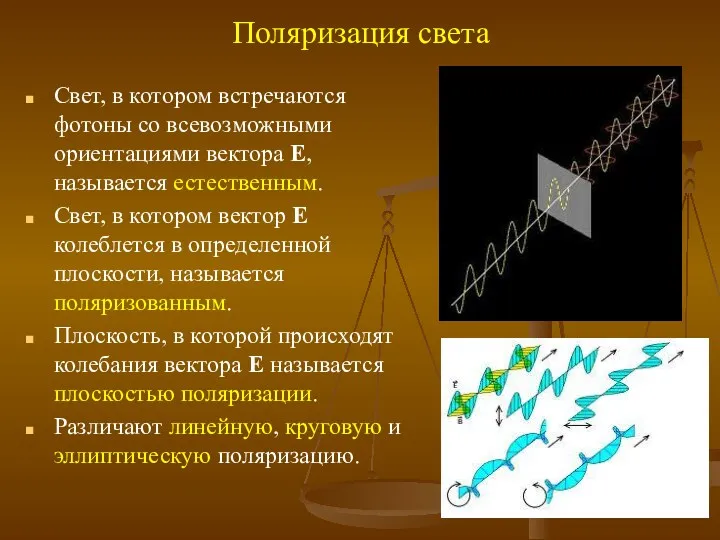
- 10. Поляризация света Свет, в котором встречаются фотоны со всевозможными ориентациями вектора Е, называется естественным. Свет, в
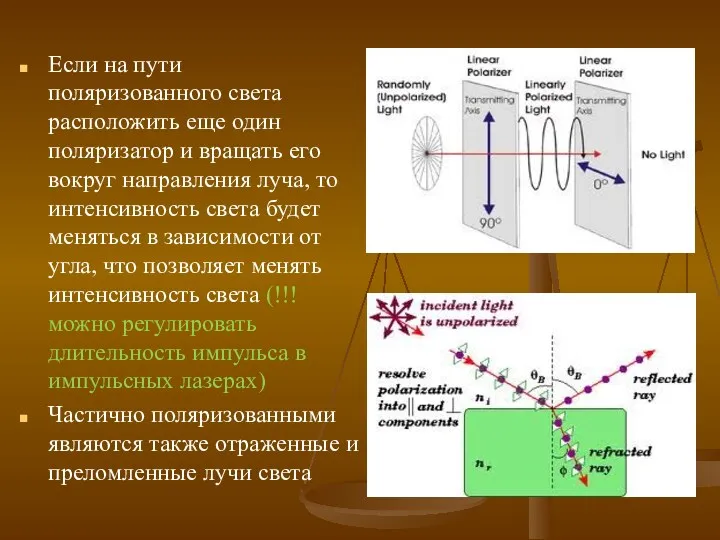
- 11. Если на пути поляризованного света расположить еще один поляризатор и вращать его вокруг направления луча, то
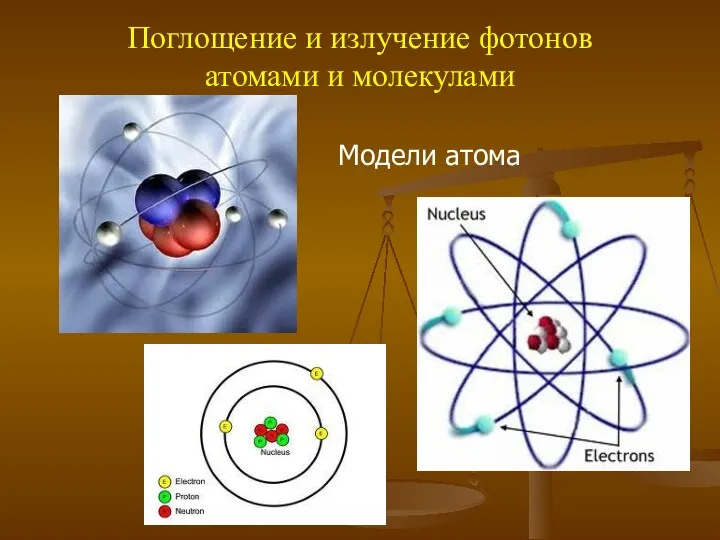
- 12. Поглощение и излучение фотонов атомами и молекулами Модели атома
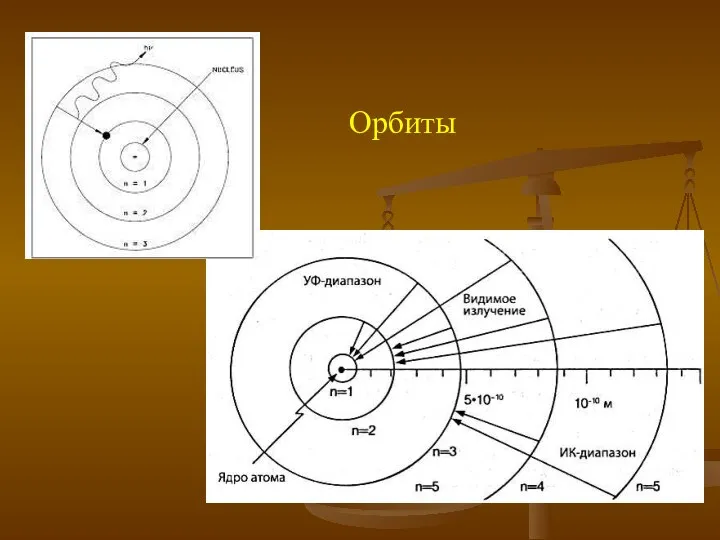
- 13. Орбиты
- 14. Уровни энергии Уровни энергии – возможные значения энергии квантовых систем (электронов, протонов, ядер, атомов, молекул и
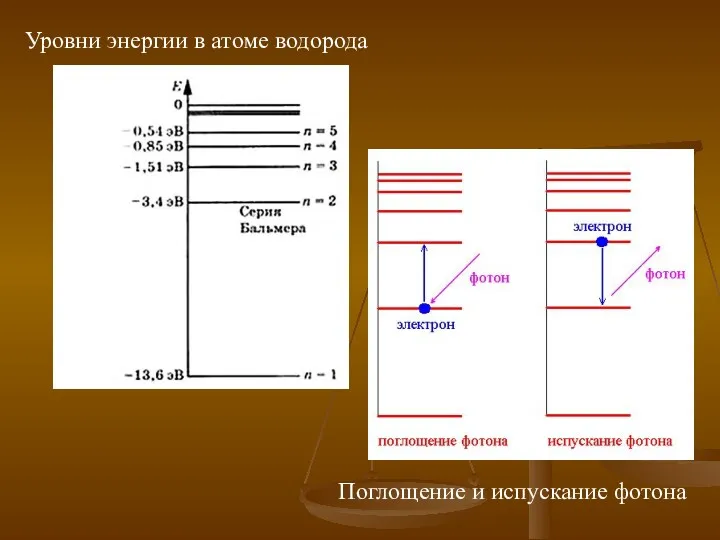
- 15. Уровни энергии в атоме водорода Поглощение и испускание фотона
- 16. Квантовые числа Для нахождения возможных состояний электрона в атоме каждая атомная орбиталь однозначно характеризуется набором из
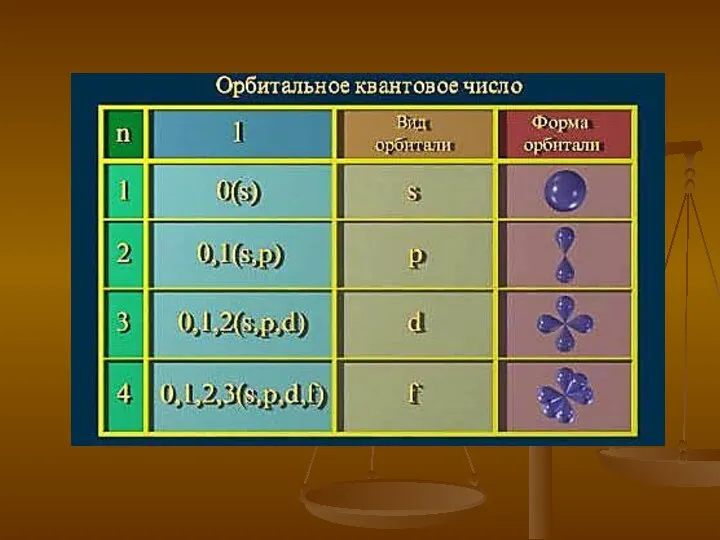
- 17. Орбитальное квантовое число l может принимать любые целочисленные значения от нуля до n–1 и определяет орбитальный
- 19. Магнитное квантовое число m может принимать любые целочисленные значения от – l до + l, включая
- 20. Спиновое квантовое число s для электрона может принимать только два значения: 1/2 и –1/2 В результате
- 22. Скачать презентацию










 Основи молекулярно - кінетичної теорії газів (лекція 6)
Основи молекулярно - кінетичної теорії газів (лекція 6) Что изучает физика
Что изучает физика Теплотехнические схемы парогенераторов АЭС
Теплотехнические схемы парогенераторов АЭС Ремонт системы питания КамАЗ 4326
Ремонт системы питания КамАЗ 4326 Механическое движение. Материальная точка. Система отсчета
Механическое движение. Материальная точка. Система отсчета Типовые детали машин
Типовые детали машин Расчет и проектирование элементов механического измельчения отходов
Расчет и проектирование элементов механического измельчения отходов Молекулярная физика. Молекулярно-кинетическая теория. Масса и размеры молекул
Молекулярная физика. Молекулярно-кинетическая теория. Масса и размеры молекул Равномерное движение по окружности. Решение задач.
Равномерное движение по окружности. Решение задач. Физика пласта. Подземная нефтегидродинамика
Физика пласта. Подземная нефтегидродинамика Исследовательский проект Машина Голдберга Разбивалка яйиц
Исследовательский проект Машина Голдберга Разбивалка яйиц Физические основы механики. Физика в познании вещества, поля, пространства и времени
Физические основы механики. Физика в познании вещества, поля, пространства и времени Звук и его характеристики
Звук и его характеристики Сравнительная характеристика полупроводниковых материалов
Сравнительная характеристика полупроводниковых материалов Общие сведения об устройствах получения информации о процессе
Общие сведения об устройствах получения информации о процессе Lektsia_9_Difraktsia_Frenelya
Lektsia_9_Difraktsia_Frenelya Электромагнитные волны и их свойства. Шкала электромагнитных волн
Электромагнитные волны и их свойства. Шкала электромагнитных волн Озоновый слой атмосферы и озоновые дыры
Озоновый слой атмосферы и озоновые дыры Преломление света. 8 класс
Преломление света. 8 класс Сообщающиеся сосуды
Сообщающиеся сосуды Елементи теорії поля. (Лекція 10)
Елементи теорії поля. (Лекція 10) Материалы с особыми электрическими свойствами
Материалы с особыми электрическими свойствами Процесс ремонтной окраски Mazda 46G
Процесс ремонтной окраски Mazda 46G Дисперсия света
Дисперсия света Методы исследования переключения в сегнетоэлектриках. Микроскопия
Методы исследования переключения в сегнетоэлектриках. Микроскопия Bosch Airless SCR System
Bosch Airless SCR System Электромагнитная совместимость
Электромагнитная совместимость Оптические явления. Урок для 8 класса
Оптические явления. Урок для 8 класса